化学实验装置的选取与连接
图片预览


文档简介
(共21张PPT)
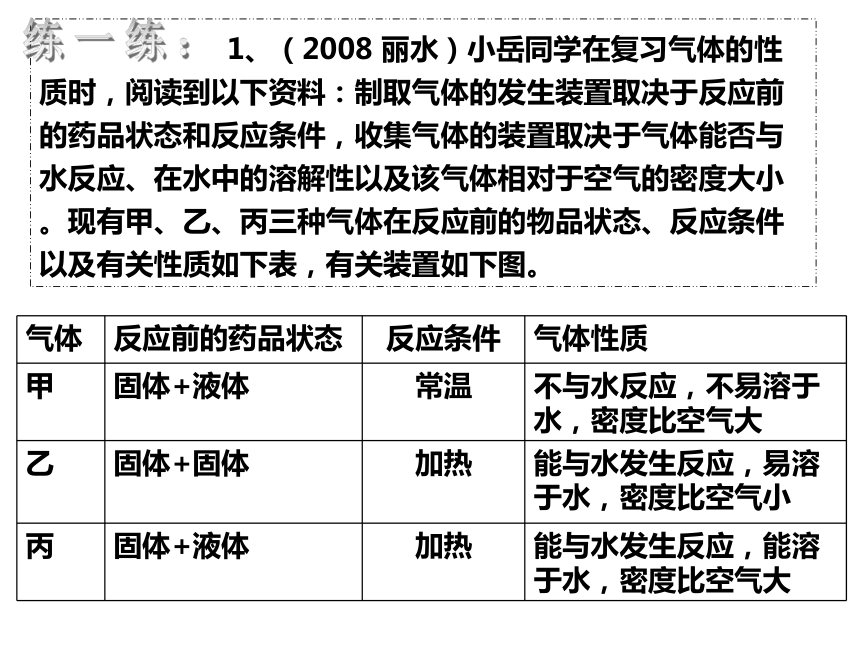
1、(2008 丽水)小岳同学在复习气体的性质时,阅读到以下资料:制取气体的发生装置取决于反应前的药品状态和反应条件,收集气体的装置取决于气体能否与水反应、在水中的溶解性以及该气体相对于空气的密度大小。现有甲、乙、丙三种气体在反应前的物品状态、反应条件以及有关性质如下表,有关装置如下图。
气体 反应前的药品状态 反应条件 气体性质
甲 固体+液体 常温 不与水反应,不易溶于水,密度比空气大
乙 固体+固体 加热 能与水发生反应,易溶于水,密度比空气小
丙 固体+液体 加热 能与水发生反应,能溶于水,密度比空气大
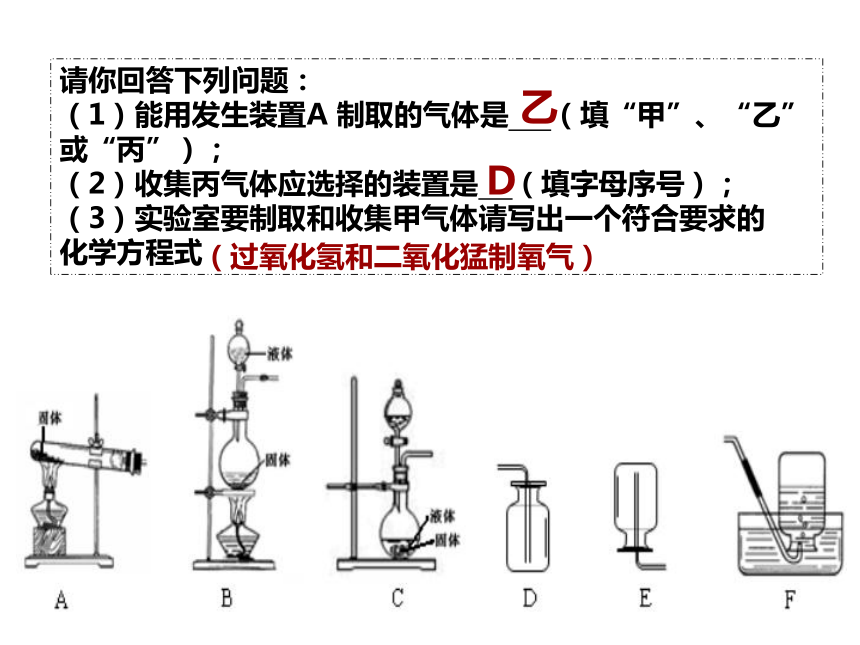
请你回答下列问题:
(1)能用发生装置A 制取的气体是 (填“甲”、“乙”或“丙”);
(2)收集丙气体应选择的装置是 (填字母序号);
(3)实验室要制取和收集甲气体请写出一个符合要求的
化学方程式
乙
D
(过氧化氢和二氧化猛制氧气)
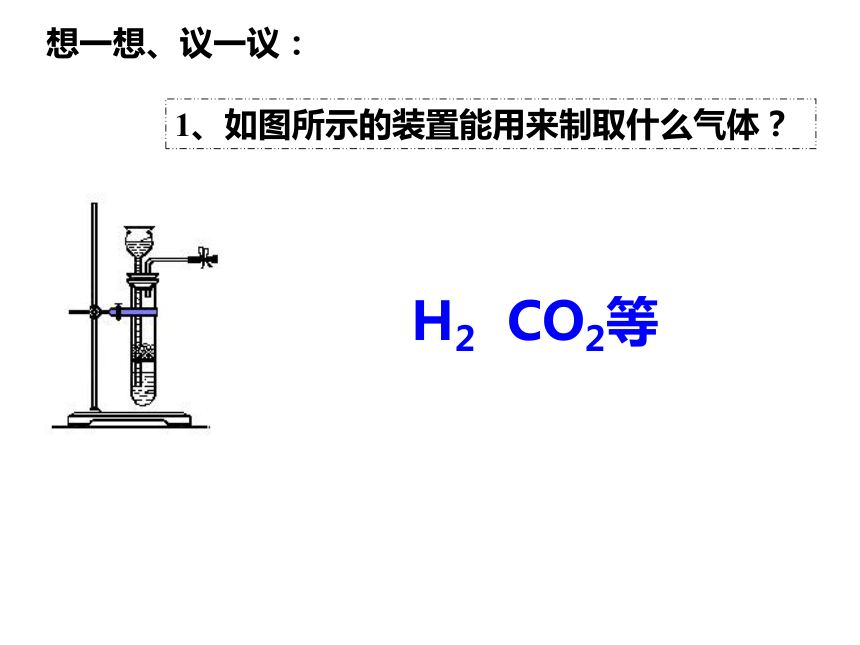
1、如图所示的装置能用来制取什么气体?
H2 CO2等
想一想、议一议:
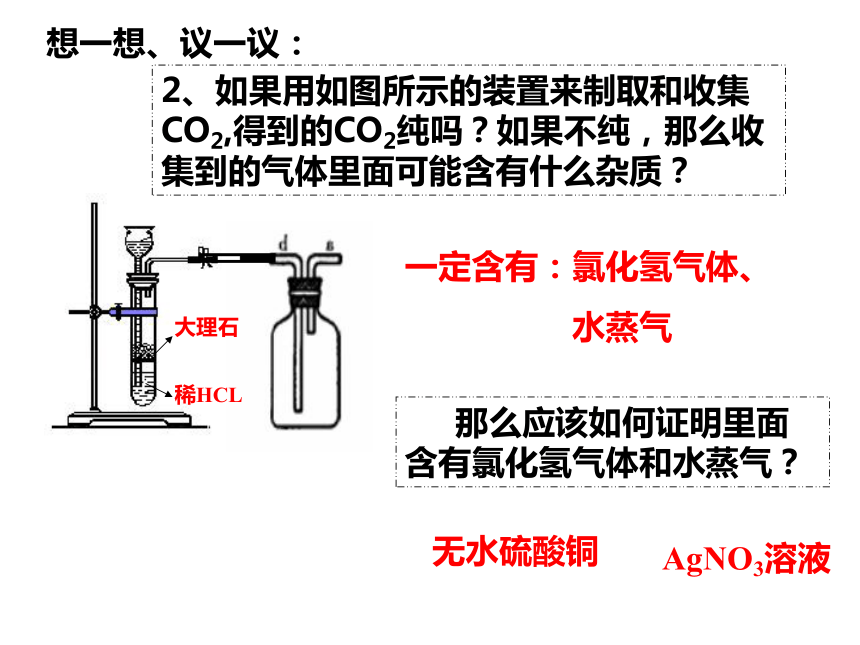
2、如果用如图所示的装置来制取和收集CO2,得到的CO2纯吗?如果不纯,那么收集到的气体里面可能含有什么杂质?
大理石
稀HCL
那么应该如何证明里面含有氯化氢气体和水蒸气?
一定含有:氯化氢气体、
水蒸气
无水硫酸铜
AgNO3溶液
想一想、议一议:
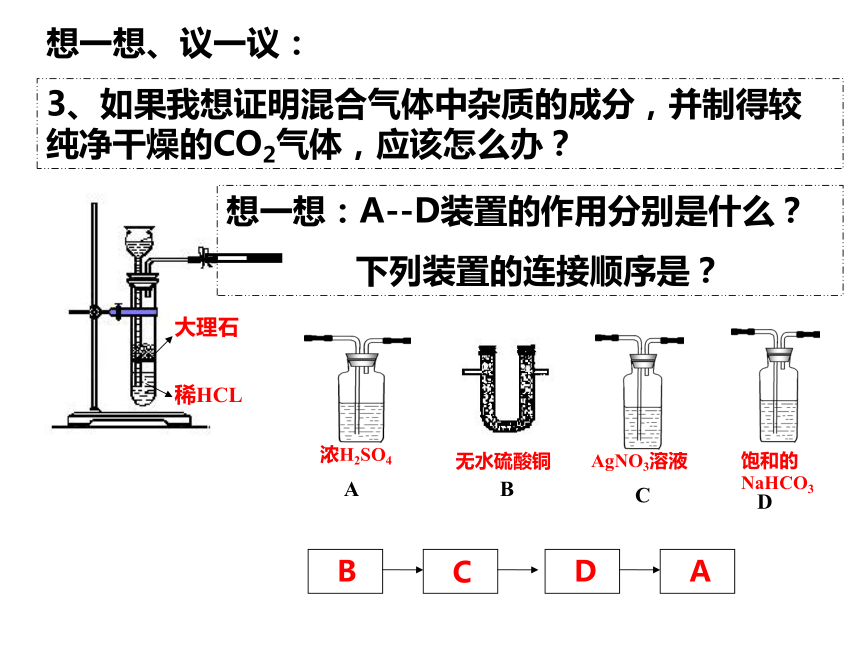
3、如果我想证明混合气体中杂质的成分,并制得较纯净干燥的CO2气体,应该怎么办?
浓H2SO4
A
无水硫酸铜
B
AgNO3溶液
C
饱和的NaHCO3
D
B
C
D
A
大理石
稀HCL
想一想:A--D装置的作用分别是什么?
下列装置的连接顺序是?
想一想、议一议:
小结:
1、先证明 后除杂 最后干燥
2、如果有水蒸气的一般最先证明 最后除去
①所用的吸收剂只能吸收气体中的杂质;
②不能与被提纯的物质反应,也不能引入新的杂质。
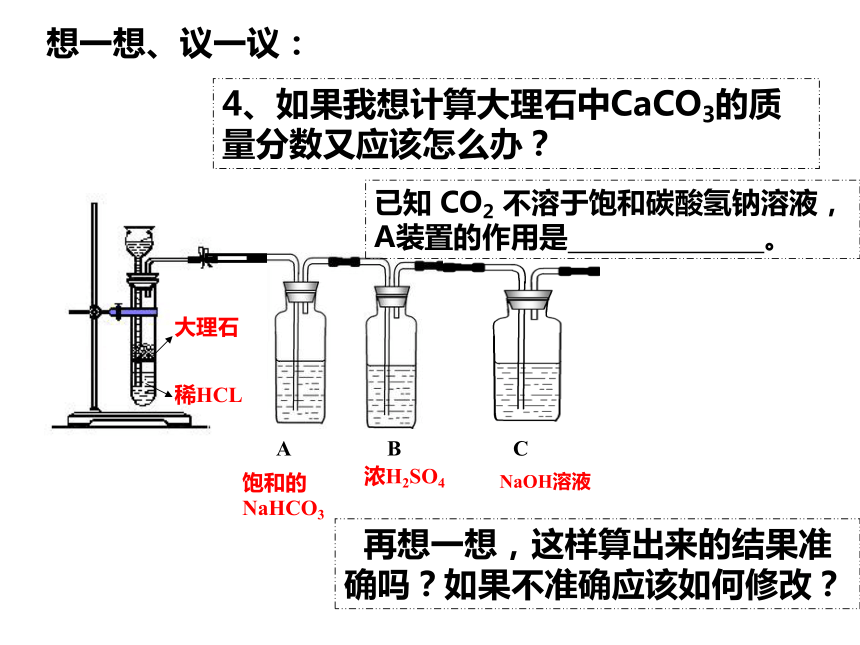
4、如果我想计算大理石中CaCO3的质量分数又应该怎么办?
NaOH溶液
浓H2SO4
再想一想,这样算出来的结果准确吗?如果不准确应该如何修改?
大理石
稀HCL
A B
C
饱和的NaHCO3
想一想、议一议:
已知 CO2 不溶于饱和碳酸氢钠溶液,
A装置的作用是 。
实验改进
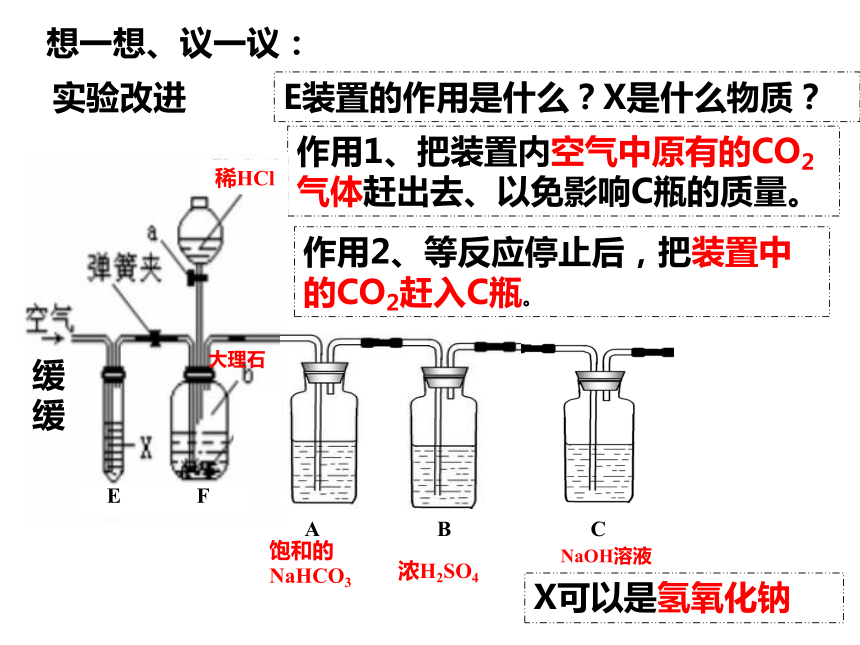
E装置的作用是什么?X是什么物质?
作用1、把装置内空气中原有的CO2气体赶出去、以免影响C瓶的质量。
C
X可以是氢氧化钠
稀HCl
大理石
NaOH溶液
浓H2SO4
饱和的NaHCO3
E F
C
A B
作用2、等反应停止后,把装置中 的CO2赶入C瓶。
想一想、议一议:
缓缓
实验改进
C
稀HCl
大理石
NaOH溶液
浓H2SO4
饱和的NaHCO3
E F
C
A B
这样改了还有问题吗?
D
D的作用是防止空气中的CO2和水蒸气进入C瓶
想一想、议一议:
顺序:1、先通一会空气,然后再接上C装置。
2、然后再打开活塞a,等反应停止后再通一会空气。
实验装置的选取与连接探究题的分类及步骤
1、检验:混合气体中有什么成份。
2、除杂:把混合气体中不需用的成分除去。(装置中某种
成份的作用 如:浓硫酸、饱和碳酸氢钠等)
3、干燥:得到纯净干燥的气体。
4、计算:通过实验中测得的一些数据来计算反应物的纯度等问题。
1、仪器中原有的气体(一般是空气)会不会对实验结果
造成干扰,如果会的必须先除去。
2、对造成计算结果偏大偏小问题的原因进行分析。
3、防止装置最后的倒吸问题(一般是空气中的某种成分)。
4、尾气处理问题。
小
结
注
意
3、某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为 A克;③准确称得B克的纯碱样品放入容器 b中;④连接装置;⑤打开分液漏斗 a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑥打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为 C 克。试回答:
⑴若⑤⑥两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”);
⑵步骤⑥的目的是 ,装置A中试剂可选用 ;
⑶若没有C装置,则会导致测定结果 (填“偏大”或“偏小”);
⑷E装置的作用是 ;
⑸某同学认为此实验还缺少一个步骤,会影响实验结果。你认为缺少的
步骤是 。
增加这步骤目的是
。 ?
偏小
把装置中的二氧化碳气体赶到D装置中去
氢氧化钠
防止外界的水蒸气或二氧化碳被D吸收
连接D之前先通一会经过处理的空气
赶出装置内的二氧化碳,避免装置内原有的二氧化碳影响实验结果
偏大
4、某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原,例如:
PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的
金属钯,此反应 也可用来检测微量CO的存在。
多孔隔板
请回答下列问题:
(1)通常实验室制取CO2气体的化学方程式是 ,
为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___ (填写 “Ⅰ”、“Ⅱ”或“”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________ 。
(2)观察实验装置图可知Na与CO2反应的条件是____。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是_ ,待装置 (填写字母)中出现
现象时,再点燃酒精喷灯,这步操作的目的是
。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Ⅲ
饱和NaHCO3
浓H2SO4
高温
扭开装置Ⅲ中导气管活塞
E
澄清的石灰水变浑浊
排出该装置中的空气
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:① 若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
② 若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的
化学方程式是 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由 。
4Na + 3CO2
2Na2CO3 + C
2Na + 2CO2
Na2CO3 + CO
生成正盐。因为根据质量守恒定律可知,反应物共有三种元素,没有氢元素因此不能生成酸式盐。(或:生成正盐。因为高温条件下碳酸氢钠不存在)
1、有一混合气体,可能由H2、CO、CO2中的一种或几种组成,若将混合气体通过下图所示装置,试回答(假定每一步均完全反应):
混合气体
⑴图示装置能测定哪些气体的存在与否?
⑵若要能测定所有气体的存在与否,应添加什么装置?
⑶判定H2、CO、CO2各气体存在的依据是什么?
2、神舟六号载人飞船成功返航,标志着我国已跨入航天领域国际领先行列。某研究性学习小组查阅资料得知,宇宙飞船中可用超氧化钾(KO2)作为氧气再生剂。超氧化钾是一种固体,它与人呼出的二氧化碳反应生成氧气:4KO2 + 2CO2 == K2CO3 + 302
为了验证这个反应能够产生氧气,该小组同学以大理石和盐酸反应生成的CO2来与KO2反应制取O2,设计了如下实验装置:
(1)C 处应从 A、B两种装置中选择 作 CO2发生装置。检验 G中集气瓶内收集的气体是否为氧气,可以在取出集气瓶后,用 检验。
(2)已知 CO2 不溶于饱和碳酸氢钠溶液,D装置的
作用是 。
(3)为了除去 O2 中可能混有的 CO2 ,F 中可盛放过量
溶液。
(4)有同学提出,上述实验能生成氧气可能与 CO2 中混有的水蒸气有关。若要检验干燥的 CO2能否与超氧化钾反应生成氧气,你对上述实验装置的改进方法是 。
实验装置的选取与连接探究题的分类及步骤
1、检验:混合气体中有什么成份。
2、除杂:把混合气体中不需用的成分除去。(装置中某种
成份的作用 如:浓硫酸、饱和碳酸氢钠等)
3、干燥:得到纯净干燥的气体。
4、计算:通过实验中测得的一些数据来计算反应物的纯度等问题。
1、仪器中原有的气体(一般是空气)会不会对实验结果
造成干扰,如果会的必须先除去。
2、对造成计算结果偏大偏小问题的原因进行分析。
3、防止装置最后的倒吸问题(一般是空气中的某种成分)。
4、尾气处理问题。
小
结
注
意
1、(2008 丽水)小岳同学在复习气体的性质时,阅读到以下资料:制取气体的发生装置取决于反应前的药品状态和反应条件,收集气体的装置取决于气体能否与水反应、在水中的溶解性以及该气体相对于空气的密度大小。现有甲、乙、丙三种气体在反应前的物品状态、反应条件以及有关性质如下表,有关装置如下图。
气体 反应前的药品状态 反应条件 气体性质
甲 固体+液体 常温 不与水反应,不易溶于水,密度比空气大
乙 固体+固体 加热 能与水发生反应,易溶于水,密度比空气小
丙 固体+液体 加热 能与水发生反应,能溶于水,密度比空气大
请你回答下列问题:
(1)能用发生装置A 制取的气体是 (填“甲”、“乙”或“丙”);
(2)收集丙气体应选择的装置是 (填字母序号);
(3)实验室要制取和收集甲气体请写出一个符合要求的
化学方程式
乙
D
(过氧化氢和二氧化猛制氧气)
1、如图所示的装置能用来制取什么气体?
H2 CO2等
想一想、议一议:
2、如果用如图所示的装置来制取和收集CO2,得到的CO2纯吗?如果不纯,那么收集到的气体里面可能含有什么杂质?
大理石
稀HCL
那么应该如何证明里面含有氯化氢气体和水蒸气?
一定含有:氯化氢气体、
水蒸气
无水硫酸铜
AgNO3溶液
想一想、议一议:
3、如果我想证明混合气体中杂质的成分,并制得较纯净干燥的CO2气体,应该怎么办?
浓H2SO4
A
无水硫酸铜
B
AgNO3溶液
C
饱和的NaHCO3
D
B
C
D
A
大理石
稀HCL
想一想:A--D装置的作用分别是什么?
下列装置的连接顺序是?
想一想、议一议:
小结:
1、先证明 后除杂 最后干燥
2、如果有水蒸气的一般最先证明 最后除去
①所用的吸收剂只能吸收气体中的杂质;
②不能与被提纯的物质反应,也不能引入新的杂质。
4、如果我想计算大理石中CaCO3的质量分数又应该怎么办?
NaOH溶液
浓H2SO4
再想一想,这样算出来的结果准确吗?如果不准确应该如何修改?
大理石
稀HCL
A B
C
饱和的NaHCO3
想一想、议一议:
已知 CO2 不溶于饱和碳酸氢钠溶液,
A装置的作用是 。
实验改进
E装置的作用是什么?X是什么物质?
作用1、把装置内空气中原有的CO2气体赶出去、以免影响C瓶的质量。
C
X可以是氢氧化钠
稀HCl
大理石
NaOH溶液
浓H2SO4
饱和的NaHCO3
E F
C
A B
作用2、等反应停止后,把装置中 的CO2赶入C瓶。
想一想、议一议:
缓缓
实验改进
C
稀HCl
大理石
NaOH溶液
浓H2SO4
饱和的NaHCO3
E F
C
A B
这样改了还有问题吗?
D
D的作用是防止空气中的CO2和水蒸气进入C瓶
想一想、议一议:
顺序:1、先通一会空气,然后再接上C装置。
2、然后再打开活塞a,等反应停止后再通一会空气。
实验装置的选取与连接探究题的分类及步骤
1、检验:混合气体中有什么成份。
2、除杂:把混合气体中不需用的成分除去。(装置中某种
成份的作用 如:浓硫酸、饱和碳酸氢钠等)
3、干燥:得到纯净干燥的气体。
4、计算:通过实验中测得的一些数据来计算反应物的纯度等问题。
1、仪器中原有的气体(一般是空气)会不会对实验结果
造成干扰,如果会的必须先除去。
2、对造成计算结果偏大偏小问题的原因进行分析。
3、防止装置最后的倒吸问题(一般是空气中的某种成分)。
4、尾气处理问题。
小
结
注
意
3、某纯碱样品中含有少量氯化钠杂质,现用下图所示装置来测定纯碱样品中碳酸钠的质量分数(铁架台、铁夹等在图中均已略去)。实验步骤如下:①按图连接装置,并检查气密性;②准确称得盛有碱石灰(固体氢氧化钠和生石灰的混合物)的干燥管D的质量为 A克;③准确称得B克的纯碱样品放入容器 b中;④连接装置;⑤打开分液漏斗 a的旋塞,缓缓滴入稀硫酸,至不再产生气泡为止;⑥打开弹簧夹,往试管A中缓缓鼓入空气数分钟,然后称得干燥管D的总质量为 C 克。试回答:
⑴若⑤⑥两步的实验操作太快,则会导致测定结果 (填“偏大”或“偏小”);
⑵步骤⑥的目的是 ,装置A中试剂可选用 ;
⑶若没有C装置,则会导致测定结果 (填“偏大”或“偏小”);
⑷E装置的作用是 ;
⑸某同学认为此实验还缺少一个步骤,会影响实验结果。你认为缺少的
步骤是 。
增加这步骤目的是
。 ?
偏小
把装置中的二氧化碳气体赶到D装置中去
氢氧化钠
防止外界的水蒸气或二氧化碳被D吸收
连接D之前先通一会经过处理的空气
赶出装置内的二氧化碳,避免装置内原有的二氧化碳影响实验结果
偏大
4、某兴趣小组的学生根据活泼金属Mg与CO2发生反应,推测活泼金属钠也能与CO2发生反应,因此兴趣小组用下列装置进行“钠与二氧化碳反应”的实验探究(尾气处理装置已略去)。
已知:常温下,CO能使一些化合物中的金属离子还原,例如:
PdCl2 + CO + H2O=Pd↓+ CO2 +2HCl 。反应生成黑色的
金属钯,此反应 也可用来检测微量CO的存在。
多孔隔板
请回答下列问题:
(1)通常实验室制取CO2气体的化学方程式是 ,
为了使制气装置能“随开随用,随关随停”,上图A处应选用的装置是___ (填写 “Ⅰ”、“Ⅱ”或“”)。若要制取干燥、纯净的CO2气体,装置B中应盛放的试剂是 溶液,装置C中应盛放的试剂是________ 。
(2)观察实验装置图可知Na与CO2反应的条件是____。检查装置的气密性完好并装入药品后,在点燃酒精喷灯前,必须进行的操作是_ ,待装置 (填写字母)中出现
现象时,再点燃酒精喷灯,这步操作的目的是
。
CaCO3 + 2HCl = CaCl2 + H2O + CO2↑
Ⅲ
饱和NaHCO3
浓H2SO4
高温
扭开装置Ⅲ中导气管活塞
E
澄清的石灰水变浑浊
排出该装置中的空气
(3)假设CO2气体为足量,在实验过程中分别产生以下①、②两种不同情况,请分析并回答问题:① 若装置F中溶液无明显变化,装置D中生成两种固体物质,取少量固体生成物与盐酸反应后,有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的化学方程式是 。
② 若装置F中有黑色沉淀生成,装置D中只生成一种固体物质,取少量该固体与盐酸反应后,也有能使澄清石灰水变浑浊的气体放出,则钠与二氧化碳反应的
化学方程式是 。
(4)请用文字简要说明你判断②中D装置生成固体的成分是钠的正盐或酸式盐的理由 。
4Na + 3CO2
2Na2CO3 + C
2Na + 2CO2
Na2CO3 + CO
生成正盐。因为根据质量守恒定律可知,反应物共有三种元素,没有氢元素因此不能生成酸式盐。(或:生成正盐。因为高温条件下碳酸氢钠不存在)
1、有一混合气体,可能由H2、CO、CO2中的一种或几种组成,若将混合气体通过下图所示装置,试回答(假定每一步均完全反应):
混合气体
⑴图示装置能测定哪些气体的存在与否?
⑵若要能测定所有气体的存在与否,应添加什么装置?
⑶判定H2、CO、CO2各气体存在的依据是什么?
2、神舟六号载人飞船成功返航,标志着我国已跨入航天领域国际领先行列。某研究性学习小组查阅资料得知,宇宙飞船中可用超氧化钾(KO2)作为氧气再生剂。超氧化钾是一种固体,它与人呼出的二氧化碳反应生成氧气:4KO2 + 2CO2 == K2CO3 + 302
为了验证这个反应能够产生氧气,该小组同学以大理石和盐酸反应生成的CO2来与KO2反应制取O2,设计了如下实验装置:
(1)C 处应从 A、B两种装置中选择 作 CO2发生装置。检验 G中集气瓶内收集的气体是否为氧气,可以在取出集气瓶后,用 检验。
(2)已知 CO2 不溶于饱和碳酸氢钠溶液,D装置的
作用是 。
(3)为了除去 O2 中可能混有的 CO2 ,F 中可盛放过量
溶液。
(4)有同学提出,上述实验能生成氧气可能与 CO2 中混有的水蒸气有关。若要检验干燥的 CO2能否与超氧化钾反应生成氧气,你对上述实验装置的改进方法是 。
实验装置的选取与连接探究题的分类及步骤
1、检验:混合气体中有什么成份。
2、除杂:把混合气体中不需用的成分除去。(装置中某种
成份的作用 如:浓硫酸、饱和碳酸氢钠等)
3、干燥:得到纯净干燥的气体。
4、计算:通过实验中测得的一些数据来计算反应物的纯度等问题。
1、仪器中原有的气体(一般是空气)会不会对实验结果
造成干扰,如果会的必须先除去。
2、对造成计算结果偏大偏小问题的原因进行分析。
3、防止装置最后的倒吸问题(一般是空气中的某种成分)。
4、尾气处理问题。
小
结
注
意
