2020-2021学年人教版高二化学选修3-3.1《 晶体的常识》过关训练试题(含解析)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修3-3.1《 晶体的常识》过关训练试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 634.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-21 14:46:19 | ||
图片预览


文档简介
(人教版选修3)3.1《晶体的常识》过关训练试题(原卷版)
(时间:45分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列叙述中正确的是( )
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.粉末状的固体一定不是晶体
2.如图是a、b两种不同物质的熔化曲线,下列说法正确的是( )
A.a没有固定的熔点 B.a是非晶体
C.b是晶体 D.b是非晶体
3.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
4.下列选项中各物质的化学键类型相同、晶体类型也相同的是( )
A.HCHO、CO2、C2H5OH B.金刚石、O2、F2
C.Ba(OH)2、H2O、CaCl2 D.I2、Ar、N2、单质硅
5.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;
③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;
④晶体内部的微粒按一定规律呈周期性排列;
⑤晶胞是晶体结构的基本单元;
⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
6.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
7.将一块缺角的胆矾晶体置于饱和的硫酸铜溶液中,一段时间后(浓度不变),发现缺角晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体的质量变小,溶液的质量变大 B.晶体的质量变大,溶液的质量变小
C.晶体和溶液的质量都不变 D.无法确定
8.金刚石晶胞如图,属于一个金刚石晶胞的碳原子数为( )
A.18 B.16 C.10 D.8
9.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
A.K2O B.K2O2
C.K2O3 D.KO2
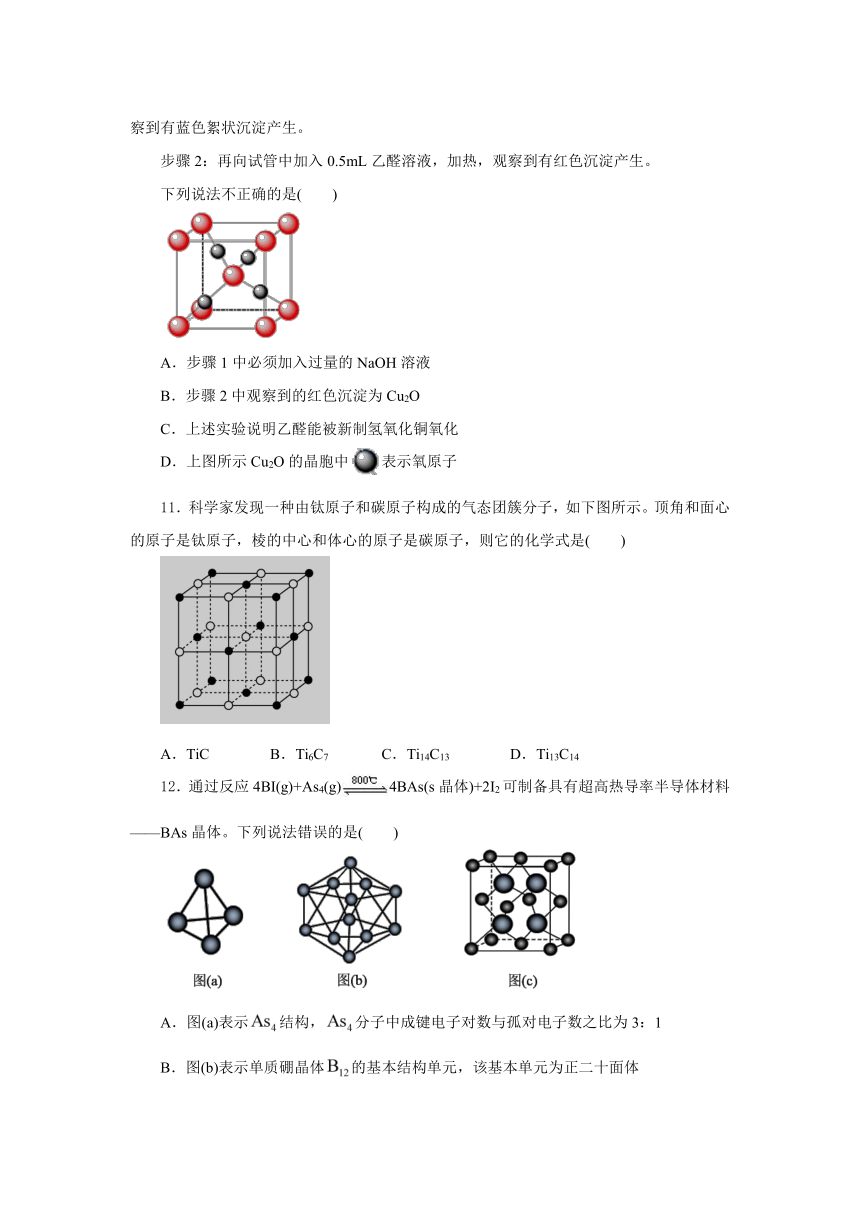
10.乙醛与新制氢氧化铜悬浊液反应的实验如下:
步骤1:向试管中加入2mL10%NaOH溶液,边振荡边滴加4~6滴2%CuSO4溶液,观察到有蓝色絮状沉淀产生。
步骤2:再向试管中加入0.5mL乙醛溶液,加热,观察到有红色沉淀产生。
下列说法不正确的是( )
A.步骤1中必须加入过量的NaOH溶液
B.步骤2中观察到的红色沉淀为Cu2O
C.上述实验说明乙醛能被新制氢氧化铜氧化
D.上图所示Cu2O的晶胞中表示氧原子
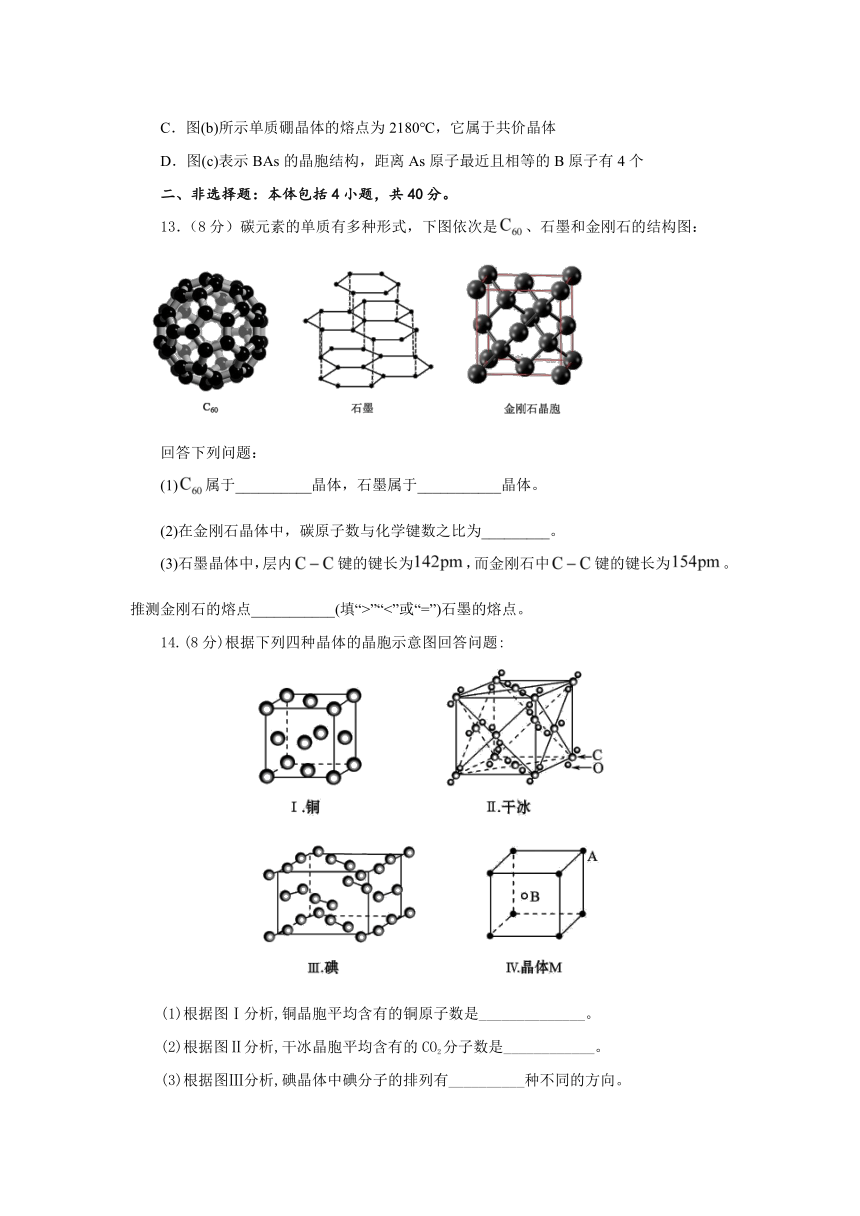
11.科学家发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
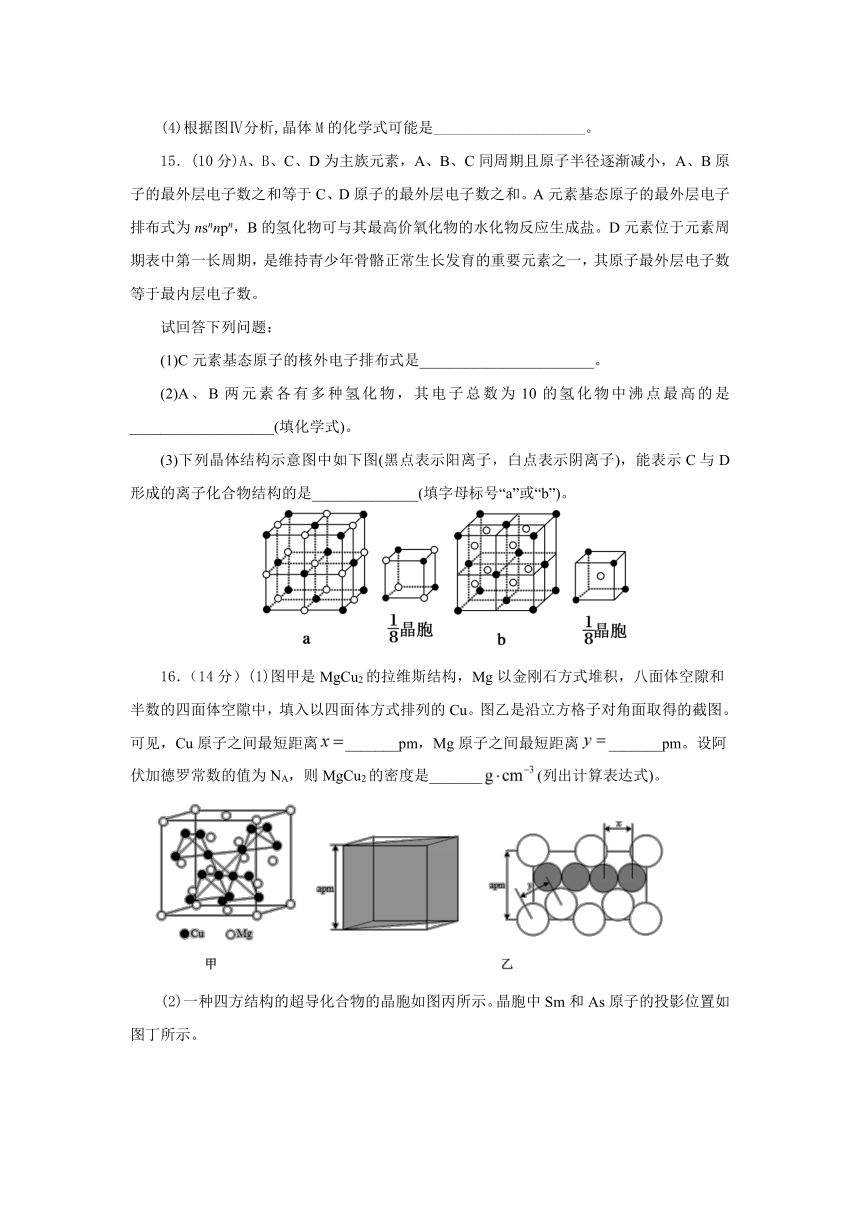
12.通过反应4BI(g)+As4(g)4BAs(s晶体)+2I2可制备具有超高热导率半导体材料——BAs晶体。下列说法错误的是( )
A.图(a)表示false结构,false分子中成键电子对数与孤对电子数之比为3:1
B.图(b)表示单质硼晶体false的基本结构单元,该基本单元为正二十面体
C.图(b)所示单质硼晶体的熔点为2180℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,距离As原子最近且相等的B原子有4个
二、非选择题:本体包括4小题,共40分。
13.(8分)碳元素的单质有多种形式,下图依次是false、石墨和金刚石的结构图:
回答下列问题:
(1)false属于__________晶体,石墨属于___________晶体。
(2)在金刚石晶体中,碳原子数与化学键数之比为_________。
(3)石墨晶体中,层内false键的键长为false,而金刚石中false键的键长为false。推测金刚石的熔点___________(填“>”“<”或“=”)石墨的熔点。
14.(8分)根据下列四种晶体的晶胞示意图回答问题:
(1)根据图Ⅰ分析,铜晶胞平均含有的铜原子数是______________。?
(2)根据图Ⅱ分析,干冰晶胞平均含有的CO2分子数是____________。?
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有__________种不同的方向。?
(4)根据图Ⅳ分析,晶体M的化学式可能是____________________。?
15.(10分)A、B、C、D为主族元素,A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素基态原子的最外层电子排布式为nsnnpn,B的氢化物可与其最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。
试回答下列问题:
(1)C元素基态原子的核外电子排布式是_______________________。
(2)A、B两元素各有多种氢化物,其电子总数为10的氢化物中沸点最高的是___________________(填化学式)。
(3)下列晶体结构示意图中如下图(黑点表示阳离子,白点表示阴离子),能表示C与D形成的离子化合物结构的是______________(填字母标号“a”或“b”)。
16.(14分)(1)图甲是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图乙是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离false_______pm,Mg原子之间最短距离false_______pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_______false(列出计算表达式)。
(2)一种四方结构的超导化合物的晶胞如图丙所示。晶胞中Sm和As原子的投影位置如图丁所示。
图中F—和O2—共同占据晶胞的上下底面位置,若两者的比例依次用x和1—x代表,则该化合物的化学式表示为_______;通过测定密度false和晶胞参数,可以计算该物质的x值,完成它们关系表达式:false_______false,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图丙中原子1的坐标为false,则原子2和3的坐标分别为_______、_______。
(3)苯胺()的晶体类型是_____________。
(4)一个Cu2O晶胞(如图戊)中,Cu原子的数目为________________________。
(人教版选修3)3.1《晶体的常识》过关训练试题(解析版)
(时间:45分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列叙述中正确的是( )
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.粉末状的固体一定不是晶体
【答案】C
【解析】有些人工加工而成的固体也具有规则的几何外形,但不是晶体,如玻璃制品,A项错误;晶体与非晶体的根本区别在于其内部微粒是否呈周期性有序排列,晶体所具有的规则几何外形、各向异性和特定的对称性都是其内部粒子规律性排列的外部反映,B项错误;具有各向异性的固体一定是晶体,非晶体不具有各向异性,C项正确;不管固体的颗粒大小如何,只要其组成粒子在三维空间里呈现周期性的有序排列就属于晶体,D项错误。
2.如图是a、b两种不同物质的熔化曲线,下列说法正确的是( )
A.a没有固定的熔点 B.a是非晶体
C.b是晶体 D.b是非晶体
【答案】D
【解析】晶体有固定的熔点,由a的熔化曲线分析可知,中间有一段温度不变但一直在吸收能量,该段所对应的温度就是晶体a的熔点;由b的熔化曲线可知,温度一直升高,所以物质b没有固定的熔点,为非晶体。
3.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
【答案】B
【解析】A选项,将饱和CuSO4溶液降温,可析出胆矾,胆矾属于晶体。B选项,一般宝石的硬度较大,玻璃制品的硬度较小,可以根据有无刻痕来鉴别。C选项,非晶体没有固定的熔点。D选项,由于晶体的各向异性导致蓝宝石在不同方向上的硬度有一些差异。
4.下列选项中各物质的化学键类型相同、晶体类型也相同的是( )
A.HCHO、CO2、C2H5OH B.金刚石、O2、F2
C.Ba(OH)2、H2O、CaCl2 D.I2、Ar、N2、单质硅
【答案】A
【解析】A.HCHO、CO2、C2H5OH都是分子晶体,都只含共价键,故A正确;
B.金刚石是共价晶体,O2、F2是分子晶体,故B错误;C.Ba(OH)2、CaCl2是离子晶体,H2O是分子晶体,故C错误;D.I2、Ar、N2是分子晶体,单质硅是共价晶体,故D错误;
选A。
5.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;
③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;
④晶体内部的微粒按一定规律呈周期性排列;
⑤晶胞是晶体结构的基本单元;
⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
【答案】D
【解析】晶体中原子呈周期性有序排列,有自范性,非晶体中原子排列相对无序,无自范性,故①正确;晶胞是晶体中最小的重复的“平行六面体”,故②不正确;许多固体粉末虽然用肉眼看不到晶体外形,但通过光学显微镜或电子显微镜可以观察到规则的几何外形,这些固体粉末仍是晶体,故③不正确;晶体内部的微粒按一定规律呈周期性排列,故④正确;
晶胞是晶体结构的基本单元,故⑤正确;晶体尽量采取紧密堆积的方式,以使其更稳定,故⑥正确;不正确的是②③,选D。
6.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
【答案】B
【解析】A选项,将饱和CuSO4溶液降温,可析出胆矾,胆矾属于晶体。B选项,一般宝石的硬度较大,玻璃制品的硬度较小,可以根据有无刻痕来鉴别。C选项,非晶体没有固定的熔点。D选项,由于晶体的各向异性导致蓝宝石在不同方向上的硬度有一些差异。
7.将一块缺角的胆矾晶体置于饱和的硫酸铜溶液中,一段时间后(浓度不变),发现缺角晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体的质量变小,溶液的质量变大 B.晶体的质量变大,溶液的质量变小
C.晶体和溶液的质量都不变 D.无法确定
【答案】C
【解析】胆矾晶体具有自范性,有自发呈现封闭的、规则的多面体外形的性质。由于原溶液为饱和溶液,因此胆矾晶体与饱和硫酸铜溶液间存在着溶解晶体平衡,整个过程中晶体和溶液的质量都不发生变化。故选C项。综上所述,本题正确答案为C。
8.金刚石晶胞如图,属于一个金刚石晶胞的碳原子数为( )
A.18 B.16
C.10 D.8
【答案】D
【解析】从晶胞上看8个顶点各有1个C原子,属于该晶胞的部分相当于只有1个,6个面上相当于有3个,晶胞内部还有4个,故属于该晶胞的碳原子数为8个,答案选D。
9.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
A.K2O B.K2O2
C.K2O3 D.KO2
【答案】D
【解析】K+的个数:8×+6×=4;O的个数:12×+1=4,故其比值为1∶1,应选D。
10.乙醛与新制氢氧化铜悬浊液反应的实验如下:
步骤1:向试管中加入2mL10%NaOH溶液,边振荡边滴加4~6滴2%CuSO4溶液,观察到有蓝色絮状沉淀产生。
步骤2:再向试管中加入0.5mL乙醛溶液,加热,观察到有红色沉淀产生。
下列说法不正确的是( )
A.步骤1中必须加入过量的NaOH溶液
B.步骤2中观察到的红色沉淀为Cu2O
C.上述实验说明乙醛能被新制氢氧化铜氧化
D.上图所示Cu2O的晶胞中表示氧原子
【答案】D
【解析】A.醛基和新制的氢氧化铜悬浊液反应时需要碱过量,故必须加入过量的氢氧化钠溶液,A正确;B.乙醛和新制的氢氧化铜悬浊液反应生成红色的氧化亚铜沉淀,B正确;C.实验生成乙酸铵,说明乙醛被氢氧化铜氧化,C正确;D.晶胞中红色球有false,黑色球有4个,所以结合氧化亚铜的化学式分析,黑色球表示铜原子,D错误;故选D。
11.科学家发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
【答案】C
【解析】如果利用“均摊法”来计算,就会得出:钛原子数为8(顶角)×+6(面心)×=4;碳原子数为12(棱)×+1(体心)=4,从而错选A。若该图是一个晶胞,则这种计算正确,但它是一个气态团簇分子,其化学式就是其分子式,应直接数出原子数。
12.通过反应4BI(g)+As4(g)4BAs(s晶体)+2I2可制备具有超高热导率半导体材料——BAs晶体。下列说法错误的是( )
A.图(a)表示false结构,false分子中成键电子对数与孤对电子数之比为3:1
B.图(b)表示单质硼晶体false的基本结构单元,该基本单元为正二十面体
C.图(b)所示单质硼晶体的熔点为2180℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,距离As原子最近且相等的B原子有4个
【答案】A
【解析】A.图(a)表示As4结构,每个As原子最外层有5个电子,形成3个false键,还有1对孤对电子,As分子中成键电子对数与孤对电子数之比为3:2,故A项错误;B.图(b)表示单质硼晶体false的基本结构单元,每个面都是由3个B原子形成的正三角形,一共有20个正三角形,所以该基本单元为正二十面体,故B项正确;C.单质硼晶体的熔点为2180℃,熔点较高,且原子间通过共价键结合,属于共价晶体,故C项正确;D.BAs晶胞中,较大的原子为As原子,距离As原子最近且相等的B原子有4个,故D项正确。故选:A。
二、非选择题:本体包括4小题,共40分。
13.(8分)碳元素的单质有多种形式,下图依次是false、石墨和金刚石的结构图:
回答下列问题:
(1)false属于__________晶体,石墨属于___________晶体。
(2)在金刚石晶体中,碳原子数与化学键数之比为_________。
(3)石墨晶体中,层内false键的键长为false,而金刚石中false键的键长为false。推测金刚石的熔点___________(填“>”“<”或“=”)石墨的熔点。
【答案】分子 混合型 1:2 <
【解析】(1)false中构成微粒是分子,所以属于分子晶体;石墨晶体中含有共价键、范德华力,且沿石墨平面的方向具有导电性,所以石墨属于混合型晶体;故答案为:分子;混合型;(2)金刚石晶体中每个碳原子平均拥有的化学键数为false,则碳原子数与化学键数之比为1:2,故答案为:1:2;(3)石墨中的false键比金刚石中的false键键长短,键能大,故石墨的熔点高于金刚石,故答案为:<。
14.(8分)根据下列四种晶体的晶胞示意图回答问题:
(1)根据图Ⅰ分析,铜晶胞平均含有的铜原子数是______________。?
(2)根据图Ⅱ分析,干冰晶胞平均含有的CO2分子数是____________。?
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有__________种不同的方向。?
(4)根据图Ⅳ分析,晶体M的化学式可能是____________________。?
【答案】(1)4 (2)4 (3)2 (4)AB(或BA)
【解析】(1)铜晶胞平均含有的铜原子数为1/8×8+1/2×6=4。(2)干冰晶胞平均含有的CO2分子数为1/8×8+1/2×6=4。(3)根据碘晶胞中碘分子的排列方向可知,碘晶体中碘分子的排列有2种不同的方向。(4)晶体M的晶胞中,N(A)∶N(B)=(1/8×8)∶1
=1∶1,故M的化学式可能为AB(或BA)。
15.(10分)A、B、C、D为主族元素,A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素基态原子的最外层电子排布式为nsnnpn,B的氢化物可与其最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。
试回答下列问题:
(1)C元素基态原子的核外电子排布式是_______________________。
(2)A、B两元素各有多种氢化物,其电子总数为10的氢化物中沸点最高的是___________________(填化学式)。
(3)下列晶体结构示意图中如下图(黑点表示阳离子,白点表示阴离子),能表示C与D形成的离子化合物结构的是______________(填字母标号“a”或“b”)。
【答案】(1)1s22s22p5 (2)NH3 (3)b
【解析】这是一道综合性的物质结构推断题,既考查了原子结构知识,又考查了晶体知识。由信息“A元素基态原子的最外层电子排布为nsnnpn”可推知ns轨道已经填满电子,所以n=2,故A元素原子的核外电子排布式为1s22s22p2,即A为碳元素;由信息“B的氢化物可与其最高价氧化物的水化物反应生成盐”可推知B为氮元素;由“D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一”可推知D为钙元素;由“A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和”可推知C元素最外层电子数=4+5-2=7,所以与A、B同周期的C为氟元素。A、B形成的氢化物且含有10个电子的分子是CH4和NH3,CH4的沸点比NH3的沸点低;C与D形成的离子化合物的化学式是CaF2,a图中Ca2+和F-的个数比为1?1,b图中Ca2+和F-的个数比为1?2,故b图表示的是CaF2的结构。
16.(14分)(1)图甲是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图乙是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离false_______pm,Mg原子之间最短距离false_______pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_______false(列出计算表达式)。
(2)一种四方结构的超导化合物的晶胞如图丙所示。晶胞中Sm和As原子的投影位置如图丁所示。
图中F—和O2—共同占据晶胞的上下底面位置,若两者的比例依次用x和1—x代表,则该化合物的化学式表示为_______;通过测定密度false和晶胞参数,可以计算该物质的x值,完成它们关系表达式:false_______false,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图丙中原子1的坐标为false,则原子2和3的坐标分别为_______、_______。
(3)苯胺()的晶体类型是_____________。
(4)一个Cu2O晶胞(如图戊)中,Cu原子的数目为________________________。
【答案】(1)false false false
(2) false false false false
(3)分子晶体 (4)4
【解析】(1)由题图乙右侧图形可知4个false原子相切排列,x为false原子直径,晶胞面对角线长为false,由题可知false,所以false,false原子之间最短距离为体对角线长的false,则false;晶体密度false,false,晶胞质量m为8个false和16个false的质量,即false,所以false,故答案为: false;false;false;
(2)由题图丙可知,晶胞内false处于体心和棱心,false原子一共有false个,结合题图丁得知,false原子和false原子位于面上,false原子一共有false个,false原子一共有false个,false和false位于上下底面,则false和false共有false个,综上所述,一个晶胞内有2个false、2个false、2个false、false和false一共2个,可得该化合物的化学式表示为false;已知超导化合物晶体晶胞参数为false、false、false,且false的相对分子质量为false,根据密度公式false得false;原子2位于原子1正下方(底面面心),则由原子1坐标结合三维坐标系的方向可知原子2坐标为false;原子3位于棱心,其坐标为false,故答案为:false;false;false;false;
(3)苯胺是由分子构成的物质,其晶体属于分子晶体,故答案为:分子晶体;
(4)氧原子位于顶点和体心,一个晶胞内氧原子数为false,false原子位于晶胞内,一个晶胞中有4个false原子,故答案为:4;
(时间:45分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列叙述中正确的是( )
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.粉末状的固体一定不是晶体
2.如图是a、b两种不同物质的熔化曲线,下列说法正确的是( )
A.a没有固定的熔点 B.a是非晶体
C.b是晶体 D.b是非晶体
3.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
4.下列选项中各物质的化学键类型相同、晶体类型也相同的是( )
A.HCHO、CO2、C2H5OH B.金刚石、O2、F2
C.Ba(OH)2、H2O、CaCl2 D.I2、Ar、N2、单质硅
5.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;
③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;
④晶体内部的微粒按一定规律呈周期性排列;
⑤晶胞是晶体结构的基本单元;
⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
6.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
7.将一块缺角的胆矾晶体置于饱和的硫酸铜溶液中,一段时间后(浓度不变),发现缺角晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体的质量变小,溶液的质量变大 B.晶体的质量变大,溶液的质量变小
C.晶体和溶液的质量都不变 D.无法确定
8.金刚石晶胞如图,属于一个金刚石晶胞的碳原子数为( )
A.18 B.16 C.10 D.8
9.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
A.K2O B.K2O2
C.K2O3 D.KO2
10.乙醛与新制氢氧化铜悬浊液反应的实验如下:
步骤1:向试管中加入2mL10%NaOH溶液,边振荡边滴加4~6滴2%CuSO4溶液,观察到有蓝色絮状沉淀产生。
步骤2:再向试管中加入0.5mL乙醛溶液,加热,观察到有红色沉淀产生。
下列说法不正确的是( )
A.步骤1中必须加入过量的NaOH溶液
B.步骤2中观察到的红色沉淀为Cu2O
C.上述实验说明乙醛能被新制氢氧化铜氧化
D.上图所示Cu2O的晶胞中表示氧原子
11.科学家发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
12.通过反应4BI(g)+As4(g)4BAs(s晶体)+2I2可制备具有超高热导率半导体材料——BAs晶体。下列说法错误的是( )
A.图(a)表示false结构,false分子中成键电子对数与孤对电子数之比为3:1
B.图(b)表示单质硼晶体false的基本结构单元,该基本单元为正二十面体
C.图(b)所示单质硼晶体的熔点为2180℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,距离As原子最近且相等的B原子有4个
二、非选择题:本体包括4小题,共40分。
13.(8分)碳元素的单质有多种形式,下图依次是false、石墨和金刚石的结构图:
回答下列问题:
(1)false属于__________晶体,石墨属于___________晶体。
(2)在金刚石晶体中,碳原子数与化学键数之比为_________。
(3)石墨晶体中,层内false键的键长为false,而金刚石中false键的键长为false。推测金刚石的熔点___________(填“>”“<”或“=”)石墨的熔点。
14.(8分)根据下列四种晶体的晶胞示意图回答问题:
(1)根据图Ⅰ分析,铜晶胞平均含有的铜原子数是______________。?
(2)根据图Ⅱ分析,干冰晶胞平均含有的CO2分子数是____________。?
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有__________种不同的方向。?
(4)根据图Ⅳ分析,晶体M的化学式可能是____________________。?
15.(10分)A、B、C、D为主族元素,A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素基态原子的最外层电子排布式为nsnnpn,B的氢化物可与其最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。
试回答下列问题:
(1)C元素基态原子的核外电子排布式是_______________________。
(2)A、B两元素各有多种氢化物,其电子总数为10的氢化物中沸点最高的是___________________(填化学式)。
(3)下列晶体结构示意图中如下图(黑点表示阳离子,白点表示阴离子),能表示C与D形成的离子化合物结构的是______________(填字母标号“a”或“b”)。
16.(14分)(1)图甲是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图乙是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离false_______pm,Mg原子之间最短距离false_______pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_______false(列出计算表达式)。
(2)一种四方结构的超导化合物的晶胞如图丙所示。晶胞中Sm和As原子的投影位置如图丁所示。
图中F—和O2—共同占据晶胞的上下底面位置,若两者的比例依次用x和1—x代表,则该化合物的化学式表示为_______;通过测定密度false和晶胞参数,可以计算该物质的x值,完成它们关系表达式:false_______false,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图丙中原子1的坐标为false,则原子2和3的坐标分别为_______、_______。
(3)苯胺()的晶体类型是_____________。
(4)一个Cu2O晶胞(如图戊)中,Cu原子的数目为________________________。
(人教版选修3)3.1《晶体的常识》过关训练试题(解析版)
(时间:45分钟 满分:100分)
一、单项选择题:本题包括12小题,每小题5分,共60分。
1.下列叙述中正确的是( )
A.具有规则几何外形的固体一定是晶体
B.晶体与非晶体的根本区别在于是否具有规则的几何外形
C.具有各向异性的固体一定是晶体
D.粉末状的固体一定不是晶体
【答案】C
【解析】有些人工加工而成的固体也具有规则的几何外形,但不是晶体,如玻璃制品,A项错误;晶体与非晶体的根本区别在于其内部微粒是否呈周期性有序排列,晶体所具有的规则几何外形、各向异性和特定的对称性都是其内部粒子规律性排列的外部反映,B项错误;具有各向异性的固体一定是晶体,非晶体不具有各向异性,C项正确;不管固体的颗粒大小如何,只要其组成粒子在三维空间里呈现周期性的有序排列就属于晶体,D项错误。
2.如图是a、b两种不同物质的熔化曲线,下列说法正确的是( )
A.a没有固定的熔点 B.a是非晶体
C.b是晶体 D.b是非晶体
【答案】D
【解析】晶体有固定的熔点,由a的熔化曲线分析可知,中间有一段温度不变但一直在吸收能量,该段所对应的温度就是晶体a的熔点;由b的熔化曲线可知,温度一直升高,所以物质b没有固定的熔点,为非晶体。
3.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
【答案】B
【解析】A选项,将饱和CuSO4溶液降温,可析出胆矾,胆矾属于晶体。B选项,一般宝石的硬度较大,玻璃制品的硬度较小,可以根据有无刻痕来鉴别。C选项,非晶体没有固定的熔点。D选项,由于晶体的各向异性导致蓝宝石在不同方向上的硬度有一些差异。
4.下列选项中各物质的化学键类型相同、晶体类型也相同的是( )
A.HCHO、CO2、C2H5OH B.金刚石、O2、F2
C.Ba(OH)2、H2O、CaCl2 D.I2、Ar、N2、单质硅
【答案】A
【解析】A.HCHO、CO2、C2H5OH都是分子晶体,都只含共价键,故A正确;
B.金刚石是共价晶体,O2、F2是分子晶体,故B错误;C.Ba(OH)2、CaCl2是离子晶体,H2O是分子晶体,故C错误;D.I2、Ar、N2是分子晶体,单质硅是共价晶体,故D错误;
选A。
5.下列关于晶体的说法中,不正确的是( )
①晶体中原子呈周期性有序排列,有自范性;而非晶体中原子排列相对无序,无自范性;
②晶胞是晶体中最小的“平行六面体”;
③呈粉末状的固体物质没有规则的晶体外形,均不属于晶体;
④晶体内部的微粒按一定规律呈周期性排列;
⑤晶胞是晶体结构的基本单元;
⑥晶体尽可能采取紧密堆积的方式,以使其更稳定。
A.①②③ B.②③④
C.④⑤⑥ D.②③
【答案】D
【解析】晶体中原子呈周期性有序排列,有自范性,非晶体中原子排列相对无序,无自范性,故①正确;晶胞是晶体中最小的重复的“平行六面体”,故②不正确;许多固体粉末虽然用肉眼看不到晶体外形,但通过光学显微镜或电子显微镜可以观察到规则的几何外形,这些固体粉末仍是晶体,故③不正确;晶体内部的微粒按一定规律呈周期性排列,故④正确;
晶胞是晶体结构的基本单元,故⑤正确;晶体尽量采取紧密堆积的方式,以使其更稳定,故⑥正确;不正确的是②③,选D。
6.下列关于晶体的说法正确的是( )
A.将饱和硫酸铜溶液降温,析出的固体不是晶体
B.假宝石往往是玻璃仿造的,可以用划痕的方法鉴别宝石和玻璃制品
C.石蜡和玻璃都是非晶体,但它们都有固定的熔点
D.蓝宝石在不同方向上的硬度一定相同
【答案】B
【解析】A选项,将饱和CuSO4溶液降温,可析出胆矾,胆矾属于晶体。B选项,一般宝石的硬度较大,玻璃制品的硬度较小,可以根据有无刻痕来鉴别。C选项,非晶体没有固定的熔点。D选项,由于晶体的各向异性导致蓝宝石在不同方向上的硬度有一些差异。
7.将一块缺角的胆矾晶体置于饱和的硫酸铜溶液中,一段时间后(浓度不变),发现缺角晶体变完整了。若溶剂不挥发,则这段时间内晶体和溶液的质量变化分别是( )
A.晶体的质量变小,溶液的质量变大 B.晶体的质量变大,溶液的质量变小
C.晶体和溶液的质量都不变 D.无法确定
【答案】C
【解析】胆矾晶体具有自范性,有自发呈现封闭的、规则的多面体外形的性质。由于原溶液为饱和溶液,因此胆矾晶体与饱和硫酸铜溶液间存在着溶解晶体平衡,整个过程中晶体和溶液的质量都不发生变化。故选C项。综上所述,本题正确答案为C。
8.金刚石晶胞如图,属于一个金刚石晶胞的碳原子数为( )
A.18 B.16
C.10 D.8
【答案】D
【解析】从晶胞上看8个顶点各有1个C原子,属于该晶胞的部分相当于只有1个,6个面上相当于有3个,晶胞内部还有4个,故属于该晶胞的碳原子数为8个,答案选D。
9.如图所示,在较高温度时,钾、氧两种元素形成的一种晶体结构与NaCl晶体结构相似,则该化合物的化学式为( )
A.K2O B.K2O2
C.K2O3 D.KO2
【答案】D
【解析】K+的个数:8×+6×=4;O的个数:12×+1=4,故其比值为1∶1,应选D。
10.乙醛与新制氢氧化铜悬浊液反应的实验如下:
步骤1:向试管中加入2mL10%NaOH溶液,边振荡边滴加4~6滴2%CuSO4溶液,观察到有蓝色絮状沉淀产生。
步骤2:再向试管中加入0.5mL乙醛溶液,加热,观察到有红色沉淀产生。
下列说法不正确的是( )
A.步骤1中必须加入过量的NaOH溶液
B.步骤2中观察到的红色沉淀为Cu2O
C.上述实验说明乙醛能被新制氢氧化铜氧化
D.上图所示Cu2O的晶胞中表示氧原子
【答案】D
【解析】A.醛基和新制的氢氧化铜悬浊液反应时需要碱过量,故必须加入过量的氢氧化钠溶液,A正确;B.乙醛和新制的氢氧化铜悬浊液反应生成红色的氧化亚铜沉淀,B正确;C.实验生成乙酸铵,说明乙醛被氢氧化铜氧化,C正确;D.晶胞中红色球有false,黑色球有4个,所以结合氧化亚铜的化学式分析,黑色球表示铜原子,D错误;故选D。
11.科学家发现一种由钛原子和碳原子构成的气态团簇分子,如下图所示。顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,则它的化学式是( )
A.TiC B.Ti6C7 C.Ti14C13 D.Ti13C14
【答案】C
【解析】如果利用“均摊法”来计算,就会得出:钛原子数为8(顶角)×+6(面心)×=4;碳原子数为12(棱)×+1(体心)=4,从而错选A。若该图是一个晶胞,则这种计算正确,但它是一个气态团簇分子,其化学式就是其分子式,应直接数出原子数。
12.通过反应4BI(g)+As4(g)4BAs(s晶体)+2I2可制备具有超高热导率半导体材料——BAs晶体。下列说法错误的是( )
A.图(a)表示false结构,false分子中成键电子对数与孤对电子数之比为3:1
B.图(b)表示单质硼晶体false的基本结构单元,该基本单元为正二十面体
C.图(b)所示单质硼晶体的熔点为2180℃,它属于共价晶体
D.图(c)表示BAs的晶胞结构,距离As原子最近且相等的B原子有4个
【答案】A
【解析】A.图(a)表示As4结构,每个As原子最外层有5个电子,形成3个false键,还有1对孤对电子,As分子中成键电子对数与孤对电子数之比为3:2,故A项错误;B.图(b)表示单质硼晶体false的基本结构单元,每个面都是由3个B原子形成的正三角形,一共有20个正三角形,所以该基本单元为正二十面体,故B项正确;C.单质硼晶体的熔点为2180℃,熔点较高,且原子间通过共价键结合,属于共价晶体,故C项正确;D.BAs晶胞中,较大的原子为As原子,距离As原子最近且相等的B原子有4个,故D项正确。故选:A。
二、非选择题:本体包括4小题,共40分。
13.(8分)碳元素的单质有多种形式,下图依次是false、石墨和金刚石的结构图:
回答下列问题:
(1)false属于__________晶体,石墨属于___________晶体。
(2)在金刚石晶体中,碳原子数与化学键数之比为_________。
(3)石墨晶体中,层内false键的键长为false,而金刚石中false键的键长为false。推测金刚石的熔点___________(填“>”“<”或“=”)石墨的熔点。
【答案】分子 混合型 1:2 <
【解析】(1)false中构成微粒是分子,所以属于分子晶体;石墨晶体中含有共价键、范德华力,且沿石墨平面的方向具有导电性,所以石墨属于混合型晶体;故答案为:分子;混合型;(2)金刚石晶体中每个碳原子平均拥有的化学键数为false,则碳原子数与化学键数之比为1:2,故答案为:1:2;(3)石墨中的false键比金刚石中的false键键长短,键能大,故石墨的熔点高于金刚石,故答案为:<。
14.(8分)根据下列四种晶体的晶胞示意图回答问题:
(1)根据图Ⅰ分析,铜晶胞平均含有的铜原子数是______________。?
(2)根据图Ⅱ分析,干冰晶胞平均含有的CO2分子数是____________。?
(3)根据图Ⅲ分析,碘晶体中碘分子的排列有__________种不同的方向。?
(4)根据图Ⅳ分析,晶体M的化学式可能是____________________。?
【答案】(1)4 (2)4 (3)2 (4)AB(或BA)
【解析】(1)铜晶胞平均含有的铜原子数为1/8×8+1/2×6=4。(2)干冰晶胞平均含有的CO2分子数为1/8×8+1/2×6=4。(3)根据碘晶胞中碘分子的排列方向可知,碘晶体中碘分子的排列有2种不同的方向。(4)晶体M的晶胞中,N(A)∶N(B)=(1/8×8)∶1
=1∶1,故M的化学式可能为AB(或BA)。
15.(10分)A、B、C、D为主族元素,A、B、C同周期且原子半径逐渐减小,A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和。A元素基态原子的最外层电子排布式为nsnnpn,B的氢化物可与其最高价氧化物的水化物反应生成盐。D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一,其原子最外层电子数等于最内层电子数。
试回答下列问题:
(1)C元素基态原子的核外电子排布式是_______________________。
(2)A、B两元素各有多种氢化物,其电子总数为10的氢化物中沸点最高的是___________________(填化学式)。
(3)下列晶体结构示意图中如下图(黑点表示阳离子,白点表示阴离子),能表示C与D形成的离子化合物结构的是______________(填字母标号“a”或“b”)。
【答案】(1)1s22s22p5 (2)NH3 (3)b
【解析】这是一道综合性的物质结构推断题,既考查了原子结构知识,又考查了晶体知识。由信息“A元素基态原子的最外层电子排布为nsnnpn”可推知ns轨道已经填满电子,所以n=2,故A元素原子的核外电子排布式为1s22s22p2,即A为碳元素;由信息“B的氢化物可与其最高价氧化物的水化物反应生成盐”可推知B为氮元素;由“D元素位于元素周期表中第一长周期,是维持青少年骨骼正常生长发育的重要元素之一”可推知D为钙元素;由“A、B原子的最外层电子数之和等于C、D原子的最外层电子数之和”可推知C元素最外层电子数=4+5-2=7,所以与A、B同周期的C为氟元素。A、B形成的氢化物且含有10个电子的分子是CH4和NH3,CH4的沸点比NH3的沸点低;C与D形成的离子化合物的化学式是CaF2,a图中Ca2+和F-的个数比为1?1,b图中Ca2+和F-的个数比为1?2,故b图表示的是CaF2的结构。
16.(14分)(1)图甲是MgCu2的拉维斯结构,Mg以金刚石方式堆积,八面体空隙和半数的四面体空隙中,填入以四面体方式排列的Cu。图乙是沿立方格子对角面取得的截图。可见,Cu原子之间最短距离false_______pm,Mg原子之间最短距离false_______pm。设阿伏加德罗常数的值为NA,则MgCu2的密度是_______false(列出计算表达式)。
(2)一种四方结构的超导化合物的晶胞如图丙所示。晶胞中Sm和As原子的投影位置如图丁所示。
图中F—和O2—共同占据晶胞的上下底面位置,若两者的比例依次用x和1—x代表,则该化合物的化学式表示为_______;通过测定密度false和晶胞参数,可以计算该物质的x值,完成它们关系表达式:false_______false,以晶胞参数为单位长度建立的坐标系可以表示晶胞中各原子的位置,称作原子分数坐标,例如图丙中原子1的坐标为false,则原子2和3的坐标分别为_______、_______。
(3)苯胺()的晶体类型是_____________。
(4)一个Cu2O晶胞(如图戊)中,Cu原子的数目为________________________。
【答案】(1)false false false
(2) false false false false
(3)分子晶体 (4)4
【解析】(1)由题图乙右侧图形可知4个false原子相切排列,x为false原子直径,晶胞面对角线长为false,由题可知false,所以false,false原子之间最短距离为体对角线长的false,则false;晶体密度false,false,晶胞质量m为8个false和16个false的质量,即false,所以false,故答案为: false;false;false;
(2)由题图丙可知,晶胞内false处于体心和棱心,false原子一共有false个,结合题图丁得知,false原子和false原子位于面上,false原子一共有false个,false原子一共有false个,false和false位于上下底面,则false和false共有false个,综上所述,一个晶胞内有2个false、2个false、2个false、false和false一共2个,可得该化合物的化学式表示为false;已知超导化合物晶体晶胞参数为false、false、false,且false的相对分子质量为false,根据密度公式false得false;原子2位于原子1正下方(底面面心),则由原子1坐标结合三维坐标系的方向可知原子2坐标为false;原子3位于棱心,其坐标为false,故答案为:false;false;false;false;
(3)苯胺是由分子构成的物质,其晶体属于分子晶体,故答案为:分子晶体;
(4)氧原子位于顶点和体心,一个晶胞内氧原子数为false,false原子位于晶胞内,一个晶胞中有4个false原子,故答案为:4;
