备战2012高考化学冲刺押题(高考预测)系列 专题15 化学实验的探究与评价
文档属性
| 名称 | 备战2012高考化学冲刺押题(高考预测)系列 专题15 化学实验的探究与评价 |  | |
| 格式 | zip | ||
| 文件大小 | 159.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-12 20:43:42 | ||
图片预览




文档简介
一、选择题
1.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是( )
解析:A项应“长进短出”;C项,温度计水银球的位置应与蒸馏烧瓶支管在同一水平线上;D项,由于白磷的着火点远低于红磷,二者位置应对调。
答案:B
2. 以下说法正确的是( )
A.利用丁达尔效应可以区别溶液和胶体
B.保存FeCl2溶液时常加入少量铁粉以防止Fe2+水解
C.油脂皂化以后可以用渗析的方法使高级脂肪酸钠和甘油充分分离
D.电解法精炼铜时用硫酸铜作电解液,电解后溶液中Cu2+可能消耗完
解析:选项A,胶体具有丁达尔现象,溶液则无,故可用丁达尔效应区别之。选项B,加入少量铁粉是防止Fe2+被氧化。选项C,分离高级脂肪酸钠和甘油应采用盐析的方法。选项D,溶液中消耗的Cu2+可由阳极的粗铜补充,所以电解后溶液中的Cu2+浓度基本不变。
答案:A
3.下列实验设计能够成功的是( )
实验目的 实验步骤及现象
A 检验亚硫酸钠试样是否变质 试样白色沉淀沉淀不溶
B 检验某卤代烃是否是氯代烃 试样冷却出现白色沉淀
C 证明酸性条件下H2O2氧化性比I2强 NaI溶液溶液变蓝色
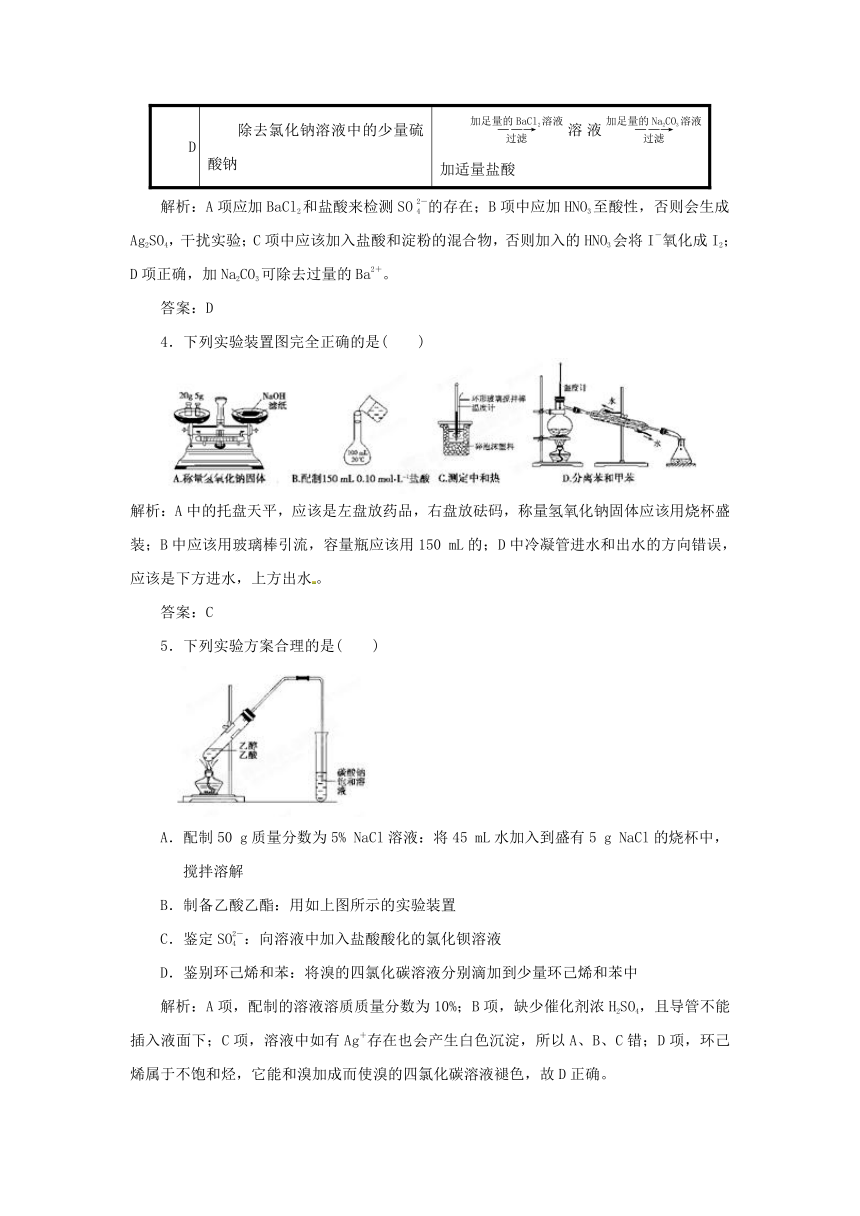
D 除去氯化钠溶液中的少量硫酸钠 溶液加适量盐酸
解析:A项应加BaCl2和盐酸来检测SO的存在;B项中应加HNO3至酸性,否则会生成Ag2SO4,干扰实验;C项中应该加入盐酸和淀粉的混合物,否则加入的HNO3会将I-氧化成I2;D项正确,加Na2CO3可除去过量的Ba2+。
答案:D
4.下列实验装置图完全正确的是( )
解析:A中的托盘天平,应该是左盘放药品,右盘放砝码,称量氢氧化钠固体应该用烧杯盛装;B中应该用玻璃棒引流,容量瓶应该用150 mL的;D中冷凝管进水和出水的方向错误,应该是下方进水,上方出水。
答案:C
5.下列实验方案合理的是( )
A.配制50 g质量分数为5% NaCl溶液:将45 mL水加入到盛有5 g NaCl的烧杯中,
搅拌溶解
B.制备乙酸乙酯:用如上图所示的实验装置
C.鉴定SO:向溶液中加入盐酸酸化的氯化钡溶液
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
解析:A项,配制的溶液溶质质量分数为10%;B项,缺少催化剂浓H2SO4,且导管不能插入液面下;C项,溶液中如有Ag+存在也会产生白色沉淀,所以A、B、C错;D项,环己烯属于不饱和烃,它能和溴加成而使溴的四氯化碳溶液褪色,故D正确。
答案:D
6.下列实验操作中,先后顺序正确的是( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称量时,先称取一定量的晶体,后放入坩埚中
C.为检验酸性溶液中的Cl-和SO,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
解析:A项中考查溶液的稀释问题,稀释规律是:将密度大的溶液倒入密度小的溶液中,应将浓硫酸加入到水中,故A错;B项中操作应是先称量空坩埚,然后将晶体放入坩埚中再一起称量;C项中SO对Cl-的检验有干扰;D项中在制取氯气时要用浓盐酸作原料,氯气中含有氯化氢及水蒸气两种杂质,通过水(或饱和食盐水)是为了除去HCl,再通过浓硫酸是为了除H2O,故D正确。
答案:D
7.在复杂的体系中,研究化学反应的先后顺序有利于解决问题,下列化学反应先后顺序的判断正确的是( )
A.含有等物质的量的AlO、OH-、CO的溶液中逐滴加入盐酸: AlO、Al(OH)3、 OH-、CO
B.含有等物质的量的FeBr2和FeI2的溶液中缓缓通入Cl2:I- 、Br-、Fe2+
C.向含有等物质的量的Ba(OH)2和KOH溶液中缓缓通入CO2:KOH、Ba(OH)2、BaCO3
D.向含有等物质的量的Fe3+、Ag+、Cu2+、H+的溶液中逐渐加入锌粉:Ag+、Fe3+、 Cu2+、H+、Fe2+
解析:A中OH-先反应;B中Fe2+比Br-先反应;C中Ba(OH)2先反应。
答案:D
8.下列实验的设计不可行的是( )
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用水就能一次性鉴别溴苯、苯、乙酸三种物质
C.用如图所示的装置测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl
解析C项不能用稀硝酸,应选用盐酸,装置中的集气瓶应左管短达到进气的目的,右管长达到出水的目的。
答案:C
9.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物测定生成气体的体积
方案Ⅱ:铜铝混合物测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,则测得铜的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
解析:利用铜与铝的性质差异,可选择非氧化性酸、强碱或冷的氧化性酸,让其中一种金属参加反应,可达到目的。对于B项,铝可钝化,生成少量氧化铝,测铝的质量偏大,故铜的质量分数偏小。
答案:C
10.右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤ B.②⑥
C.③⑤ D.①②④
解析:②加入KNO3溶液后不产生H2,而产生NO;④Na2CO3溶液会与稀H2SO4反应产生CO2,既消耗稀H2SO4又会使产生的气体不纯;⑤CCl4在下层,使稀H2SO4与锌粒接触;⑥浓氨水会与稀H2SO4反应。
答案:A
二、非选择题
11.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O22MgO ②3Mg+N2Mg3N2 ③2Mg+CO22MgO+C ④Mg+H2OMgO+H2↑ ⑤Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________
________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)_____________________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?________,原因是______________________________________________________________________
________________________________________________________________________;
(4)请设计一个实验,验证产物是氮化镁:____________________________________
________________________________________________________________________
________________________________________________________________________。
解析:由题目所提供的信息可知:Mg能与O2、CO2、H2O反应,空气中都含有这些气体,所以在Mg与N2反应前先除去以上三种气体,顺序为先除CO2(D装置),再除H2O(B装置),最后除O2(F装置)。在连接装置时,要注意气体流向(长进短出)。Fe与O2反应时应在加热条件(或温度较高)下进行,铁粉没有达到反应温度,不能与O2反应,导致O2除不尽。根据反应⑤可知Mg3N2的水解产物有NH3,可通过测定水解的产物中NH3的存在推出产物是Mg3N2。
答案:(1)B 目的是除气流中的水蒸气,避免反应④发生;
D 目的是除空气中的CO2,避免反应③发生;
F 目的是除空气中的氧气,避免反应①发生
(2)h→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)使氮化镁不纯 如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁
(4)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
12.实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
(1)溶解大理石时,用硝酸而不用硫酸的原因是____________________。
(2)操作Ⅱ的目的是________,溶液A(溶质是共价化合物)是________。
(3)写出检验滤液中是否含铁离子的方法: ____________________________________
________________________________________________________________________。
(4)写出加入碳酸铵所发生反应的离子方程式:___________________________________。
写出滤液B的一种用途:______________________________________________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞
仪器:电子天平、锥形瓶、滴定管
实验步骤:
①________;②加入________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为________。
解析:(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生。
(2)溶液A应呈碱性且溶质为共价化合物,故溶液A是氨水,目的是除去Fe3+。
(3)Fe3+能与KSCN溶液反应生成红色的Fe(SCN)3,用此反应物质来检验Fe3+的存在。
(4)滤液B的主要成分是NH4NO3,可用于制造化肥。
(5)首先称量固体的质量,再加入过量的盐酸标准溶液,过量的盐酸再用NaOH标准溶液滴定。
(6)半滴溶液的体积为×=mL,则相对误差为×100%=0.1%。
答案:(1)硫酸钙微溶于水 (2)除去溶液中Fe3+ 氨水
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
(4)Ca2++CO===CaCO3↓ 作化肥 (5)称量 过量的标准盐酸 (6)0.1%
13. 硫酸铵是一种常见的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
指标项目 优等品 一等品 合格品
外 观 白色结晶,无可见机械杂质 无可见机械杂质
氮(N)含量 ≥21.0% ≥21.0% ≥20.5%
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
【观察外观】 该硫酸铵化肥无可见机械杂质。
【实验探究】 按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:______________________________,烧杯中盛放的试剂最好是________(填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是________________________________________________________________________。
【交流讨论】 甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:________________________________________________________
________________________________________________________________________。
乙同学:实验装置中还存在另一个明显缺陷是:___________________________________。
经过大家充分讨论一致认为:甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
【探究结论】 称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥________(填“是”或“不是”)一等品。
解析:本实验的设计思路为:将氮肥中的NH变为NH3,用稀硫酸吸收,通过增重来得到NH3的质量,从而推算出化肥的含氮量。但是实验缺少一个将NH3全部赶出A装置的设计,NH3在A装置中有残留,在A、B之间应加一个干燥装置,如增加一个装有碱石灰的干燥管,以吸收水分,减少误差。
增加的质量为生成的NH3的质量,由N元素守恒有
N ~ NH3
14 17
2.8 g 3.4 g
该化肥的含氮量=×100%=20.7%<21.0%,所以该化肥不是一等品。
答案:实验探究:(1)NH+OH-NH3↑+H2O 稀硫酸
(2)使硫酸铵充分反应,完全转化为NH3
交流讨论:A、B装置间缺一个干燥装置
缺少赶尽反应装置中残留氨气的装置 不是
14.(2009·广东化学,21)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是________,现象是________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:________; 假设2:________; 假设3:________。
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
实验步骤 预期现象与结论
步骤1:
步骤2:
步骤3:
……
解析:(1)根据A中石灰水变浑浊,知有CO2气体,B中有红色固体生成,说明CuO被还原,C中石灰水变浑浊,可知B中CuO被CO还原。
(3)因为题目中说明铁不以三价存在,只能是以二价铁或单质形式,或两者混合物存在。
步骤1:利用K2CO3的溶解性,除去K2CO3;
步骤2:利用铁能置换出Cu,而FeO不能置换出Cu来检验是否含铁单质;
步骤3:利用盐酸酸化分离出FeO,再用H2O2氧化,利用KSCN是否变色,来验证固体中是否含FeO。
答案:(1)CO和CO2
(2)焰色反应 透过蓝色钴玻璃观察到紫色火焰
(3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
实验步骤 预期现象与结论
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 固体产物部分溶解
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡。 (1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。(2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在。
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 结合步骤2中的(2);(1)若溶液基本无色,则假设1成立。(2)若溶液呈血红色,则假设3成立。
1.用下列实验装置完成对应的实验(部分仪器已省略),操作正确并能达到实验目的的是( )
解析:A项应“长进短出”;C项,温度计水银球的位置应与蒸馏烧瓶支管在同一水平线上;D项,由于白磷的着火点远低于红磷,二者位置应对调。
答案:B
2. 以下说法正确的是( )
A.利用丁达尔效应可以区别溶液和胶体
B.保存FeCl2溶液时常加入少量铁粉以防止Fe2+水解
C.油脂皂化以后可以用渗析的方法使高级脂肪酸钠和甘油充分分离
D.电解法精炼铜时用硫酸铜作电解液,电解后溶液中Cu2+可能消耗完
解析:选项A,胶体具有丁达尔现象,溶液则无,故可用丁达尔效应区别之。选项B,加入少量铁粉是防止Fe2+被氧化。选项C,分离高级脂肪酸钠和甘油应采用盐析的方法。选项D,溶液中消耗的Cu2+可由阳极的粗铜补充,所以电解后溶液中的Cu2+浓度基本不变。
答案:A
3.下列实验设计能够成功的是( )
实验目的 实验步骤及现象
A 检验亚硫酸钠试样是否变质 试样白色沉淀沉淀不溶
B 检验某卤代烃是否是氯代烃 试样冷却出现白色沉淀
C 证明酸性条件下H2O2氧化性比I2强 NaI溶液溶液变蓝色
D 除去氯化钠溶液中的少量硫酸钠 溶液加适量盐酸
解析:A项应加BaCl2和盐酸来检测SO的存在;B项中应加HNO3至酸性,否则会生成Ag2SO4,干扰实验;C项中应该加入盐酸和淀粉的混合物,否则加入的HNO3会将I-氧化成I2;D项正确,加Na2CO3可除去过量的Ba2+。
答案:D
4.下列实验装置图完全正确的是( )
解析:A中的托盘天平,应该是左盘放药品,右盘放砝码,称量氢氧化钠固体应该用烧杯盛装;B中应该用玻璃棒引流,容量瓶应该用150 mL的;D中冷凝管进水和出水的方向错误,应该是下方进水,上方出水。
答案:C
5.下列实验方案合理的是( )
A.配制50 g质量分数为5% NaCl溶液:将45 mL水加入到盛有5 g NaCl的烧杯中,
搅拌溶解
B.制备乙酸乙酯:用如上图所示的实验装置
C.鉴定SO:向溶液中加入盐酸酸化的氯化钡溶液
D.鉴别环己烯和苯:将溴的四氯化碳溶液分别滴加到少量环己烯和苯中
解析:A项,配制的溶液溶质质量分数为10%;B项,缺少催化剂浓H2SO4,且导管不能插入液面下;C项,溶液中如有Ag+存在也会产生白色沉淀,所以A、B、C错;D项,环己烯属于不饱和烃,它能和溴加成而使溴的四氯化碳溶液褪色,故D正确。
答案:D
6.下列实验操作中,先后顺序正确的是( )
A.稀释浓硫酸时,先在烧杯中加入一定体积的浓硫酸,后注入蒸馏水
B.为测定硫酸铜晶体的结晶水含量,称量时,先称取一定量的晶体,后放入坩埚中
C.为检验酸性溶液中的Cl-和SO,先加硝酸银溶液,滤去沉淀后加硝酸钡溶液
D.在制取干燥纯净的氯气时,先使氯气通过水(或饱和食盐水),后通过浓硫酸
解析:A项中考查溶液的稀释问题,稀释规律是:将密度大的溶液倒入密度小的溶液中,应将浓硫酸加入到水中,故A错;B项中操作应是先称量空坩埚,然后将晶体放入坩埚中再一起称量;C项中SO对Cl-的检验有干扰;D项中在制取氯气时要用浓盐酸作原料,氯气中含有氯化氢及水蒸气两种杂质,通过水(或饱和食盐水)是为了除去HCl,再通过浓硫酸是为了除H2O,故D正确。
答案:D
7.在复杂的体系中,研究化学反应的先后顺序有利于解决问题,下列化学反应先后顺序的判断正确的是( )
A.含有等物质的量的AlO、OH-、CO的溶液中逐滴加入盐酸: AlO、Al(OH)3、 OH-、CO
B.含有等物质的量的FeBr2和FeI2的溶液中缓缓通入Cl2:I- 、Br-、Fe2+
C.向含有等物质的量的Ba(OH)2和KOH溶液中缓缓通入CO2:KOH、Ba(OH)2、BaCO3
D.向含有等物质的量的Fe3+、Ag+、Cu2+、H+的溶液中逐渐加入锌粉:Ag+、Fe3+、 Cu2+、H+、Fe2+
解析:A中OH-先反应;B中Fe2+比Br-先反应;C中Ba(OH)2先反应。
答案:D
8.下列实验的设计不可行的是( )
A.在浓氨水中加入生石灰可以制取少量的NH3
B.用水就能一次性鉴别溴苯、苯、乙酸三种物质
C.用如图所示的装置测定黄铜(Cu、Zn合金)中Zn的含量
D.除去粗盐中的Ca2+、Mg2+、SO,依次加入的物质是H2O、Ba(OH)2、Na2CO3、HCl
解析C项不能用稀硝酸,应选用盐酸,装置中的集气瓶应左管短达到进气的目的,右管长达到出水的目的。
答案:C
9.某化学小组为测定一定质量的某铜铝混合物中铜的质量分数,设计了如下实验方案:
方案Ⅰ:铜铝混合物测定生成气体的体积
方案Ⅱ:铜铝混合物测定剩余固体的质量
下列有关判断中不正确的是( )
A.溶液A和B均可以是盐酸或NaOH溶液
B.若溶液B选用浓硝酸,则测得铜的质量分数偏小
C.溶液A和B均可选用稀硝酸
D.实验室中方案Ⅱ更便于实施
解析:利用铜与铝的性质差异,可选择非氧化性酸、强碱或冷的氧化性酸,让其中一种金属参加反应,可达到目的。对于B项,铝可钝化,生成少量氧化铝,测铝的质量偏大,故铜的质量分数偏小。
答案:C
10.右图为实验室制氢气的简易装置。若在加稀硫酸时,发现锌粒与稀硫酸没有接触而稀硫酸又不够了,为使该反应顺利进行,则可以从长颈漏斗中加入的试剂是( )
①食盐水 ②KNO3溶液 ③适量稀硫酸铜溶液 ④Na2CO3溶液 ⑤CCl4 ⑥浓氨水
A.①③⑤ B.②⑥
C.③⑤ D.①②④
解析:②加入KNO3溶液后不产生H2,而产生NO;④Na2CO3溶液会与稀H2SO4反应产生CO2,既消耗稀H2SO4又会使产生的气体不纯;⑤CCl4在下层,使稀H2SO4与锌粒接触;⑥浓氨水会与稀H2SO4反应。
答案:A
二、非选择题
11.现拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。已知实验中可能会发生下列反应:
①2Mg+O22MgO ②3Mg+N2Mg3N2 ③2Mg+CO22MgO+C ④Mg+H2OMgO+H2↑ ⑤Mg3N2+6H2O===3Mg(OH)2↓+2NH3↑
可供选择的装置和药品如下图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。
回答下列问题:
(1)在设计实验方案时,除装置A、E外,还应选择的装置(填字母代号)及其目的分别是________________________________________________________________________
________________________________________________________________________。
(2)连接并检查实验装置的气密性。实验开始时,打开自来水的开关,将空气从5升的储气瓶压入反应装置,则气流流经导管的顺序是(填字母代号)_____________________;
(3)通气后,如果同时点燃A、F装置的酒精灯,对实验结果有何影响?________,原因是______________________________________________________________________
________________________________________________________________________;
(4)请设计一个实验,验证产物是氮化镁:____________________________________
________________________________________________________________________
________________________________________________________________________。
解析:由题目所提供的信息可知:Mg能与O2、CO2、H2O反应,空气中都含有这些气体,所以在Mg与N2反应前先除去以上三种气体,顺序为先除CO2(D装置),再除H2O(B装置),最后除O2(F装置)。在连接装置时,要注意气体流向(长进短出)。Fe与O2反应时应在加热条件(或温度较高)下进行,铁粉没有达到反应温度,不能与O2反应,导致O2除不尽。根据反应⑤可知Mg3N2的水解产物有NH3,可通过测定水解的产物中NH3的存在推出产物是Mg3N2。
答案:(1)B 目的是除气流中的水蒸气,避免反应④发生;
D 目的是除空气中的CO2,避免反应③发生;
F 目的是除空气中的氧气,避免反应①发生
(2)h→h→g→d→c→k→l(或l→k)→a→b(或b→a)
(3)使氮化镁不纯 如果装置F中的还原铁粉没有达到反应温度时,氧气不能除尽,导致氧同镁反应,而使氮化镁中混入氧化镁
(4)取适量产物放入试管中,滴加蒸馏水,将润湿的红色石蕊试纸靠近试管口,如果试管中的溶液出现浑浊,红色石蕊试纸变蓝,则可以证明有氮化镁生成
12.实验室用大理石等原料制取安全无毒的杀菌剂过氧化钙。大理石的主要杂质是氧化铁,以下是提纯大理石的实验步骤:
(1)溶解大理石时,用硝酸而不用硫酸的原因是____________________。
(2)操作Ⅱ的目的是________,溶液A(溶质是共价化合物)是________。
(3)写出检验滤液中是否含铁离子的方法: ____________________________________
________________________________________________________________________。
(4)写出加入碳酸铵所发生反应的离子方程式:___________________________________。
写出滤液B的一种用途:______________________________________________________。
(5)CaO2中一般含CaO。试按下列提示完成CaO2含量分析的实验设计。
试剂:氢氧化钠标准溶液、盐酸标准溶液、酚酞
仪器:电子天平、锥形瓶、滴定管
实验步骤:
①________;②加入________;③加入酚酞,用氢氧化钠标准溶液滴定。
(6)若理论上滴定时耗用标准溶液20.00 mL恰好完全反应,实际操作中过量半滴(1 mL溶液为25滴),则相对误差为________。
解析:(1)H2SO4与CaCO3反应生成CaSO4,CaSO4微溶于水,附着在CaCO3的表面,阻止反应进一步发生。
(2)溶液A应呈碱性且溶质为共价化合物,故溶液A是氨水,目的是除去Fe3+。
(3)Fe3+能与KSCN溶液反应生成红色的Fe(SCN)3,用此反应物质来检验Fe3+的存在。
(4)滤液B的主要成分是NH4NO3,可用于制造化肥。
(5)首先称量固体的质量,再加入过量的盐酸标准溶液,过量的盐酸再用NaOH标准溶液滴定。
(6)半滴溶液的体积为×=mL,则相对误差为×100%=0.1%。
答案:(1)硫酸钙微溶于水 (2)除去溶液中Fe3+ 氨水
(3)取少量滤液,向其中加入硫氰化钾溶液,溶液不变红色,说明滤液中不含Fe3+;或取少量滤液,向其中加入硫氰化钾溶液,溶液变红色,说明滤液中含Fe3+
(4)Ca2++CO===CaCO3↓ 作化肥 (5)称量 过量的标准盐酸 (6)0.1%
13. 硫酸铵是一种常见的铵态氮肥。下表是硫酸铵化肥品质的主要指标。
指标项目 优等品 一等品 合格品
外 观 白色结晶,无可见机械杂质 无可见机械杂质
氮(N)含量 ≥21.0% ≥21.0% ≥20.5%
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究。
【观察外观】 该硫酸铵化肥无可见机械杂质。
【实验探究】 按右图所示装置进行实验。
(1)烧瓶内发生反应的离子方程式为:______________________________,烧杯中盛放的试剂最好是________(填“浓硫酸”、“稀硫酸”或“水”)。
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是________________________________________________________________________。
【交流讨论】 甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:________________________________________________________
________________________________________________________________________。
乙同学:实验装置中还存在另一个明显缺陷是:___________________________________。
经过大家充分讨论一致认为:甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验。
【探究结论】 称取13.5 g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4 g。则该化肥________(填“是”或“不是”)一等品。
解析:本实验的设计思路为:将氮肥中的NH变为NH3,用稀硫酸吸收,通过增重来得到NH3的质量,从而推算出化肥的含氮量。但是实验缺少一个将NH3全部赶出A装置的设计,NH3在A装置中有残留,在A、B之间应加一个干燥装置,如增加一个装有碱石灰的干燥管,以吸收水分,减少误差。
增加的质量为生成的NH3的质量,由N元素守恒有
N ~ NH3
14 17
2.8 g 3.4 g
该化肥的含氮量=×100%=20.7%<21.0%,所以该化肥不是一等品。
答案:实验探究:(1)NH+OH-NH3↑+H2O 稀硫酸
(2)使硫酸铵充分反应,完全转化为NH3
交流讨论:A、B装置间缺一个干燥装置
缺少赶尽反应装置中残留氨气的装置 不是
14.(2009·广东化学,21)三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O可用于摄影和蓝色印刷。某小组将无水三草酸合铁酸钾在一定条件下加热分解,对所得气体产物和固体产物进行实验和探究。请利用实验室常用仪器、用品和以下限选试剂完成验证和探究过程。
限选试剂:浓硫酸、1.0 mol·L-1 HNO3、1.0 mol·L-1盐酸、1.0 mol·L-1 NaOH、3% H2O2、0.1 mol·L-1 KI、0.1 mol·L-1 CuSO4、20% KSCN、澄清石灰水、氧化铜、蒸馏水。
(1)将气体产物依次通过澄清石灰水(A)、浓硫酸、灼热氧化铜(B)、澄清石灰水(C),观察到A、C中澄清石灰水都变浑浊,B中有红色固体生成,则气体产物是________。
(2)该小组同学查阅资料后推知,固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。验证固体产物中钾元素存在的方法是________,现象是________。
(3)固体产物中铁元素存在形式的探究。
①提出合理假设
假设1:________; 假设2:________; 假设3:________。
②设计实验方案证明你的假设
③实验过程
根据②中方案进行实验。按下表的格式写出实验步骤、预期现象与结论。
实验步骤 预期现象与结论
步骤1:
步骤2:
步骤3:
……
解析:(1)根据A中石灰水变浑浊,知有CO2气体,B中有红色固体生成,说明CuO被还原,C中石灰水变浑浊,可知B中CuO被CO还原。
(3)因为题目中说明铁不以三价存在,只能是以二价铁或单质形式,或两者混合物存在。
步骤1:利用K2CO3的溶解性,除去K2CO3;
步骤2:利用铁能置换出Cu,而FeO不能置换出Cu来检验是否含铁单质;
步骤3:利用盐酸酸化分离出FeO,再用H2O2氧化,利用KSCN是否变色,来验证固体中是否含FeO。
答案:(1)CO和CO2
(2)焰色反应 透过蓝色钴玻璃观察到紫色火焰
(3)①全部为铁单质 全部为FeO 同时存在铁单质和FeO
③
实验步骤 预期现象与结论
步骤1:取适量固体产物于试管中,加入足量蒸馏水,充分振荡使K2CO3完全溶解。分离不溶固体与溶液,用蒸馏水充分洗涤不溶固体。 固体产物部分溶解
步骤2:向试管中加入适量CuSO4溶液,再加入少量上述不溶固体,充分振荡。 (1)若蓝色溶液颜色及加入的不溶固体无明显变化,则假设2成立。(2)若蓝色溶液颜色明显改变,且有暗红色固体物质生成,则证明有铁单质存在。
步骤3:继续步骤2中的(2),进行固液分离,用蒸馏水洗涤固体至洗涤液无色。取少量固体于试管中,滴加过量HCl后,静置,取上层清液,滴加适量H2O2,充分振荡后滴加KSCN。 结合步骤2中的(2);(1)若溶液基本无色,则假设1成立。(2)若溶液呈血红色,则假设3成立。
同课章节目录
