2021年高考化学真题分类汇编——物质结构与性质部分(有解析)
文档属性
| 名称 | 2021年高考化学真题分类汇编——物质结构与性质部分(有解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-22 09:34:55 | ||
图片预览


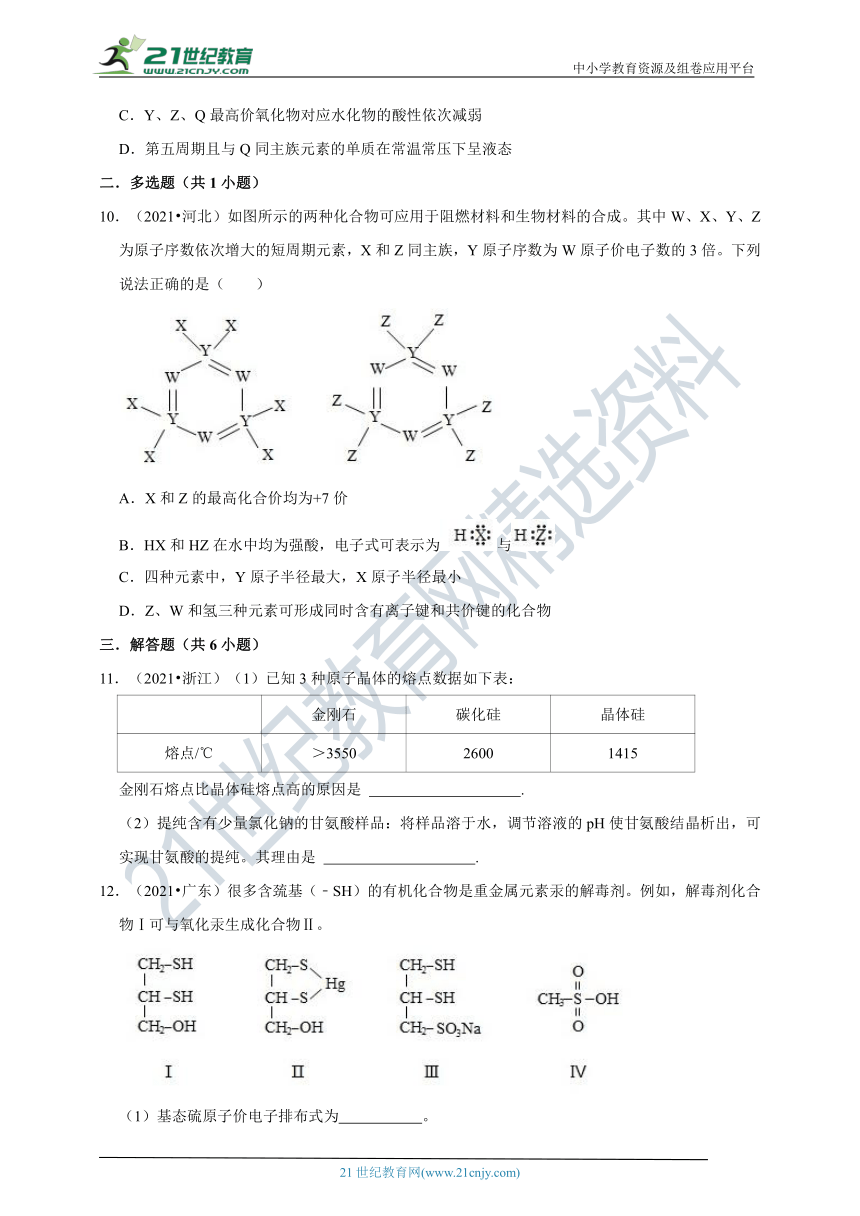


文档简介
2021年高考化学真题分类汇编——物质结构与性质部分
一.选择题(共9小题)
33054765878431.(2021?浙江)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A.还原性:ZQ2<ZR4
B.X能从ZQ2中置换出Z
C.Y能与Fe2O3反应得到Fe
D.M最高价氧化物的水化物能与其最低价氢化物反应
2.(2021?甲卷)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
A.原子半径:Z>Y>X>W
B.W与X只能形成一种化合物
C.Y的氧化物为碱性氧化物,不与强碱反应
D.W、X和Z可形成既含有离子键又含有共价键的化合物
3.(2021?广东)“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )
A.煤油是可再生能源
B.H2燃烧过程中热能转化为化学能
C.火星陨石中的20Ne质量数为20
D.月壤中的3He与地球上的3H互为同位素
4.(2021?河北)用中子轰击X原于产生α粒子(即氦核He)的核反应为:X+n→Y+He。已知元素Y在化合物中呈+1价。下列说法正确的是( )
A.H3XO3可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y2O2
C.X和氢元素形成离子化合物
D.6Y和7Y互为同素异形体
5.(2021?广东)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法2881964121953不正确的是( )
A.XEZ4是一种强酸
B.非金属性:W>Z>Y
C.原子半径:Y>W>E
D.ZW2中,Z的化合价为+2价
6.(2021?湖南)W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2:1的18e﹣分子。下列说法正确的是( )
A.简单离子半径:Z>X>Y
B.W与Y能形成含有非极性键的化合物
C.X和Y的最简单氢化物的沸点:X>Y
D.由W、X、Y三种元素所组成化合物的水溶液均显酸性
7.(2021?乙卷)我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
A.原子半径大小顺序为W>X>Y>Z
B.化合物XW中的化学键为离子键
C.Y单质的导电性能弱于Z单质的
D.Z的氧化物的水化物的酸性强于碳酸
8.(2021?浙江)下列含有共价键的盐是( )
A.CaCl2 B.H2SO4 C.Ba(OH)2 D.Na2CO3
9.(2021?浙江)现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如表,下列说法正确的是( )
元素
相关信息
X
最外层电子数是核外电子总数的一半
Y
最高化合价和最低化合价之和为零
Z
单质为淡黄色固体,常存在于火山喷口附近
Q
同周期元素中原子半径最小
A.常温时,X单质能与水发生剧烈反应
B.Y与Q元素组成的YQ4分子,空间构型为正四面体
C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱
D.第五周期且与Q同主族元素的单质在常温常压下呈液态
二.多选题(共1小题)
10.(2021?河北)如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是( )
A.X和Z的最高化合价均为+7价
B.HX和HZ在水中均为强酸,电子式可表示为与
C.四种元素中,Y原子半径最大,X原子半径最小
D.Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
三.解答题(共6小题)
11.(2021?浙江)(1)已知3种原子晶体的熔点数据如下表:
金刚石
碳化硅
晶体硅
熔点/℃
>3550
2600
1415
金刚石熔点比晶体硅熔点高的原因是 .
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是 .
12.(2021?广东)很多含巯基(﹣SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A.在Ⅰ中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅰ中C﹣C﹣C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg:Ge:Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
13.(2021?甲卷)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为 ;单晶硅的晶体类型为 。SiCl4是生成高纯硅的前驱体,其中Si采取的杂化类型为 。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为 (填标号)。
(2)CO2分子中存在 个σ键和 个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数 ,晶胞参数为apm、apm、cpm,该晶体密度为 g?cm﹣3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1﹣xOy,则y= (用x表达)。
14.(2021?河北)KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用﹣表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为 。
(3)已知有关氮、磷的单键和三键的键能(kJ?mol﹣1)如表:
N﹣N
N≡N
P﹣P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示)形式存在的原因是 。
(4)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 ,其中P采取 杂化方式。
(5)与PO43﹣电子总数相同的等电子体的分子式为 。
(6)磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为 。
(7)分别用〇、●表示H2PO4﹣和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO4﹣、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA,晶体的密度为 g?cm﹣3(写出表达式)。
②晶胞在x轴方向的投影图为 (填标号)。
15.(2021?乙卷)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(3)[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
PH3中P的杂化类型是 。NH3的沸点比PH3的 ,原因是 。H2O的键角小于NH3的,分析原因 。
(4)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为 %(列出计算表达式)。
16.(2021?湖南)硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为 ,晶体硅和碳化硅熔点较高的是 (填化学式);
(2)硅和卤素单质反应可以得到SiX4。
SiX4的熔沸点
SiF4
SiCl4
SiBr4
SiI4
熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是 ,气态SiX4分子的空间构型是 ;
②SiCl4与N﹣甲基咪唑()反应可以得到M2+,其结构如图所示:
N﹣甲基咪唑分子中碳原子的杂化轨道类型为 ,H、C、N的电负性由大到小的顺序为 ,1个M2+中含有 个σ键;
(3)如图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①已知化合物中Ge和O的原子个数比为1:4,图中Z表示 原子(填元素符号),该化合物的化学式为 ;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则该晶体的密度ρ= g?cm﹣3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
2021年高考化学真题分类汇编——物质结构与性质部分
参考答案与试题解析
一.选择题(共9小题)
1.【解答】结合分析可知,X为Mg,Y为Al,Z为C,M为N,Q为S,R为Cl元素
A.ZQ2、ZR4分别为CS2、CCl4,CS2中S元素易被氧化,而CCl4中Cl元素性质稳定,所以还原性ZQ2>ZR4,故A错误;
B.结合Mg与二氧化碳反应生成MgO可知,Mg能够与CS2反应生成MgS和S,故B正确;
C.Al能够与Fe2O3发生铝热反应生成Al2O3和Fe,故C正确;
D.M最高价氧化物的水化物能为硝酸,其最低价氢化物为氨气,氨气能够与硝酸反应生成硝酸铵,故D正确;
故选:A。
2.【解答】A.H、N、Al、S四种元素中H为第一周期主族元素,N为第二周期主族元素,而Al和S均为第三周期主族元素,核电荷数越大,原子半径越小,则四种元素的原子半径由大到小的顺序为Al>S>N>H,故A错误;
B.H和N可组成多种化合物如NH3、N2H4等,故B错误;
C.Al元素氧化物Al2O3是两性氧化物,能与强酸、强碱反应生成盐和水,故C错误;
D.H、N、S可以组成离子化合物(NH4)2S,既含有离子键又含有共价键,故D正确;
故选:D。
3.【解答】A.煤油为石油分馏产品,为不可再生能源,故A错误;
B.氢气燃烧过程中,发光发热,化学能主要转化为热能,还有一部分光能,故B错误;
C.依据核素的表示方法,20Ne质量数为20,故C正确;
D.同位素为相同元素的不同核素,其质子数相同,但3He、3H质子数不同,故D错误;
故选:C。
4.【解答】由分析可知X为B元素、Y为Li元素。
A.H3BO3酸性比较弱,可以用于中和溅在皮肤上的NaOH溶液,故A正确;
B.Li在空气中燃烧产物为Li2O,故B错误;
C.B元素与H元素之间形成共价化合物,故C错误;
D.6Li和7Li互为同位素,故D错误。
故选:A。
5.【解答】由上述分析可知,X为H、Y为C、Z为O、W为F、E为Cl,
A.XEZ4是高氯酸,为强酸,故A正确;
B.同周期从左向右非金属性增强,则非金属性:W>Z>Y,故B正确;
C.电子层越多、原子半径越大,同周期从左向右原子半径减小,则原子半径:E>Y>W,故C错误;
D.OF2中F为﹣1价,则O为+2价,故D正确;
故选:C。
6.【解答】结合分析可知,W为H,X为N,Y为O,Z为Na元素,
A.氮离子、氧离子、钠离子的核外电子层结构相同,核电荷数越大离子半径越小,则简单离子半径:X>Y>Z,故A错误;
B.W与Y形成的过氧化氢含有O﹣O非极性键,故B正确;
C.X和Y的最简单氢化物分别为氨气、水,常温下水为液态,氨气为气态,则沸点:X<Y,故C错误;
D.H、N、O三种元素所组成化合物的水溶液不一定显酸性吗,如一水合氨的水溶液呈碱性,故D错误;
故选:B。
7.【解答】结合分析可知,W为O,X为Mg,Y为Al,Z为Si元素,
A.同一周期从左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径大小顺序为X>Y>Z>W,故A错误;
B.XW为MgO,MgO为离子化合物,只含有离子键,故B正确;
C.Al为金属,属于导体,而Si单质为半导体材料,单质的导电性:Al>Si,即Y单质的导电性能强于Z单质的,故C错误;
D.Z的氧化物的水化物为硅酸,非金属性Si<C,则酸性:硅酸<碳酸,故D错误;
故选:B。
8.【解答】A.CaCl2由Ca2+和Cl﹣构成,只含有离子键不含有共价键,故A错误;
B.H2SO4由分子构成,只含有共价键不含有离子键,故B错误;
C.Ba(OH)2由Ba2+和OH﹣构成,属于碱,不属于盐,故C错误;
D.Na2CO3有Na+和CO32﹣构成,含有离子键,CO32﹣内部C与O原子之间还含有共价键,故D正确;
故选:D。
9.【解答】根据以上分析可知X是Be,Y是C或Si,Z是S,Q是Cl,
A.Be的金属性弱于Mg,常温时镁和冷水不反应,因此Be单质不能与水发生剧烈反应,故A错误;
B.Y与Q元素组成的CCl4或SiCl4分子,空间构型均为正四面体,故B正确;
C.Y、Z、Q三种元素的非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应水化物的酸性依次增强,故C错误;
D.第五周期且与Cl同主族元素的单质是碘,在常温常压下呈固态,故D错误;
故选:B。
二.多选题(共1小题)
10.【解答】A.由分析知X为F元素,是最强非金属元素,通常只显示﹣1价,Z是氯元素,其最高价是+7价,故A错误;
B.由分析知X为F元素、Z是氯元素,HF是弱酸,在水中显弱酸性,HCl为强酸,故B错误;
C.四种元素是N、F、P、Cl,同周期主族元素核电荷数越大,原子半径越小,原子核外电子层数越多,原子半径越大,则F的原子半径最小,P的原子半径最大,故C正确;
D.Cl、N和H三种元素组成的NH4Cl,是离子化合物,NH4+和Cl﹣之间存在离子键,N﹣H是共价键,故D正确;
故选:CD。
三.解答题(共6小题)
11.【解答】(1)原子晶体中,原子半径越小,共价键键能越大,熔点越高,原子半径C<Si(或键长C﹣C<Si﹣Si),键能C﹣C>Si﹣Si,金刚石熔点比晶体硅熔点高,
故答案为:原子半径C<Si(或键长C﹣C<Si﹣Si),键能C﹣C>Si﹣Si;
(2)调节溶液的pH,甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小,可以从溶剂中析出以除去溶剂中的氯化钠,
故答案为:当调节溶液pH至甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小。
12.【解答】(1)S位于周期表中第3周期第ⅥA族,基态硫原子的价电子排布式为3s23p4,
故答案为:3s23p4;
(2)CH4、H2S分子间只有分子间作用力,H2O分子间还存在氢键,则H2O的沸点最大,H2S的相对分子质量大于CH4,分子间作用力大于CH4,故沸点排序为:H2O>H2S>CH4,
故答案为:H2O>H2S>CH4;
(3)铬的原子序数为80,第六周期稀有气体的原子序数为86,则Hg位于第六周期第ⅡB族,
故答案为:六;
(4)A.在Ⅰ中每个S原子含有2个共价键、2个孤电子对,所以每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3,故A正确;
B.在Ⅱ中各元素非金属性O>C>S>Hg>H,电负性最大的为O,故B错误;
C.在Ⅰ中各原子大小不同,是非对称结构,C﹣C﹣C键角不是180°,故C错误;
D.在Ⅲ中,非金属原子形成共价键,钠原子形成离子键,故D正确;
E.在Ⅳ中硫氧单键和硫氧双键键能不同,所以硫氧键的键能不相等,故E错误,
故答案为:AD;
(5)化合物Ⅰ与化合物Ⅲ相比,Ⅲ属于盐类物质,水溶性更好,
故答案为:Ⅲ;
(6)①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,因为图b不是晶体中最小结构的重复单元,
故答案为:图b不是晶体中最小结构的重复单元;
②根据晶胞结构可知,X的晶体中与Hg距离最近的Sb的数目为4个;一个晶胞中Hg为:4×+6×=4,Ge:8×+4×+1=4,Sb:8×1=8,晶胞中粒子个数比Hg:Ge:Sb=4:4:8=1:1:2,
故答案为:4;1:1:2;
③根据晶胞中粒子个数比Hg:Ge:Sb=4:4:8,X的最简式的式量为Mr,1mol该晶胞的质量=4Mrg,晶胞的体积V=x2y nm3,ρ==g/cm3=g/cm3,
故答案为:。
13.【解答】(1)Si原子核外有14个电子,最外层为M能层,含有4个电子,价电子排布式为3s23p2;单晶硅为原子晶体;SiCl4中Si形成4个σ键,且无孤电子对,则为sp3杂化;中间体SiCl4(H2O)中Si分别与Cl、O形成5个共价键,应为杂化sp3d,
故答案为:3s23p2;原子晶体;sp3;②;
(2)CO2分子的结构式为O=C=O,含有2个σ键和2个π键,
故答案为:2;2;
(3)氧的非金属性强于硫,甲醇含有O﹣H键,可形成分子间氢键,水分子间氢键数目较多,甲硫醇分子间不含氢键,则水的沸点最高,甲硫醇沸点最低,
故答案为:甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多;
(4)Zr4+位于晶胞顶点,每个晶胞中有一个O2﹣与Zr4+距离最近,且面心的Zr4+与4个O2﹣相邻,则配位数为8,晶胞中Zr4+位于顶点和面心,个数为8×+6×=4,O2﹣位于晶胞体心,个数为8,则一个晶胞含有4个ZrO2,质量为,晶胞体积为a2c×10﹣30cm3,可知ρ==g?cm﹣3;在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1﹣xOy,化合物中Zn为+2价、Zr为+4价、O为﹣2价,则2x+4×(1﹣x)=2y,y=2﹣x,
故答案为:8;;2﹣x。
14.【解答】(1)在KH2PO4的四种组成元素的各自所能形成的简单离子中只有K+和P3﹣离子的核外电子的层数都为3,每层容纳的电子数分别为2,8,8,
故答案为:K+和P3﹣;
(2)P原子核外电子数为15,核外电子排布式为1s22s22p63s23p3,其价电子排布式为3s23p3,若一种自旋状态用+表示,与之相反的用﹣表示,则自旋磁量子数的代数和为(+)×4+(﹣)=+,也可以是﹣,
故答案为:+或﹣;
(3)从能量角度看,N≡N的键能为946,N﹣N的键能为193,N≡N键能比N﹣N的大,P≡P的键能为489,P﹣P的键能为197,P4分子中6个P﹣P的键能比2个P≡P大,键能越大越稳定,所以氮以N2、而白磷以P4(结构式可表示)形式存在,
故答案为:N≡N键能比N﹣N的大,P4分子中6个P﹣P的键能比P≡P大,键能越大越稳定;
(4)KH2PO2是次磷酸的正盐,说明其中的2个H原子不是羟基H原子,而直接与P原子形成共价键,则H3PO2的结构式为;H3PO2中含有4个σ键,无孤电子对,则中心的P原子采取sp3杂化,
故答案为:;sp3;
(5)PO43﹣电子总数为15+4×8+3=50,含有5个原子,价电子总数为5+6×4+3=32;与PO43﹣电子总数相同的等电子体的分子式为SiF4,
故答案为:SiF4;
(6)根据题干信息,相邻2个磷酸分子间脱水结合成链状或环状,n个磷酸分子间脱水形成环状的多磷酸中的每个P原子只有1个羟基和2个O原子,则分子式为(HPO3)n,则相应的酸根可写为(PO3)nn﹣,
故答案为:(PO3)nn﹣;
(7)根据如图所示,白球8个在顶点、4个在侧面上和1个在体心;黑球4个在垂直于底面的4条棱的棱心、上下面心各1个、4个侧面上各有1个;根据均摊法,得出晶胞中含有4个H2PO4﹣和4个K+,则1mol晶胞的质量为m=4×39g?mol﹣1+4×(2×1g?mol﹣1+31g?mol﹣1+4×16g?mol﹣1),晶胞的体积为V=a2cpm3=a2c×10﹣30cm3,代入ρ===g?cm﹣3;在晶胞图上xz面为侧面、yz面为正面,晶胞在x轴方向的z﹣y投影图应符合图(c),和图(b)中的H2PO4﹣、K+的相对位置,x轴方向的投影图的正面上应为小黑球在上,2个白球在下,投影图应为B,
故答案为:;B。
15.【解答】(1)24号Cr元素的原子的电子排布式为:1s22s22p63s23p63d54s1;
A.根据洪特规则的特例,原子轨道处于半满状态时能量低,稳定,则Cr原子的简化的核外电子排布应为[Ar]3d54s1,故A正确;
B.电子层是距离原子核由近到远排列的,则多电子原子中电子离核的平均距离4s>3s,离原子核越远,层数越大,能量越高,4s电子在4s区域出现的几率多,但不总是在比3s电子离核更远的区域运动,故B错误;
C.钾原子对键合电子的吸引力小,易失电子;而Cr原子对电子的键合能力越强,不易失电子,电负性比钾大,故C正确,
故答案为:AC;
(2)金属Cr3+离子提供空轨道,Cr3+离子与3个NH3、2个H2O分子、1个Cl﹣形成配位键,则提供电子对形成配位键的原子是N、O、Cl,配位数为6,
故答案为:N、O、Cl;6;
(3)PH3中P原子形成3个σ键,有1对孤电子对,则P的杂化类型是sp3杂化;NH3的分子间形成了氢键,而PH3中没有氢键的存在,氢键使物质的沸点升高,则NH3的沸点比PH3的高;H2O中O原子形成2个σ键,有2对孤电子对;NH3中N原子形成3个σ键,有1对孤电子对,VSEPR模型都为四面体构型,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,所以 H2O的键角小于NH3的键角,
故答案为:sp3;高;NH3的分子间形成了氢键;H2O和NH3的VSEPR模型都为四面体构型,H2O有2对孤电子对、NH3有1对孤电子对,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力;
(4)根据均摊法,晶胞中黑球位于晶胞的体心和顶点,含有的原子个数为8×+1=2;8个白球位于4条棱上和晶胞体内,含有的原子个数为8×+2=4;根据颗粒化学式AlCr2,Al原子与Cr原子的比为1:2,则处于顶角位置的黑球为Al,金属原子的空间占有率为×100%=×100%,
故答案为:Al;×100%。
16.【解答】(1)Si位于周期表中第3周期第ⅣA族,基态原子的价电子排布式为3s23p2,则基态Si原子的价电子排布图为:;晶体硅、碳化硅均属于原子晶体,原子半径:Si>C,键长:C﹣Si<Si﹣Si,则键能:C﹣Si>Si﹣Si,所以熔点:碳化硅>晶体硅,晶体硅和碳化硅熔点较高的是SiC,
故答案为:;SiC;
(2)①0℃为273K,呈液态的物质是:熔点<273K<沸点;根据表中数据知,SiF4的熔沸点都比273K低,而SiBr4和SiI4的熔沸点都比273K高,只有SiCl4的熔点低于273K,沸点高于273K;根据表中数据知,其熔沸点依次升高,这4种物质熔沸点都较低,说明为分子晶体,且都不含有氢键,结构相似的分子晶体熔沸点与分子间作用力成正比,其相对分子质量依次增大,分子间作用力逐渐增强,所以其熔沸点依次升高;根据价层电子对互斥理论,SiX4分子的中心原子的价层电子对数个数为4+(4﹣4×1)=4,则分子空间构型为正四面体构型;
故答案为:SiCl4;不含氢键的分子结构相似的分子晶体,相对分子质量依次增大,分子间作用力逐渐增强;四面体形;
②甲基的C原子形成4个σ键,无孤电子对,C原子价层电子对个数是4,为sp3杂化;环上C原子形成3个σ键,无孤电子对,价层电子对个数是3,为sp2杂化;元素非金属性越强,其电负性越大,元素的非金属性大小:N>C>H,则电负性大小顺序为N>C>H;共价单键为σ键、共价双键中含有1个σ键、1个π键,配位键为σ键,则中含有12个σ键,则1个分子中含有12×4+6=54个σ键,则1mol该物质中含有54molσ键,
故答案为:sp3和sp2;N>C>H;54;
(3)①根据如图所示晶胞,根据均摊法,Z球位于晶胞内,位于晶胞的内部,含有4+4+4+4=16个;Y球有4个位于晶胞内,X球位于顶点的有8个,位于4条棱心的有4个,上下面心上各有2个,晶胞内有5个,则晶胞中共含有的X为8×+4×+6×+3×1=8个;已知化合物中Ge和O的原子个数比为1:4,则为1:4比例的为X:Z,所以图中Z表示O原子,Y表示Ge原子,X表示Mg原子,则该化合物的化学式为Mg2GeO4,
故答案为:O;Mg2GeO4;
②晶胞的总质量为m==g,晶胞的体积为V=abcnm3=abc×10﹣21cm3,代入根据晶体的密度ρ==,
故答案为:。
一.选择题(共9小题)
33054765878431.(2021?浙江)已知短周期元素X、Y、Z、M、Q和R在周期表中的相对位置如图所示,其中Y的最高化合价为+3。下列说法不正确的是( )
A.还原性:ZQ2<ZR4
B.X能从ZQ2中置换出Z
C.Y能与Fe2O3反应得到Fe
D.M最高价氧化物的水化物能与其最低价氢化物反应
2.(2021?甲卷)W、X、Y、Z为原子序数依次增大的短周期主族元素,Z的最外层电子数是W和X的最外层电子数之和,也是Y的最外层电子数的2倍。W和X的单质常温下均为气体。下列叙述正确的是( )
A.原子半径:Z>Y>X>W
B.W与X只能形成一种化合物
C.Y的氧化物为碱性氧化物,不与强碱反应
D.W、X和Z可形成既含有离子键又含有共价键的化合物
3.(2021?广东)“天问一号”着陆火星,“嫦娥五号”采回月壤。腾飞中国离不开化学,长征系列运载火箭使用的燃料有液氢和煤油等化学品。下列有关说法正确的是( )
A.煤油是可再生能源
B.H2燃烧过程中热能转化为化学能
C.火星陨石中的20Ne质量数为20
D.月壤中的3He与地球上的3H互为同位素
4.(2021?河北)用中子轰击X原于产生α粒子(即氦核He)的核反应为:X+n→Y+He。已知元素Y在化合物中呈+1价。下列说法正确的是( )
A.H3XO3可用于中和溅在皮肤上的NaOH溶液
B.Y单质在空气中燃烧的产物是Y2O2
C.X和氢元素形成离子化合物
D.6Y和7Y互为同素异形体
5.(2021?广东)一种麻醉剂的分子结构式如图所示。其中,X的原子核只有1个质子;元素Y、Z、W原子序数依次增大,且均位于X的下一周期;元素E的原子比W原子多8个电子。下列说法2881964121953不正确的是( )
A.XEZ4是一种强酸
B.非金属性:W>Z>Y
C.原子半径:Y>W>E
D.ZW2中,Z的化合价为+2价
6.(2021?湖南)W、X、Y、Z为原子序数依次增大的短周期主族元素,Y的原子序数等于W与X的原子序数之和,Z的最外层电子数为K层的一半,W与X可形成原子个数比为2:1的18e﹣分子。下列说法正确的是( )
A.简单离子半径:Z>X>Y
B.W与Y能形成含有非极性键的化合物
C.X和Y的最简单氢化物的沸点:X>Y
D.由W、X、Y三种元素所组成化合物的水溶液均显酸性
7.(2021?乙卷)我国嫦娥五号探测器带回1.731kg的月球土壤,经分析发现其构成与地球土壤类似。土壤中含有的短周期元素W、X、Y、Z,原子序数依次增大,最外层电子数之和为15。X、Y、Z为同周期相邻元素,且均不与W同族。下列结论正确的是( )
A.原子半径大小顺序为W>X>Y>Z
B.化合物XW中的化学键为离子键
C.Y单质的导电性能弱于Z单质的
D.Z的氧化物的水化物的酸性强于碳酸
8.(2021?浙江)下列含有共价键的盐是( )
A.CaCl2 B.H2SO4 C.Ba(OH)2 D.Na2CO3
9.(2021?浙江)现有4种短周期主族元素X、Y、Z和Q,原子序数依次增大,其中Z、Q在同一周期。相关信息如表,下列说法正确的是( )
元素
相关信息
X
最外层电子数是核外电子总数的一半
Y
最高化合价和最低化合价之和为零
Z
单质为淡黄色固体,常存在于火山喷口附近
Q
同周期元素中原子半径最小
A.常温时,X单质能与水发生剧烈反应
B.Y与Q元素组成的YQ4分子,空间构型为正四面体
C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱
D.第五周期且与Q同主族元素的单质在常温常压下呈液态
二.多选题(共1小题)
10.(2021?河北)如图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。下列说法正确的是( )
A.X和Z的最高化合价均为+7价
B.HX和HZ在水中均为强酸,电子式可表示为与
C.四种元素中,Y原子半径最大,X原子半径最小
D.Z、W和氢三种元素可形成同时含有离子键和共价键的化合物
三.解答题(共6小题)
11.(2021?浙江)(1)已知3种原子晶体的熔点数据如下表:
金刚石
碳化硅
晶体硅
熔点/℃
>3550
2600
1415
金刚石熔点比晶体硅熔点高的原因是 .
(2)提纯含有少量氯化钠的甘氨酸样品:将样品溶于水,调节溶液的pH使甘氨酸结晶析出,可实现甘氨酸的提纯。其理由是 .
12.(2021?广东)很多含巯基(﹣SH)的有机化合物是重金属元素汞的解毒剂。例如,解毒剂化合物Ⅰ可与氧化汞生成化合物Ⅱ。
(1)基态硫原子价电子排布式为 。
(2)H2S、CH4、H2O的沸点由高到低顺序为 。
(3)汞的原子序数为80,位于元素周期表第 周期第ⅡB族。
(4)化合物Ⅲ也是一种汞解毒剂。化合物Ⅳ是一种强酸。下列说法正确的有 。
A.在Ⅰ中S原子采取sp3杂化 B.在Ⅱ中S元素的电负性最大
C.在Ⅰ中C﹣C﹣C键角是180° D.在Ⅲ中存在离子键与共价键
E.在Ⅳ中硫氧键的键能均相等
(5)汞解毒剂的水溶性好,有利于体内重金属元素汞的解毒。化合物Ⅰ与化合物Ⅲ相比,水溶性较好的是 。
(6)理论计算预测,由汞(Hg)、锗(Ge)、锑(Sb)形成的一种新物质X为潜在的拓扑绝缘体材料。X的晶体可视为Ge晶体(晶胞如图a所示)中部分Ge原子被Hg和Sb取代后形成。
①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,理由是 。
②图c为X的晶胞,X的晶体中与Hg距离最近的Sb的数目为 ;该晶胞中粒子个数比Hg:Ge:Sb= 。
③设X的最简式的式量为Mr,则X晶体的密度为 g/cm3(列出算式)。
13.(2021?甲卷)我国科学家研发的全球首套千吨级太阳能燃料合成项目被形象地称为“液态阳光”计划。该项目通过太阳能发电电解水制氢,再采用高选择性催化剂将二氧化碳加氢合成甲醇。回答下列问题:
(1)太阳能电池板主要材料为单晶硅或多晶硅。Si的价电子层的电子排布式为 ;单晶硅的晶体类型为 。SiCl4是生成高纯硅的前驱体,其中Si采取的杂化类型为 。SiCl4可发生水解反应,机理如下:
含s、p、d轨道的杂化类型有:①dsp2、②sp3d、③sp3d2,中间体SiCl4(H2O)中Si采取的杂化类型为 (填标号)。
(2)CO2分子中存在 个σ键和 个π键。
(3)甲醇的沸点(64.7℃)介于水(100℃)和甲硫醇(CH3SH,7.6℃)之间,其原因是 。
(4)我国科学家发明了高选择性的二氧化碳加氢合成甲醇的催化剂,其组成为ZnO/ZrO2固溶体。四方ZrO2晶胞如图所示。Zr4+离子在晶胞中的配位数 ,晶胞参数为apm、apm、cpm,该晶体密度为 g?cm﹣3(写出表达式)。在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1﹣xOy,则y= (用x表达)。
14.(2021?河北)KH2PO4晶体具有优异的非线性光学性能。我国科学工作者制备的超大KH2PO4晶体已应用于大功率固体激光器,填补了国家战略空白。回答下列问题:
(1)在KH2PO4的四种组成元素各自所能形成的简单离子中,核外电子排布相同的是 (填离子符号)。
(2)原子中运动的电子有两种相反的自旋状态,若一种自旋状态用+表示,与之相反的用﹣表示,称为电子的自旋磁量子数。对于基态的磷原子,其价电子自旋磁量子数的代数和为 。
(3)已知有关氮、磷的单键和三键的键能(kJ?mol﹣1)如表:
N﹣N
N≡N
P﹣P
P≡P
193
946
197
489
从能量角度看,氮以N2、而白磷以P4(结构式可表示)形式存在的原因是 。
(4)已知KH2PO2是次磷酸的正盐,H3PO2的结构式为 ,其中P采取 杂化方式。
(5)与PO43﹣电子总数相同的等电子体的分子式为 。
(6)磷酸通过分子间脱水缩合形成多磷酸,如:
如果有n个磷酸分子间脱水形成环状的多磷酸,则相应的酸根可写为 。
(7)分别用〇、●表示H2PO4﹣和K+,KH2PO4晶体的四方晶胞如图(a)所示,图(b)、图(c)分别显示的是H2PO4﹣、K+在晶胞xz面、yz面上的位置:
①若晶胞底边的边长均为apm、高为cpm,阿伏加德罗常数的值为NA,晶体的密度为 g?cm﹣3(写出表达式)。
②晶胞在x轴方向的投影图为 (填标号)。
15.(2021?乙卷)过渡金属元素铬(Cr)是不锈钢的重要成分,在工农业生产和国防建设中有着广泛应用。回答下列问题:
(1)对于基态Cr原子,下列叙述正确的是 (填标号)。
A.轨道处于半充满时体系总能量低,核外电子排布应为[Ar]3d54s1
B.4s电子能量较高,总是在比3s电子离核更远的地方运动
C.电负性比钾高,原子对键合电子的吸引力比钾大
(2)三价铬离子能形成多种配位化合物。[Cr(NH3)3(H2O)2Cl]2+中提供电子对形成配位键的原子是 ,中心离子的配位数为 。
(3)[Cr(NH3)3(H2O)2Cl]2+中配体分子NH3、H2O以及分子PH3的空间结构和相应的键角如图所示。
PH3中P的杂化类型是 。NH3的沸点比PH3的 ,原因是 。H2O的键角小于NH3的,分析原因 。
(4)在金属材料中添加AlCr2颗粒,可以增强材料的耐腐蚀性、硬度和机械性能。AlCr2具有体心四方结构,如图所示。处于顶角位置的是 原子。设Cr和Al原子半径分别为rCr和rAl,则金属原子空间占有率为 %(列出计算表达式)。
16.(2021?湖南)硅、锗(Ge)及其化合物广泛应用于光电材料领域。回答下列问题:
(1)基态硅原子最外层的电子排布图为 ,晶体硅和碳化硅熔点较高的是 (填化学式);
(2)硅和卤素单质反应可以得到SiX4。
SiX4的熔沸点
SiF4
SiCl4
SiBr4
SiI4
熔点/K
183.0
203.2
278.6
393.7
沸点/K
187.2
330.8
427.2
560.7
①0℃时,SiF4、SiCl4、SiBr4、SiI4呈液态的是 (填化学式),沸点依次升高的原因是 ,气态SiX4分子的空间构型是 ;
②SiCl4与N﹣甲基咪唑()反应可以得到M2+,其结构如图所示:
N﹣甲基咪唑分子中碳原子的杂化轨道类型为 ,H、C、N的电负性由大到小的顺序为 ,1个M2+中含有 个σ键;
(3)如图是Mg、Ge、O三种元素形成的某化合物的晶胞示意图。
①已知化合物中Ge和O的原子个数比为1:4,图中Z表示 原子(填元素符号),该化合物的化学式为 ;
②已知该晶胞的晶胞参数分别为anm、bnm、cnm,α=β=γ=90°,则该晶体的密度ρ= g?cm﹣3(设阿伏加德罗常数的值为NA,用含a、b、c、NA的代数式表示)。
2021年高考化学真题分类汇编——物质结构与性质部分
参考答案与试题解析
一.选择题(共9小题)
1.【解答】结合分析可知,X为Mg,Y为Al,Z为C,M为N,Q为S,R为Cl元素
A.ZQ2、ZR4分别为CS2、CCl4,CS2中S元素易被氧化,而CCl4中Cl元素性质稳定,所以还原性ZQ2>ZR4,故A错误;
B.结合Mg与二氧化碳反应生成MgO可知,Mg能够与CS2反应生成MgS和S,故B正确;
C.Al能够与Fe2O3发生铝热反应生成Al2O3和Fe,故C正确;
D.M最高价氧化物的水化物能为硝酸,其最低价氢化物为氨气,氨气能够与硝酸反应生成硝酸铵,故D正确;
故选:A。
2.【解答】A.H、N、Al、S四种元素中H为第一周期主族元素,N为第二周期主族元素,而Al和S均为第三周期主族元素,核电荷数越大,原子半径越小,则四种元素的原子半径由大到小的顺序为Al>S>N>H,故A错误;
B.H和N可组成多种化合物如NH3、N2H4等,故B错误;
C.Al元素氧化物Al2O3是两性氧化物,能与强酸、强碱反应生成盐和水,故C错误;
D.H、N、S可以组成离子化合物(NH4)2S,既含有离子键又含有共价键,故D正确;
故选:D。
3.【解答】A.煤油为石油分馏产品,为不可再生能源,故A错误;
B.氢气燃烧过程中,发光发热,化学能主要转化为热能,还有一部分光能,故B错误;
C.依据核素的表示方法,20Ne质量数为20,故C正确;
D.同位素为相同元素的不同核素,其质子数相同,但3He、3H质子数不同,故D错误;
故选:C。
4.【解答】由分析可知X为B元素、Y为Li元素。
A.H3BO3酸性比较弱,可以用于中和溅在皮肤上的NaOH溶液,故A正确;
B.Li在空气中燃烧产物为Li2O,故B错误;
C.B元素与H元素之间形成共价化合物,故C错误;
D.6Li和7Li互为同位素,故D错误。
故选:A。
5.【解答】由上述分析可知,X为H、Y为C、Z为O、W为F、E为Cl,
A.XEZ4是高氯酸,为强酸,故A正确;
B.同周期从左向右非金属性增强,则非金属性:W>Z>Y,故B正确;
C.电子层越多、原子半径越大,同周期从左向右原子半径减小,则原子半径:E>Y>W,故C错误;
D.OF2中F为﹣1价,则O为+2价,故D正确;
故选:C。
6.【解答】结合分析可知,W为H,X为N,Y为O,Z为Na元素,
A.氮离子、氧离子、钠离子的核外电子层结构相同,核电荷数越大离子半径越小,则简单离子半径:X>Y>Z,故A错误;
B.W与Y形成的过氧化氢含有O﹣O非极性键,故B正确;
C.X和Y的最简单氢化物分别为氨气、水,常温下水为液态,氨气为气态,则沸点:X<Y,故C错误;
D.H、N、O三种元素所组成化合物的水溶液不一定显酸性吗,如一水合氨的水溶液呈碱性,故D错误;
故选:B。
7.【解答】结合分析可知,W为O,X为Mg,Y为Al,Z为Si元素,
A.同一周期从左向右原子半径逐渐减小,同主族从上到下原子半径逐渐增大,则原子半径大小顺序为X>Y>Z>W,故A错误;
B.XW为MgO,MgO为离子化合物,只含有离子键,故B正确;
C.Al为金属,属于导体,而Si单质为半导体材料,单质的导电性:Al>Si,即Y单质的导电性能强于Z单质的,故C错误;
D.Z的氧化物的水化物为硅酸,非金属性Si<C,则酸性:硅酸<碳酸,故D错误;
故选:B。
8.【解答】A.CaCl2由Ca2+和Cl﹣构成,只含有离子键不含有共价键,故A错误;
B.H2SO4由分子构成,只含有共价键不含有离子键,故B错误;
C.Ba(OH)2由Ba2+和OH﹣构成,属于碱,不属于盐,故C错误;
D.Na2CO3有Na+和CO32﹣构成,含有离子键,CO32﹣内部C与O原子之间还含有共价键,故D正确;
故选:D。
9.【解答】根据以上分析可知X是Be,Y是C或Si,Z是S,Q是Cl,
A.Be的金属性弱于Mg,常温时镁和冷水不反应,因此Be单质不能与水发生剧烈反应,故A错误;
B.Y与Q元素组成的CCl4或SiCl4分子,空间构型均为正四面体,故B正确;
C.Y、Z、Q三种元素的非金属性逐渐增强,非金属性越强,最高价含氧酸的酸性越强,则最高价氧化物对应水化物的酸性依次增强,故C错误;
D.第五周期且与Cl同主族元素的单质是碘,在常温常压下呈固态,故D错误;
故选:B。
二.多选题(共1小题)
10.【解答】A.由分析知X为F元素,是最强非金属元素,通常只显示﹣1价,Z是氯元素,其最高价是+7价,故A错误;
B.由分析知X为F元素、Z是氯元素,HF是弱酸,在水中显弱酸性,HCl为强酸,故B错误;
C.四种元素是N、F、P、Cl,同周期主族元素核电荷数越大,原子半径越小,原子核外电子层数越多,原子半径越大,则F的原子半径最小,P的原子半径最大,故C正确;
D.Cl、N和H三种元素组成的NH4Cl,是离子化合物,NH4+和Cl﹣之间存在离子键,N﹣H是共价键,故D正确;
故选:CD。
三.解答题(共6小题)
11.【解答】(1)原子晶体中,原子半径越小,共价键键能越大,熔点越高,原子半径C<Si(或键长C﹣C<Si﹣Si),键能C﹣C>Si﹣Si,金刚石熔点比晶体硅熔点高,
故答案为:原子半径C<Si(或键长C﹣C<Si﹣Si),键能C﹣C>Si﹣Si;
(2)调节溶液的pH,甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小,可以从溶剂中析出以除去溶剂中的氯化钠,
故答案为:当调节溶液pH至甘氨酸主要以两性离子的形态存在时(即等电点,此时两性离子间相互吸引力最大),溶解度最小。
12.【解答】(1)S位于周期表中第3周期第ⅥA族,基态硫原子的价电子排布式为3s23p4,
故答案为:3s23p4;
(2)CH4、H2S分子间只有分子间作用力,H2O分子间还存在氢键,则H2O的沸点最大,H2S的相对分子质量大于CH4,分子间作用力大于CH4,故沸点排序为:H2O>H2S>CH4,
故答案为:H2O>H2S>CH4;
(3)铬的原子序数为80,第六周期稀有气体的原子序数为86,则Hg位于第六周期第ⅡB族,
故答案为:六;
(4)A.在Ⅰ中每个S原子含有2个共价键、2个孤电子对,所以每个S原子价层电子对个数都是4,根据价层电子对互斥理论判断S原子杂化类型为sp3,故A正确;
B.在Ⅱ中各元素非金属性O>C>S>Hg>H,电负性最大的为O,故B错误;
C.在Ⅰ中各原子大小不同,是非对称结构,C﹣C﹣C键角不是180°,故C错误;
D.在Ⅲ中,非金属原子形成共价键,钠原子形成离子键,故D正确;
E.在Ⅳ中硫氧单键和硫氧双键键能不同,所以硫氧键的键能不相等,故E错误,
故答案为:AD;
(5)化合物Ⅰ与化合物Ⅲ相比,Ⅲ属于盐类物质,水溶性更好,
故答案为:Ⅲ;
(6)①图b为Ge晶胞中部分Ge原子被Hg和Sb取代后形成的一种单元结构,它不是晶胞单元,因为图b不是晶体中最小结构的重复单元,
故答案为:图b不是晶体中最小结构的重复单元;
②根据晶胞结构可知,X的晶体中与Hg距离最近的Sb的数目为4个;一个晶胞中Hg为:4×+6×=4,Ge:8×+4×+1=4,Sb:8×1=8,晶胞中粒子个数比Hg:Ge:Sb=4:4:8=1:1:2,
故答案为:4;1:1:2;
③根据晶胞中粒子个数比Hg:Ge:Sb=4:4:8,X的最简式的式量为Mr,1mol该晶胞的质量=4Mrg,晶胞的体积V=x2y nm3,ρ==g/cm3=g/cm3,
故答案为:。
13.【解答】(1)Si原子核外有14个电子,最外层为M能层,含有4个电子,价电子排布式为3s23p2;单晶硅为原子晶体;SiCl4中Si形成4个σ键,且无孤电子对,则为sp3杂化;中间体SiCl4(H2O)中Si分别与Cl、O形成5个共价键,应为杂化sp3d,
故答案为:3s23p2;原子晶体;sp3;②;
(2)CO2分子的结构式为O=C=O,含有2个σ键和2个π键,
故答案为:2;2;
(3)氧的非金属性强于硫,甲醇含有O﹣H键,可形成分子间氢键,水分子间氢键数目较多,甲硫醇分子间不含氢键,则水的沸点最高,甲硫醇沸点最低,
故答案为:甲硫醇不能形成分子间氢键,而水和甲醇均能,且水比甲醇的氢键多;
(4)Zr4+位于晶胞顶点,每个晶胞中有一个O2﹣与Zr4+距离最近,且面心的Zr4+与4个O2﹣相邻,则配位数为8,晶胞中Zr4+位于顶点和面心,个数为8×+6×=4,O2﹣位于晶胞体心,个数为8,则一个晶胞含有4个ZrO2,质量为,晶胞体积为a2c×10﹣30cm3,可知ρ==g?cm﹣3;在ZrO2中掺杂少量ZnO后形成的催化剂,化学式可表示为ZnxZr1﹣xOy,化合物中Zn为+2价、Zr为+4价、O为﹣2价,则2x+4×(1﹣x)=2y,y=2﹣x,
故答案为:8;;2﹣x。
14.【解答】(1)在KH2PO4的四种组成元素的各自所能形成的简单离子中只有K+和P3﹣离子的核外电子的层数都为3,每层容纳的电子数分别为2,8,8,
故答案为:K+和P3﹣;
(2)P原子核外电子数为15,核外电子排布式为1s22s22p63s23p3,其价电子排布式为3s23p3,若一种自旋状态用+表示,与之相反的用﹣表示,则自旋磁量子数的代数和为(+)×4+(﹣)=+,也可以是﹣,
故答案为:+或﹣;
(3)从能量角度看,N≡N的键能为946,N﹣N的键能为193,N≡N键能比N﹣N的大,P≡P的键能为489,P﹣P的键能为197,P4分子中6个P﹣P的键能比2个P≡P大,键能越大越稳定,所以氮以N2、而白磷以P4(结构式可表示)形式存在,
故答案为:N≡N键能比N﹣N的大,P4分子中6个P﹣P的键能比P≡P大,键能越大越稳定;
(4)KH2PO2是次磷酸的正盐,说明其中的2个H原子不是羟基H原子,而直接与P原子形成共价键,则H3PO2的结构式为;H3PO2中含有4个σ键,无孤电子对,则中心的P原子采取sp3杂化,
故答案为:;sp3;
(5)PO43﹣电子总数为15+4×8+3=50,含有5个原子,价电子总数为5+6×4+3=32;与PO43﹣电子总数相同的等电子体的分子式为SiF4,
故答案为:SiF4;
(6)根据题干信息,相邻2个磷酸分子间脱水结合成链状或环状,n个磷酸分子间脱水形成环状的多磷酸中的每个P原子只有1个羟基和2个O原子,则分子式为(HPO3)n,则相应的酸根可写为(PO3)nn﹣,
故答案为:(PO3)nn﹣;
(7)根据如图所示,白球8个在顶点、4个在侧面上和1个在体心;黑球4个在垂直于底面的4条棱的棱心、上下面心各1个、4个侧面上各有1个;根据均摊法,得出晶胞中含有4个H2PO4﹣和4个K+,则1mol晶胞的质量为m=4×39g?mol﹣1+4×(2×1g?mol﹣1+31g?mol﹣1+4×16g?mol﹣1),晶胞的体积为V=a2cpm3=a2c×10﹣30cm3,代入ρ===g?cm﹣3;在晶胞图上xz面为侧面、yz面为正面,晶胞在x轴方向的z﹣y投影图应符合图(c),和图(b)中的H2PO4﹣、K+的相对位置,x轴方向的投影图的正面上应为小黑球在上,2个白球在下,投影图应为B,
故答案为:;B。
15.【解答】(1)24号Cr元素的原子的电子排布式为:1s22s22p63s23p63d54s1;
A.根据洪特规则的特例,原子轨道处于半满状态时能量低,稳定,则Cr原子的简化的核外电子排布应为[Ar]3d54s1,故A正确;
B.电子层是距离原子核由近到远排列的,则多电子原子中电子离核的平均距离4s>3s,离原子核越远,层数越大,能量越高,4s电子在4s区域出现的几率多,但不总是在比3s电子离核更远的区域运动,故B错误;
C.钾原子对键合电子的吸引力小,易失电子;而Cr原子对电子的键合能力越强,不易失电子,电负性比钾大,故C正确,
故答案为:AC;
(2)金属Cr3+离子提供空轨道,Cr3+离子与3个NH3、2个H2O分子、1个Cl﹣形成配位键,则提供电子对形成配位键的原子是N、O、Cl,配位数为6,
故答案为:N、O、Cl;6;
(3)PH3中P原子形成3个σ键,有1对孤电子对,则P的杂化类型是sp3杂化;NH3的分子间形成了氢键,而PH3中没有氢键的存在,氢键使物质的沸点升高,则NH3的沸点比PH3的高;H2O中O原子形成2个σ键,有2对孤电子对;NH3中N原子形成3个σ键,有1对孤电子对,VSEPR模型都为四面体构型,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力,所以 H2O的键角小于NH3的键角,
故答案为:sp3;高;NH3的分子间形成了氢键;H2O和NH3的VSEPR模型都为四面体构型,H2O有2对孤电子对、NH3有1对孤电子对,由于孤电子对间排斥力>孤电子对和成对电子对间的排斥力>成对电子对间的排斥力;
(4)根据均摊法,晶胞中黑球位于晶胞的体心和顶点,含有的原子个数为8×+1=2;8个白球位于4条棱上和晶胞体内,含有的原子个数为8×+2=4;根据颗粒化学式AlCr2,Al原子与Cr原子的比为1:2,则处于顶角位置的黑球为Al,金属原子的空间占有率为×100%=×100%,
故答案为:Al;×100%。
16.【解答】(1)Si位于周期表中第3周期第ⅣA族,基态原子的价电子排布式为3s23p2,则基态Si原子的价电子排布图为:;晶体硅、碳化硅均属于原子晶体,原子半径:Si>C,键长:C﹣Si<Si﹣Si,则键能:C﹣Si>Si﹣Si,所以熔点:碳化硅>晶体硅,晶体硅和碳化硅熔点较高的是SiC,
故答案为:;SiC;
(2)①0℃为273K,呈液态的物质是:熔点<273K<沸点;根据表中数据知,SiF4的熔沸点都比273K低,而SiBr4和SiI4的熔沸点都比273K高,只有SiCl4的熔点低于273K,沸点高于273K;根据表中数据知,其熔沸点依次升高,这4种物质熔沸点都较低,说明为分子晶体,且都不含有氢键,结构相似的分子晶体熔沸点与分子间作用力成正比,其相对分子质量依次增大,分子间作用力逐渐增强,所以其熔沸点依次升高;根据价层电子对互斥理论,SiX4分子的中心原子的价层电子对数个数为4+(4﹣4×1)=4,则分子空间构型为正四面体构型;
故答案为:SiCl4;不含氢键的分子结构相似的分子晶体,相对分子质量依次增大,分子间作用力逐渐增强;四面体形;
②甲基的C原子形成4个σ键,无孤电子对,C原子价层电子对个数是4,为sp3杂化;环上C原子形成3个σ键,无孤电子对,价层电子对个数是3,为sp2杂化;元素非金属性越强,其电负性越大,元素的非金属性大小:N>C>H,则电负性大小顺序为N>C>H;共价单键为σ键、共价双键中含有1个σ键、1个π键,配位键为σ键,则中含有12个σ键,则1个分子中含有12×4+6=54个σ键,则1mol该物质中含有54molσ键,
故答案为:sp3和sp2;N>C>H;54;
(3)①根据如图所示晶胞,根据均摊法,Z球位于晶胞内,位于晶胞的内部,含有4+4+4+4=16个;Y球有4个位于晶胞内,X球位于顶点的有8个,位于4条棱心的有4个,上下面心上各有2个,晶胞内有5个,则晶胞中共含有的X为8×+4×+6×+3×1=8个;已知化合物中Ge和O的原子个数比为1:4,则为1:4比例的为X:Z,所以图中Z表示O原子,Y表示Ge原子,X表示Mg原子,则该化合物的化学式为Mg2GeO4,
故答案为:O;Mg2GeO4;
②晶胞的总质量为m==g,晶胞的体积为V=abcnm3=abc×10﹣21cm3,代入根据晶体的密度ρ==,
故答案为:。
同课章节目录
