第十单元 酸和碱 实验活动6 酸、碱的化学性质 —人教版九年级化学下册课件(共35张PPT)
文档属性
| 名称 | 第十单元 酸和碱 实验活动6 酸、碱的化学性质 —人教版九年级化学下册课件(共35张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 9.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-22 16:25:10 | ||
图片预览







文档简介
第十单元 酸和碱
实验活动6 酸、碱的化学性质
新知预习
2.盐酸、硫酸、氢氧化钠是重要的化工原料。
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸
具有______。
(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为它
们的溶液中都含有___。(写符号)将带锈铁钉放入
试管后加入稀盐酸,看到_______________________
_____,反应的化学方程式 为:_________________
_______,待铁锈消失后又看到_________现象。
(3)氢氧化钠暴露在空气中,容易潮解,同时吸收空
气中的__________而变质,反应的化学方程式为:
__________________________,所以氢氧化钠固体必
须____保存。
吸水性
H+
二氧化碳
2NaOH+CO2===Na2CO3+H2O
密封
铁锈溶解,溶液由无色变黄色
Fe2O3+6HCl===2FeCl3
+3H2O
产生气泡
新知预习
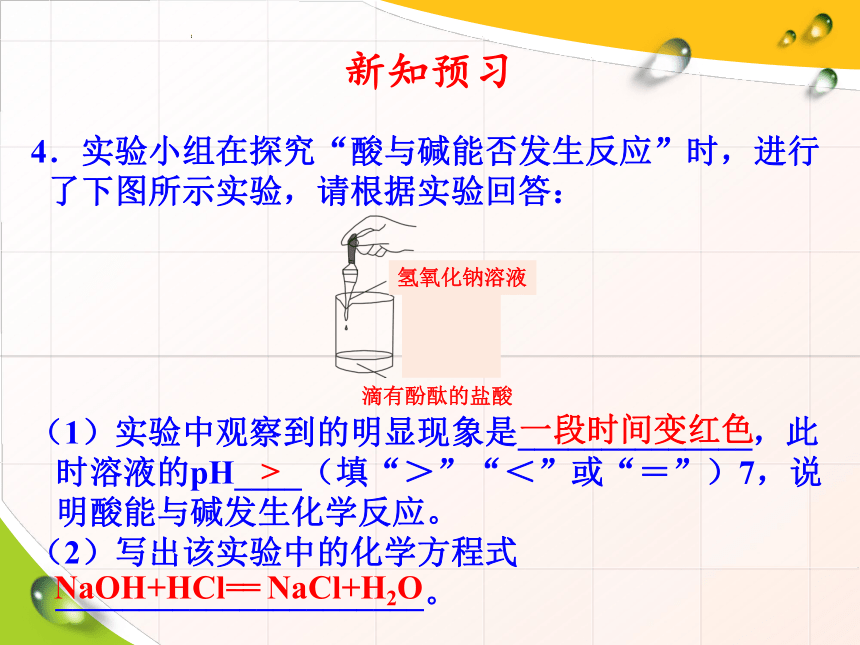
4.实验小组在探究“酸与碱能否发生反应”时,进行
了下图所示实验,请根据实验回答:
滴有酚酞的盐酸
(1)实验中观察到的明显现象是______________,此
时溶液的pH____(填“>”“<”或“=”)7,说
明酸能与碱发生化学反应。
(2)写出该实验中的化学方程式
______________________。
氢氧化钠溶液
一段时间变红色
>
NaOH+HCl== NaCl+H2O
三维目标
知识
与技能
加深对酸和碱的主要性质的认识,通过实验解释生活中的一些现象
过程
与方法
通过合作探究,动手实验、细心观察,进一步加深对酸、碱主要化学性质的理解和记忆,形成系统的关于酸、碱的知识网络
情感态度与价值观
通过合作和实验探究,培养严谨、细致的治学精神;培养学习兴趣,克服酸、碱学习中遇到的困难
重点难点
重点
通过实验,掌握酸和碱主要的化学性质
难点
形成酸、碱化学性质的知识网络
自主阅读教材,理解教材内容,初步归纳出本节课的知识点,并标注在教材中。
请大家利用5分钟时间:
酸、碱的化学性质
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
学习目标
一、探究酸的性质
1.酸、碱与酸碱指示剂作用
【操作步骤】
(1)取两个点滴板分别滴有稀盐酸、稀硫酸、氢氧化钠 溶液、氢氧化钙溶液。
图1 图2
新知探究
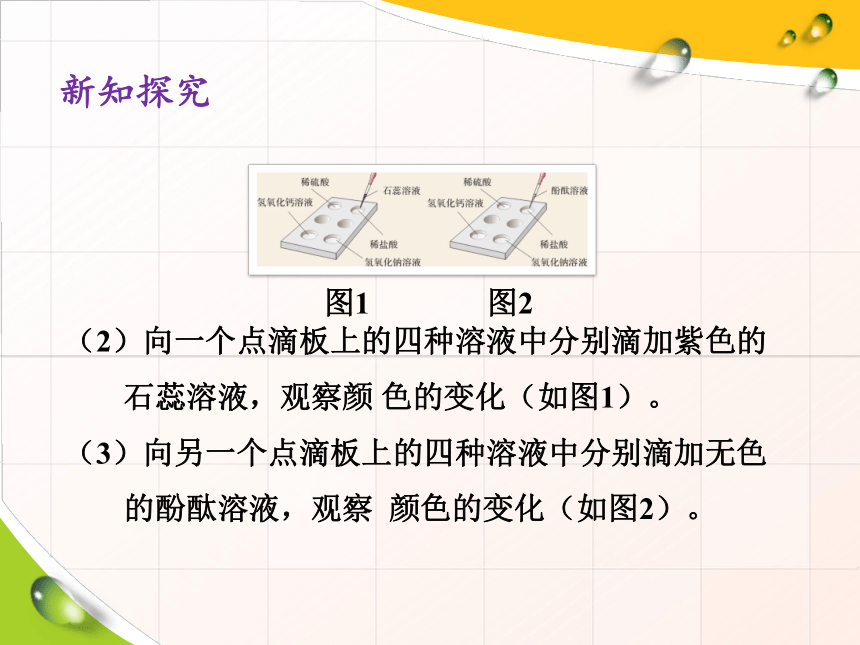
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜 色的变化(如图1)。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察 颜色的变化(如图2)。
图1 图2
新知探究
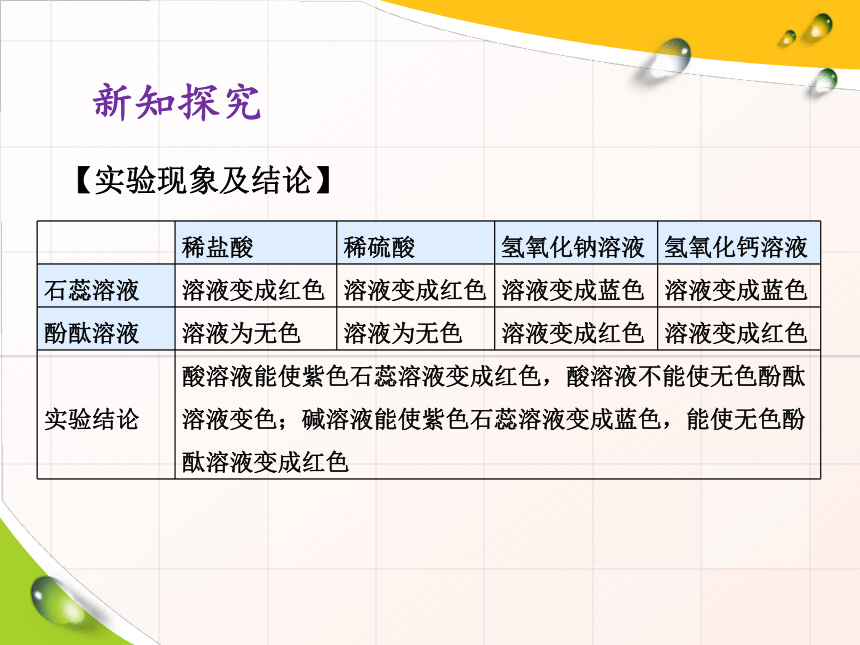
【实验现象及结论】
?
稀盐酸
稀硫酸
氢氧化钠溶液
氢氧化钙溶液
石蕊溶液
溶液变成红色
溶液变成红色
溶液变成蓝色
溶液变成蓝色
酚酞溶液
溶液为无色
溶液为无色
溶液变成红色
溶液变成红色
实验结论
酸溶液能使紫色石蕊溶液变成红色,酸溶液不能使无色酚酞溶液变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色
新知探究
2.酸与金属氧化物、金属反应
【操作步骤】
(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出洗净。继续观察另一支试管中的现象。
(3)过一段时间将铁钉取出,洗净。比较两支铁钉。
新知探究
【实验现象及结论】
?
反应现象
结论(化学方程式)
稀盐酸和生锈铁钉的反应
铁锈消失,铁钉变得光亮,溶液由无色变成黄色
Fe2O3+6HCl===2FeCl3+3H2O
光亮的铁钉继续与酸作用
光亮的铁钉表面有气泡冒出,溶液由黄色变成浅绿色
Fe + 2HCl===FeCl2+H2↑
新知探究
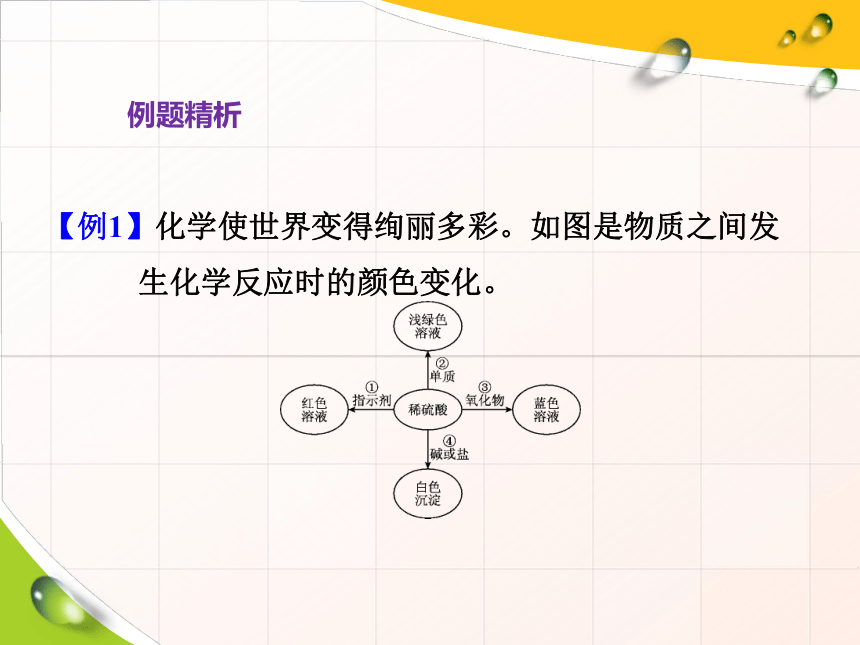
【例1】化学使世界变得绚丽多彩。如图是物质之间发生化学反应时的颜色变化。
例题精析
一瓶是酸、一瓶是碱?
两瓶无色溶液
酸碱和指示剂的反应
实验步骤:
1、取点滴板,向其中四个穴分别滴加2~3滴上边四种溶液,然后分别滴加2~3滴紫色石蕊
2、取点滴板,向其中四个穴分别滴加2~3滴上边四种溶液,然后分别滴加2~3滴无色酚酞
实验现象:
实验结论:
酸性溶液使紫色石蕊溶液变红色,不能使无色酚酞溶液变色,碱溶液能使紫色石蕊变蓝,使无色酚酞变红色
注意
酸和碱有腐蚀性,实验时应注意安全!
1.生产自来水的时,向水中通入一定量的氯气(Cl2)。这是因为氯气跟水反应,生成盐酸(HCl)和次氯酸(HClO),其中次氯酸具有强氧化性,可以起到消毒灭菌的作用。某学生用这种自来水来配制下列物质的溶液。不会与药品反应而使药品变质的是( )
A.石蕊试液 B.氢氧化钠溶液
C.碳酸钠溶液 D.氯化钠溶液
D
对应练习
2.如图表示化学反应中溶液的颜色变化。下列叙述错误的是( )
A.若X是稀盐酸,c不可能是单质
B.若X是稀硫酸,b可能是氧化物
C.若X是稀硫酸,a可能是紫色石蕊试液
D.若X是稀盐酸,d不可能是单质
A
对应练习
一、氢氧化钠(NaOH)
1、物理性质:白色固体,易溶于水,溶于水时放热。该固体在空气中易吸水而潮解(物理变化),可作某些气体的干燥剂(不能干燥CO2、SO2、HCl等酸性气体)。
二、探究碱的性质
2014年9月,哈尔滨市呼兰区一名两岁半女婴在家中误将氢氧化钠当成冰糖服下,食管和胃幽门部分组织被烧伤。
一、氢氧化钠(NaOH)
2、俗名:烧碱、火碱、苛性钠
3、氢氧化钠有强烈的腐蚀性,如果不慎将其沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液。
注意:称量氢氧化钠固体等易潮解,且具有腐蚀性的物质要放在玻璃器皿中。
一、氢氧化钠(NaOH)
注意:在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。
一、氢氧化钠(NaOH)
氢氧化钠的用途
肥 皂
石 油
造 纸
纺 织
印 染
氢氧化钠能与油脂反应
清洁剂中含有氢氧化钠。
2.中和反应
【操作步骤】在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。取该无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
【实验现象及结论】
新知探究
?
反应现象
结论(化学方程式)
向1 mL氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸
溶液由无色变成红色,然后溶液由红色变成无色
NaOH+HCl===NaCl+H2O
取上述无色的溶液1 mL置于蒸发皿中加热蒸干
蒸发皿上出现白色固体
?
新知探究
3. 氢氧化钙的性质
【实验步骤】
(1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡。
(2)向两支试管中各滴入1~2滴酚酞,观察现象。
(3)继续向其中一支试管中加入约1mL水,振荡;向另一支试管中加入约1mL稀盐酸,振荡。
(4)比较两支试管中的现象。
新知探究
【实验现象及结论】
?
反应现象
结论(化学方程式)
向少量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL水振荡
固体部分溶解,溶液由无色变为红色
氢氧化钙微溶于水,水溶液显碱性
向同质量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL稀盐酸振荡
固体部分溶解,溶液由无色变为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色
Ca(OH)2+2HCl
===CaCl2+2H2O
新知探究
提出新问题:
如何测定溶液中碳酸钠的质量分数?
实现该目的需要哪些数据?如何测得?
【任务一】画出转化流程图。
【任务二】简述实验设计方案。
定性探究
定量探究
*
取10g溶液和足量的稀盐酸,称量反应前后物质和仪器的总质量,通过质量守恒定律计算生成的二氧化碳的质量,根据化学方程式计算碳酸钠的质量,从而计算碳酸钠的质量分数。
质量守恒定律
方案一 减重法
*
用足量氢氧化钠吸收Na2CO3与足量盐酸生成的CO2气体,分别称量反应前后吸收CO2装置的总质量,两次质量差即为生成的二氧化碳的质量。
方案二 吸收法
*
用吸收法测定生成的CO2质量,(碱石灰可以吸收水和二氧化碳),请用字母连出实验装置图,并注明各装置的用途。
*
转化为CO2
除去杂质H2O
吸收生成的CO2
反思:装置有何不足之处?
*
防止空气中的CO2、H2O被D1 吸收
*
A中反应停止后,A中的气压和大气压相等,A中残留的二氧化碳气体不能自动进入后续装置。
*
总 结
明确实验目的是前提
分析干扰因素是关键
物质的性质是分析的基础
无论是定性研究还是定量测定
实验活动6 酸、碱的化学性质
新知预习
2.盐酸、硫酸、氢氧化钠是重要的化工原料。
(1)浓硫酸是实验室常用的气体干燥剂,说明浓硫酸
具有______。
(2)稀盐酸和稀硫酸都可以用于金属除锈,是因为它
们的溶液中都含有___。(写符号)将带锈铁钉放入
试管后加入稀盐酸,看到_______________________
_____,反应的化学方程式 为:_________________
_______,待铁锈消失后又看到_________现象。
(3)氢氧化钠暴露在空气中,容易潮解,同时吸收空
气中的__________而变质,反应的化学方程式为:
__________________________,所以氢氧化钠固体必
须____保存。
吸水性
H+
二氧化碳
2NaOH+CO2===Na2CO3+H2O
密封
铁锈溶解,溶液由无色变黄色
Fe2O3+6HCl===2FeCl3
+3H2O
产生气泡
新知预习
4.实验小组在探究“酸与碱能否发生反应”时,进行
了下图所示实验,请根据实验回答:
滴有酚酞的盐酸
(1)实验中观察到的明显现象是______________,此
时溶液的pH____(填“>”“<”或“=”)7,说
明酸能与碱发生化学反应。
(2)写出该实验中的化学方程式
______________________。
氢氧化钠溶液
一段时间变红色
>
NaOH+HCl== NaCl+H2O
三维目标
知识
与技能
加深对酸和碱的主要性质的认识,通过实验解释生活中的一些现象
过程
与方法
通过合作探究,动手实验、细心观察,进一步加深对酸、碱主要化学性质的理解和记忆,形成系统的关于酸、碱的知识网络
情感态度与价值观
通过合作和实验探究,培养严谨、细致的治学精神;培养学习兴趣,克服酸、碱学习中遇到的困难
重点难点
重点
通过实验,掌握酸和碱主要的化学性质
难点
形成酸、碱化学性质的知识网络
自主阅读教材,理解教材内容,初步归纳出本节课的知识点,并标注在教材中。
请大家利用5分钟时间:
酸、碱的化学性质
【实验目的】
1.加深对酸和碱的主要性质的认识。
2.通过实验解释生活中的一些现象。
学习目标
一、探究酸的性质
1.酸、碱与酸碱指示剂作用
【操作步骤】
(1)取两个点滴板分别滴有稀盐酸、稀硫酸、氢氧化钠 溶液、氢氧化钙溶液。
图1 图2
新知探究
(2)向一个点滴板上的四种溶液中分别滴加紫色的石蕊溶液,观察颜 色的变化(如图1)。
(3)向另一个点滴板上的四种溶液中分别滴加无色的酚酞溶液,观察 颜色的变化(如图2)。
图1 图2
新知探究
【实验现象及结论】
?
稀盐酸
稀硫酸
氢氧化钠溶液
氢氧化钙溶液
石蕊溶液
溶液变成红色
溶液变成红色
溶液变成蓝色
溶液变成蓝色
酚酞溶液
溶液为无色
溶液为无色
溶液变成红色
溶液变成红色
实验结论
酸溶液能使紫色石蕊溶液变成红色,酸溶液不能使无色酚酞溶液变色;碱溶液能使紫色石蕊溶液变成蓝色,能使无色酚酞溶液变成红色
新知探究
2.酸与金属氧化物、金属反应
【操作步骤】
(1)取两个生锈的铁钉放入两支试管中,然后加入约2 mL稀盐酸,观察现象。
(2)当观察到铁钉表面的锈去掉变得光亮时,将其中一支试管中的铁钉取出洗净。继续观察另一支试管中的现象。
(3)过一段时间将铁钉取出,洗净。比较两支铁钉。
新知探究
【实验现象及结论】
?
反应现象
结论(化学方程式)
稀盐酸和生锈铁钉的反应
铁锈消失,铁钉变得光亮,溶液由无色变成黄色
Fe2O3+6HCl===2FeCl3+3H2O
光亮的铁钉继续与酸作用
光亮的铁钉表面有气泡冒出,溶液由黄色变成浅绿色
Fe + 2HCl===FeCl2+H2↑
新知探究
【例1】化学使世界变得绚丽多彩。如图是物质之间发生化学反应时的颜色变化。
例题精析
一瓶是酸、一瓶是碱?
两瓶无色溶液
酸碱和指示剂的反应
实验步骤:
1、取点滴板,向其中四个穴分别滴加2~3滴上边四种溶液,然后分别滴加2~3滴紫色石蕊
2、取点滴板,向其中四个穴分别滴加2~3滴上边四种溶液,然后分别滴加2~3滴无色酚酞
实验现象:
实验结论:
酸性溶液使紫色石蕊溶液变红色,不能使无色酚酞溶液变色,碱溶液能使紫色石蕊变蓝,使无色酚酞变红色
注意
酸和碱有腐蚀性,实验时应注意安全!
1.生产自来水的时,向水中通入一定量的氯气(Cl2)。这是因为氯气跟水反应,生成盐酸(HCl)和次氯酸(HClO),其中次氯酸具有强氧化性,可以起到消毒灭菌的作用。某学生用这种自来水来配制下列物质的溶液。不会与药品反应而使药品变质的是( )
A.石蕊试液 B.氢氧化钠溶液
C.碳酸钠溶液 D.氯化钠溶液
D
对应练习
2.如图表示化学反应中溶液的颜色变化。下列叙述错误的是( )
A.若X是稀盐酸,c不可能是单质
B.若X是稀硫酸,b可能是氧化物
C.若X是稀硫酸,a可能是紫色石蕊试液
D.若X是稀盐酸,d不可能是单质
A
对应练习
一、氢氧化钠(NaOH)
1、物理性质:白色固体,易溶于水,溶于水时放热。该固体在空气中易吸水而潮解(物理变化),可作某些气体的干燥剂(不能干燥CO2、SO2、HCl等酸性气体)。
二、探究碱的性质
2014年9月,哈尔滨市呼兰区一名两岁半女婴在家中误将氢氧化钠当成冰糖服下,食管和胃幽门部分组织被烧伤。
一、氢氧化钠(NaOH)
2、俗名:烧碱、火碱、苛性钠
3、氢氧化钠有强烈的腐蚀性,如果不慎将其沾到皮肤上,要用大量的水冲洗,再涂上硼酸溶液。
注意:称量氢氧化钠固体等易潮解,且具有腐蚀性的物质要放在玻璃器皿中。
一、氢氧化钠(NaOH)
注意:在使用氢氧化钠时必须十分小心,防止眼睛、皮肤、衣服被它腐蚀。实验时最好戴防护眼镜。
一、氢氧化钠(NaOH)
氢氧化钠的用途
肥 皂
石 油
造 纸
纺 织
印 染
氢氧化钠能与油脂反应
清洁剂中含有氢氧化钠。
2.中和反应
【操作步骤】在试管中加入约1mL氢氧化钠溶液,滴入几滴酚酞溶液。然后边用滴管慢慢滴入稀盐酸,边不断振荡试管,至溶液颜色恰好变成无色为止。取该无色溶液约1mL置于蒸发皿中加热,使液体蒸干,观察现象。
【实验现象及结论】
新知探究
?
反应现象
结论(化学方程式)
向1 mL氢氧化钠溶液中加入几滴酚酞溶液,再慢慢地滴加稀盐酸
溶液由无色变成红色,然后溶液由红色变成无色
NaOH+HCl===NaCl+H2O
取上述无色的溶液1 mL置于蒸发皿中加热蒸干
蒸发皿上出现白色固体
?
新知探究
3. 氢氧化钙的性质
【实验步骤】
(1)向两支试管中各加入相同量的氢氧化钙粉末(用药匙的柄把一端挑一点),然后各加入1mL水,振荡。
(2)向两支试管中各滴入1~2滴酚酞,观察现象。
(3)继续向其中一支试管中加入约1mL水,振荡;向另一支试管中加入约1mL稀盐酸,振荡。
(4)比较两支试管中的现象。
新知探究
【实验现象及结论】
?
反应现象
结论(化学方程式)
向少量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL水振荡
固体部分溶解,溶液由无色变为红色
氢氧化钙微溶于水,水溶液显碱性
向同质量的氢氧化钙粉末中加入1 mL水,振荡,再滴入1~2滴酚酞溶液,再加入1 mL稀盐酸振荡
固体部分溶解,溶液由无色变为红色,加入盐酸后,固体全部溶解,溶液由红色变为无色
Ca(OH)2+2HCl
===CaCl2+2H2O
新知探究
提出新问题:
如何测定溶液中碳酸钠的质量分数?
实现该目的需要哪些数据?如何测得?
【任务一】画出转化流程图。
【任务二】简述实验设计方案。
定性探究
定量探究
*
取10g溶液和足量的稀盐酸,称量反应前后物质和仪器的总质量,通过质量守恒定律计算生成的二氧化碳的质量,根据化学方程式计算碳酸钠的质量,从而计算碳酸钠的质量分数。
质量守恒定律
方案一 减重法
*
用足量氢氧化钠吸收Na2CO3与足量盐酸生成的CO2气体,分别称量反应前后吸收CO2装置的总质量,两次质量差即为生成的二氧化碳的质量。
方案二 吸收法
*
用吸收法测定生成的CO2质量,(碱石灰可以吸收水和二氧化碳),请用字母连出实验装置图,并注明各装置的用途。
*
转化为CO2
除去杂质H2O
吸收生成的CO2
反思:装置有何不足之处?
*
防止空气中的CO2、H2O被D1 吸收
*
A中反应停止后,A中的气压和大气压相等,A中残留的二氧化碳气体不能自动进入后续装置。
*
总 结
明确实验目的是前提
分析干扰因素是关键
物质的性质是分析的基础
无论是定性研究还是定量测定
同课章节目录
