第九单元 课题3 溶液的浓度—人教版九年级化学下册课件(共23张PPT)
文档属性
| 名称 | 第九单元 课题3 溶液的浓度—人教版九年级化学下册课件(共23张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 19.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-22 16:29:24 | ||
图片预览








文档简介
第九单元 溶液
1、溶液是由 ______和 ______组成的。
2、A克水完全溶解了B克的某物质。
则所得溶液的质量为________克。
3、 80℃时,硝酸钾的溶解度为120克,则80℃时,将80克硝酸钾放入
50克水中充分溶解后所得溶液质量
为________克。
温故知新
溶质
溶剂
A+B
110
1
2
3
在三支试管中各加入20mL水,然后分别加入约1g、2g、3g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质质量
分数
1
2
3
浅蓝
蓝
深蓝
20g
20g
20g
1g
2g
3g
21g
22g
23g
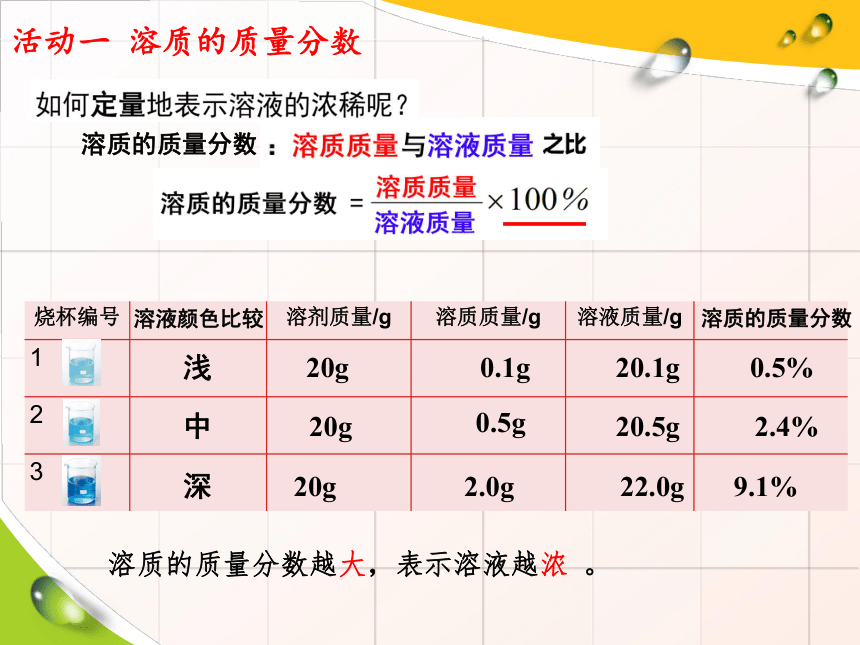
烧杯编号
溶剂质量/g
溶质质量/g
溶液质量/g
1
2
3
浅
中
深
20g
20g
20g
20.5g
0.1g
0.5g
2.0g
0.5%
2.4%
9.1%
溶质的质量分数越大,表示溶液越浓 。
活动一 溶质的质量分数
20.1g
22.0g
溶质的质量分数
溶液颜色比较
溶质的质量分数
变式1
变式2
变式3
活动一 溶质的质量分数
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【分析】
已知溶液的质量和溶质的质量分数求溶质和溶剂的质量。
活动一 溶质的质量分数
【延伸】已知20℃时氯化钠的溶解度为36.0g,在该温度下把40g氯化钠放入100g水中,充分搅拌,所得溶液中溶质的质量分数为多少?
饱和溶液溶质的质量分数=
计算溶液中溶质的质量分数时,溶质的质量只能是已溶解的部分,未溶解的部分不能作为溶质计算。
易错提示
活动一 溶质的质量分数
练习1、20g食盐溶液中含有 2g食盐,求:该溶液的溶质质量分数
练习2、40g质量分数为20%的食盐溶液中含有食盐多少克?含水多少克?
含食盐: 40 g× 20% =8 g
2g
20g
=10%
解:
答:略
解:
答:略
含 水: 40 g –8g = 32 g
NaCl%=
【对应练习】
活动二 溶液的稀释
近期,新型冠状病毒流行,小原一家需要
用体积分数为75%乙醇溶液对物品进行消毒,
但家中只有体积分数为95%的乙醇溶液,他应该怎么办呢?
乙醇溶液
【例题2】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是多少?
【问题】
在稀释的过程中 溶液质量、溶剂质量、溶质质量
哪一个量没变?
溶质的质量不变
活动二 溶液的稀释
[分析]溶液稀释前后,溶质的质量不变。
(浓)溶液质量x(浓)溶质的质量分数=(稀)溶液质量x(稀)溶质的质量分数
【例题2】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是多少?
稀释前
溶质的质量
稀释后
溶质的质量
x=195g
答:需要水的质量为195g。
=
活动二 溶液的稀释
1. 200C时,NaCl的溶解度是36克。现将20克NaCl放入50克水中,求:所得溶液的溶质质量分数
解:
X = 18g
则: 20克NaCl只有18克溶入水中
×100%
100g
36g
=
50g
x
或
36g
100g+36g
18g
50g+18g
×100%
答:略
≈ 26.5%
溶质在溶液中的质量分数为:
【对应练习】
2: 13克锌与100克稀硫酸恰好完全反应,求:
所得溶液中溶质的质量分数是多少?
解:设稀硫酸中溶质质量为x,生成硫酸锌的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑
65 98 161
13g x y
65 98
13g x
=
65 161
13g y
=
x = 19.6g
y = 32.2g
所得溶液中溶质的质量分数为:
32.2g
32.2g+(100 g-19.6g)
=28.6%
×100%
答:所得溶液中溶质的质量分数为28.6%。
【对应练习】
[实验步骤]
1.(固液法) 配制50g质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 ;水 。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看做1 g/cm), 倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠完全溶解。
(5)装瓶:
搅拌加速溶解
活动三 配制一定溶质质量分数的溶液
19
2.实验需要哪些仪器?
托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
思考
1.固液法实验步骤:
3.用托盘天平称量氯化钠时,有哪些注意事项?
(1)计算
(2)称量
(3)量取
(4)溶解
(5)装瓶贴标签
垫称量纸、先码后物、缓慢加入
2.实验需要哪些仪器?
调零、左物右码、
活动三 配制一定溶质质量分数的溶液
21
2.(稀释法)用已配好的质量分数为6%的氧化钠溶液(密度约为1.04 g/cm),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所需质量分数为6%的氯化钠溶液质量____g(体积___ mL);水____g。
(2)量取:用量简量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
(4) 装瓶贴标签:把配制好的上述两种氯化钠溶液分别装入细口瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
活动三 配制一定溶质质量分数的溶液
22
2.实验需要哪些仪器?
烧杯、玻璃棒、量筒、胶头滴管。
思考
1.稀释法实验步骤:
(1)计算
(2)量取
(3)溶解
(4)装瓶贴标签
2.实验需要哪些仪器?
3.稀释法配制一定溶质质量分数的溶液,哪些操作会使配制的浓度偏大?
浓溶液多了
溶剂少了
称量时
仰视取浓溶液
俯视取水
活动三 配制一定溶质质量分数的溶液
1. 100g某稀硫酸与13g锌恰好完全起反应。
试计算这种稀硫酸中溶质的质量分数。
x=19.6g
溶质质量分数:
【对应练习】
计算反应后所得溶液中溶质的质量分数时:
关键是求出反应后溶液中溶质的质量和溶液的质量。
①先确定所得的溶液中的溶质是什么,再利用化学方程式求出溶质的质量,有时还要看原固体中所含溶质的质量。
②求反应后所得溶液的质量:
A.溶液组成法:
反应后溶液质量=溶质质量+溶剂质量
B.质量守恒法:
反应后溶液质量=反应前的总质量-生成气体的质量-生成沉淀或杂质的质量
规律总结
典型例题方法小结
100 g某稀硫酸与13 g锌恰好完全起反应。
变式:(2)试计算所得溶液中溶质的质量分数。
典型例题方法小结
23
本课小结
1、溶液是由 ______和 ______组成的。
2、A克水完全溶解了B克的某物质。
则所得溶液的质量为________克。
3、 80℃时,硝酸钾的溶解度为120克,则80℃时,将80克硝酸钾放入
50克水中充分溶解后所得溶液质量
为________克。
温故知新
溶质
溶剂
A+B
110
1
2
3
在三支试管中各加入20mL水,然后分别加入约1g、2g、3g固体硫酸铜。比较三种溶液的颜色。
试管
编号
溶液颜
色比较
溶 剂
质量/g
溶 质
质量/g
溶 液
质量/g
溶质质量
分数
1
2
3
浅蓝
蓝
深蓝
20g
20g
20g
1g
2g
3g
21g
22g
23g
烧杯编号
溶剂质量/g
溶质质量/g
溶液质量/g
1
2
3
浅
中
深
20g
20g
20g
20.5g
0.1g
0.5g
2.0g
0.5%
2.4%
9.1%
溶质的质量分数越大,表示溶液越浓 。
活动一 溶质的质量分数
20.1g
22.0g
溶质的质量分数
溶液颜色比较
溶质的质量分数
变式1
变式2
变式3
活动一 溶质的质量分数
【例题1】在农业生产上,常需要用质量分数为16%的氯化钠溶液来选种。现要配制150kg这种溶液,需要氯化钠和水的质量各是多少?
【分析】
已知溶液的质量和溶质的质量分数求溶质和溶剂的质量。
活动一 溶质的质量分数
【延伸】已知20℃时氯化钠的溶解度为36.0g,在该温度下把40g氯化钠放入100g水中,充分搅拌,所得溶液中溶质的质量分数为多少?
饱和溶液溶质的质量分数=
计算溶液中溶质的质量分数时,溶质的质量只能是已溶解的部分,未溶解的部分不能作为溶质计算。
易错提示
活动一 溶质的质量分数
练习1、20g食盐溶液中含有 2g食盐,求:该溶液的溶质质量分数
练习2、40g质量分数为20%的食盐溶液中含有食盐多少克?含水多少克?
含食盐: 40 g× 20% =8 g
2g
20g
=10%
解:
答:略
解:
答:略
含 水: 40 g –8g = 32 g
NaCl%=
【对应练习】
活动二 溶液的稀释
近期,新型冠状病毒流行,小原一家需要
用体积分数为75%乙醇溶液对物品进行消毒,
但家中只有体积分数为95%的乙醇溶液,他应该怎么办呢?
乙醇溶液
【例题2】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是多少?
【问题】
在稀释的过程中 溶液质量、溶剂质量、溶质质量
哪一个量没变?
溶质的质量不变
活动二 溶液的稀释
[分析]溶液稀释前后,溶质的质量不变。
(浓)溶液质量x(浓)溶质的质量分数=(稀)溶液质量x(稀)溶质的质量分数
【例题2】化学实验室现有质量分数为98%的浓硫酸,但在实验中常需要用较稀的硫酸。要把50g上述浓硫酸稀释为质量分数为20%的稀硫酸,需要水的质量是多少?
稀释前
溶质的质量
稀释后
溶质的质量
x=195g
答:需要水的质量为195g。
=
活动二 溶液的稀释
1. 200C时,NaCl的溶解度是36克。现将20克NaCl放入50克水中,求:所得溶液的溶质质量分数
解:
X = 18g
则: 20克NaCl只有18克溶入水中
×100%
100g
36g
=
50g
x
或
36g
100g+36g
18g
50g+18g
×100%
答:略
≈ 26.5%
溶质在溶液中的质量分数为:
【对应练习】
2: 13克锌与100克稀硫酸恰好完全反应,求:
所得溶液中溶质的质量分数是多少?
解:设稀硫酸中溶质质量为x,生成硫酸锌的质量为y。
Zn + H2SO4 = ZnSO4 + H2↑
65 98 161
13g x y
65 98
13g x
=
65 161
13g y
=
x = 19.6g
y = 32.2g
所得溶液中溶质的质量分数为:
32.2g
32.2g+(100 g-19.6g)
=28.6%
×100%
答:所得溶液中溶质的质量分数为28.6%。
【对应练习】
[实验步骤]
1.(固液法) 配制50g质量分数为6%的氯化钠溶液。
(1)计算:配制50g质量分数为6%的氯化钠溶液所需氯化钠和水的质量分别为:氯化钠 ;水 。
(2)称量:用托盘天平称量所需的氯化钠,放入烧杯中。
(3)量取:用量筒量取所需的水(水的密度可近似看做1 g/cm), 倒入盛有氯化钠的烧杯中。
(4)溶解:用玻璃棒搅拌,使氯化钠完全溶解。
(5)装瓶:
搅拌加速溶解
活动三 配制一定溶质质量分数的溶液
19
2.实验需要哪些仪器?
托盘天平、烧杯、玻璃棒、药匙、量筒、胶头滴管。
思考
1.固液法实验步骤:
3.用托盘天平称量氯化钠时,有哪些注意事项?
(1)计算
(2)称量
(3)量取
(4)溶解
(5)装瓶贴标签
垫称量纸、先码后物、缓慢加入
2.实验需要哪些仪器?
调零、左物右码、
活动三 配制一定溶质质量分数的溶液
21
2.(稀释法)用已配好的质量分数为6%的氧化钠溶液(密度约为1.04 g/cm),配制50g质量分数为3%的氯化钠溶液。
(1)计算:所需质量分数为6%的氯化钠溶液质量____g(体积___ mL);水____g。
(2)量取:用量简量取所需的氯化钠溶液和水,倒入烧杯中。
(3)混匀:用玻璃棒搅拌,使溶液混合均匀。
(4) 装瓶贴标签:把配制好的上述两种氯化钠溶液分别装入细口瓶中,盖好瓶塞并贴上标签(标签中应包括药品名称和溶液中溶质的质量分数),放到试剂柜中。
活动三 配制一定溶质质量分数的溶液
22
2.实验需要哪些仪器?
烧杯、玻璃棒、量筒、胶头滴管。
思考
1.稀释法实验步骤:
(1)计算
(2)量取
(3)溶解
(4)装瓶贴标签
2.实验需要哪些仪器?
3.稀释法配制一定溶质质量分数的溶液,哪些操作会使配制的浓度偏大?
浓溶液多了
溶剂少了
称量时
仰视取浓溶液
俯视取水
活动三 配制一定溶质质量分数的溶液
1. 100g某稀硫酸与13g锌恰好完全起反应。
试计算这种稀硫酸中溶质的质量分数。
x=19.6g
溶质质量分数:
【对应练习】
计算反应后所得溶液中溶质的质量分数时:
关键是求出反应后溶液中溶质的质量和溶液的质量。
①先确定所得的溶液中的溶质是什么,再利用化学方程式求出溶质的质量,有时还要看原固体中所含溶质的质量。
②求反应后所得溶液的质量:
A.溶液组成法:
反应后溶液质量=溶质质量+溶剂质量
B.质量守恒法:
反应后溶液质量=反应前的总质量-生成气体的质量-生成沉淀或杂质的质量
规律总结
典型例题方法小结
100 g某稀硫酸与13 g锌恰好完全起反应。
变式:(2)试计算所得溶液中溶质的质量分数。
典型例题方法小结
23
本课小结
同课章节目录
