2020-2021学年九年级化学鲁教版下册第八单元《海水中的化学》测试题(含答案)
文档属性
| 名称 | 2020-2021学年九年级化学鲁教版下册第八单元《海水中的化学》测试题(含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 135.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-22 21:05:38 | ||
图片预览



文档简介
《海水中的化学》测试题
一、单选题
1.下列对应物质的名称、俗名、化学式中,三者皆指同一种物质的是
A.汞、水银、Ag
B.碳酸钙、熟石灰、
CaCO3
C.氢氧化钠、烧碱、NaOH
D.氯化氢、盐酸
、HCl
2.根据你的经验,下列家庭小实验不能成功的是(
)
A.将黄色的玉米面和白面掺在一起搅拌后观察扩散现象
B.用甘蓝制作指示剂,检验纯碱溶液的酸性
C.某河水经活性炭净化后变成无色无味
D.食盐中掉进了沙子用溶解、过滤、蒸发的方法提纯
3.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.20℃时,100g甲饱和溶液中含甲物质的质量是25g
B.20℃时,等质量甲、乙两种溶液中含溶质的质量相等
C.甲物质的溶解度大于乙物质的溶解度解
D.50℃时,将甲、乙两种物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数一定相等
4.在pH=1的无色溶液中,下列离子能大量共存的组是 ( )
A.NO3-、Cu2+、Na+、SO42-
B.Cl-、K+、OH-、Ba2+
C.K+、SO42-、Na+、NO3-
D.Ca2+、Cl-、CO32-、Na+
5.欲除去物质中的少量杂质(括号内为杂质),所采取的方法和反应的基本反应类型均正确的是( )
选项
物
质
加入的试剂和操作
基本反应类型
A
CuO
(
Cu
)
足量稀盐酸,过滤
分解反应
B
CaO
(
CaCO3
)
高温煅烧
复分解反应
C
Cu(NO3)2溶液(
AgNO3)
足量铜粉,过滤
置换反应
D
CO2(
CO
)
将气体通入到灼热的氧化铜
化合反应
A.A
B.B
C.C
D.D
6.甲是60℃的蔗糖溶液,按如图所示进行操作。下列分析不正确的是
A.丙溶液的溶质质量分数大于丁
B.乙溶液的溶质质量分数大于甲
C.蔗糖的溶解度随温度升高而增大
D.丁溶液一定是室温时蔗糖的饱和溶液
7.食盐、食醋、小苏打等均为家庭厨房中的常见物质,利用这些物质,能做成功的家庭小实验有( )
①鉴别食盐和食醋 ②除去热水瓶中的水垢 ③检验自来水是否有钙离子 ④探究鸡蛋壳中是否含有碳酸盐
A.①②③④
B.①④
C.②③
D.①②④
8.下列生活中常见的物质与其对应的用途描述不相符的是(
)
A.氯化钠是常用的调味品
B.氢氧化钠可作炉具清洁剂
C.碳酸钠用于配制生理盐水
D.碳酸钙可用作补钙剂
9.如图是向一定量澄清石灰水中通入过量二氧化碳的反应过程。[已知:CaCO3+CO2+H2O
=
Ca(HCO3)2]。下列说法不正确的是
A.0点时的溶质是氢氧化钙
B.a点时发生反应的类型为化合反应
C.b点表示Ca(OH)2与CO2恰好完全反应
D.c点时溶质为碳酸氢钙
10.18O是科学实验中常用的一种示踪原子,用仪器可以观测到它在化学变化中的行踪。在某一饱和硫酸铜溶液(不含18O)中,加入ag带标记18O的无水硫酸铜粉末(CuSO4中的氧元素全部为18O),如果保持温度不变,其结果是(
)
A.无水硫酸铜不再溶解,ag带标记18O的无水硫酸铜粉末没有发生改变
B.溶液中可找到带标记18O的SO42-,且白色粉末变为蓝色晶体,其质量大于ag
C.溶液中可找到带标记18O的SO42-,且白色粉末变为蓝色晶体,其质量小于ag
D.有部分带标记18O的SO42-进入溶液中,但固体质量保持不变
11.某溶液中溶质可能是HCl、Na2CO3、H2SO4、CuC12中的一种或多种,为探究溶质的成分,兴趣小组的同学向盛有一定量样品的烧杯中逐滴加入Ba(OH)2稀溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的变化趋势如下图所示。下列有关说法不正确的是
A.原溶液中一定没有Na2CO3和H2SO4
B.b点对应烧杯内溶液中只有一种溶质
C.c点对应烧杯内溶液中的阴离子只有OH-
D.沉淀出现前烧杯内溶液的pH不断增大
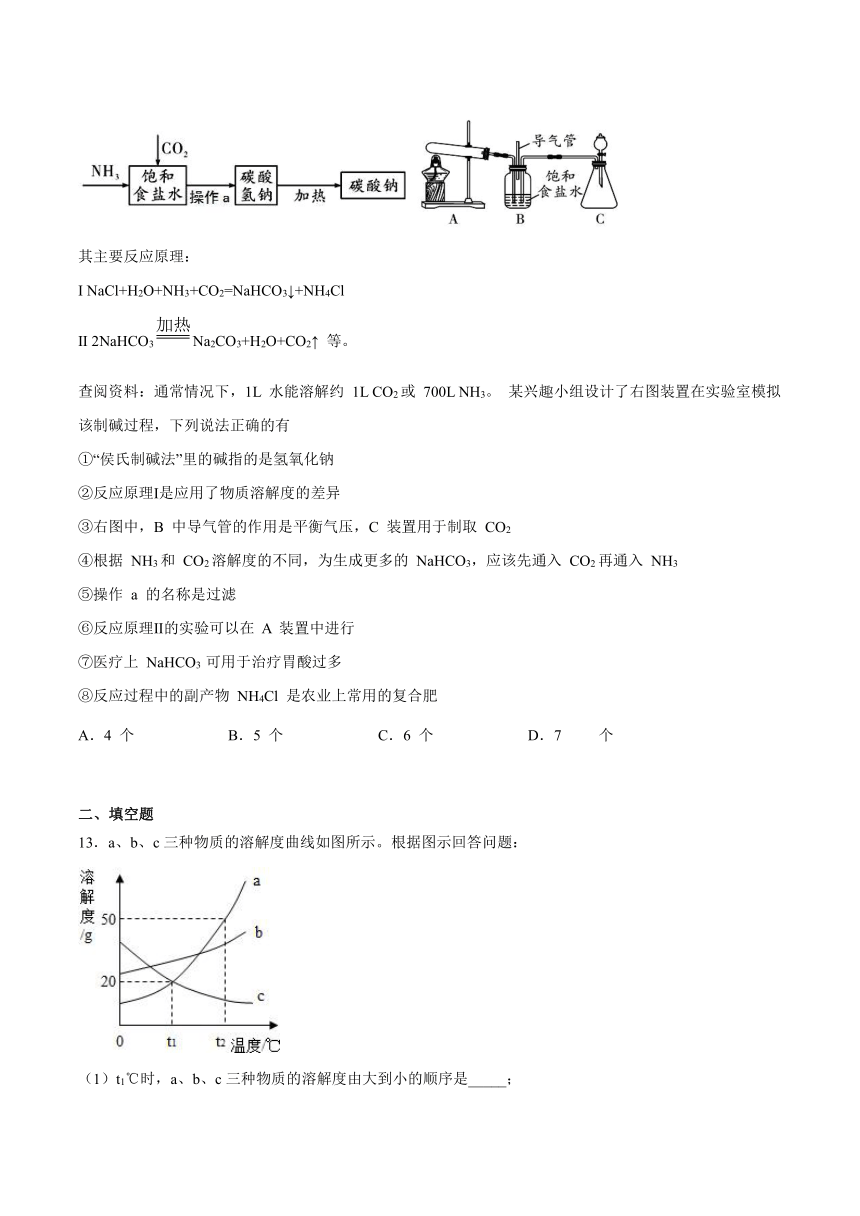
12.我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其部分工艺如下:
其主要反应原理:
Ⅰ
NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl
Ⅱ
2NaHCO3Na2CO3+H2O+CO2↑
等。
查阅资料:通常情况下,1L
水能溶解约
1L
CO2或
700L
NH3。
某兴趣小组设计了右图装置在实验室模拟该制碱过程,下列说法正确的有
①“侯氏制碱法”里的碱指的是氢氧化钠
②反应原理Ⅰ是应用了物质溶解度的差异
③右图中,B
中导气管的作用是平衡气压,C
装置用于制取
CO2
④根据
NH3和
CO2溶解度的不同,为生成更多的
NaHCO3,应该先通入
CO2再通入
NH3
⑤操作
a
的名称是过滤
⑥反应原理Ⅱ的实验可以在
A
装置中进行
⑦医疗上
NaHCO3
可用于治疗胃酸过多
⑧反应过程中的副产物
NH4Cl
是农业上常用的复合肥
A.4
个
B.5
个
C.6
个
D.7
个
二、填空题
13.a、b、c三种物质的溶解度曲线如图所示。根据图示回答问题:
(1)t1℃时,a、b、c三种物质的溶解度由大到小的顺序是_____;
(2)t2℃时,30ga物质加入50g水中,不断搅拌,所得溶液溶质质量分数为_____(结果保留到0.1%);
(3)将相同质量的t2℃时a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是_____;
(4)将t1℃时c的饱和溶液升温到t2℃,变为_____(填“饱和溶液”或“不饱和溶液”)。
14.如表为氯化钠和硝酸钾的溶解度:
10℃
20℃
30℃
40℃
50℃
60℃
70℃
80℃
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
(1)60℃时,KNO3的溶解度为_____;表中“37.8”的意义是
_____。
(2)20℃时KNO3
的溶解度_____(选填“大于”“小
于”)NaCl的溶解度。随着温度升高,NaCl的溶解度
_____(选填“变大”“变小”或“不变”)。
(3)20℃时,完全溶解18
g
NaCl
恰好得到饱和溶液,所需水的质量是
_____g,该溶液质量分数为
_____。
(4)20℃时,向
10
g
KNO3
固体不断加水,有关图像正确的是_____(选填编号)。
三、推断题
15.A、B、C、D、E都是初中化学常见的物质。B、D、E均为氧化物常温下B为固态,D为液态,E为气态;A、B、C中均含有同一种金属元素。它们之间的转化关系如图所示(部分生成物略去)。
写出下列物质的名称:A_____,E_____。
16.客家围屋如同城堡,可以抵御外敌入侵。现有A、B、C、D、E五种物质作为围屋的守护“卫士”,它们分别是由氢、碳、氧、钠、钙中的两种或三种元素组成的化合物。五种物质间建立起如图所示的关系才能组成守护的防线(“→”表示转化关系),其中物质A和B都是氧化物且常用作灭火剂,
C、D物质类别相同,C常用于改良酸性土壤。
(1)物质A的化学式为_____,物质E的俗名为____。
(2)物质C转化成物质D的化学方程式为______,属于____
(填基本反应类型)。
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质只要与两位相邻的守护“卫士”都能发生反应就能攻破防线,那么能攻入围屋的物质是_______(填标号)。
①铁
②稀盐酸
③氧化铁
④二氧化碳
17.一包白色粉末可能含有硫酸铜、碳酸钙、碳酸钠、硫酸钠、氯化钠中的一种或几种,为了确定该混合物的成分,进行如下实验:
步骤一:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。
步骤二:取少量溶液A于试管中,滴加过量氯化钡溶液,有白色沉淀产生;再加入过量稀盐酸沉淀部分溶解而且有气泡产生。
(1)步骤二中写出有气泡产生的化学方程式___
(2)根据上诉实验推断该混合物的成分,一定含有_____,可能含有_____,一定不含___。
四、实验题
18.完成下列基础的学生实验。
Ⅰ.根据下列装置图,回答有关问题。
(1)写出装置图中标号仪器的名称:a___________,b___________。
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式___________,可选用的发生装置是___________(填字母)。
(3)写出实验室用高锰酸钾制取氧气的化学方程式___________,如用E装置来收集氧气,当导管口气泡___________放出时,再把导管口伸入盛满水的集气瓶,开始收集。
Ⅱ.根据“粗盐中难溶性杂质的去除”实验,回答有关问题。
(1)实验步骤:
①溶解 称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.2g。
②过滤
③蒸发 请从溶解度的角度分析,实验中不采用降低溶液温度的方法得到精盐的依据是___________。
④计算产率 得到精盐3.2g,则精盐的产率为___________(计算结果保留一位小数)。
(2)整个实验中至少要进行___________次称量。
(3)从海水中获得的粗盐,经过上述实验得到的精盐属于___________(填“混合物”或“纯净物”)。
19.为除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加过量盐酸;⑤蒸发、结晶。
(1)加入过量Na2CO3溶液的作用_______
(2)过滤后的滤液中含有哪些溶质?____
(3)请设计实验方案证明操作③所得溶液中含有NaOH。(写出实验步骤和现象)_____
五、计算题
20.现将30g氯酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为20.4g。
请计算:
(1)生成氧气的质量。
(2)反应前混合物中氯酸钾的质量分数。
21.为了测定某品牌纯碱(只含氯化钠)中碳酸钠的含量,取该纯碱样品25g,向样品中逐滴加入一定溶质质量分数的氯化钙溶液,充分反应,生成沉淀与加入氯化钙溶液的质量关系如图所示。计算:
(1)反应生成的碳酸钙的质量为_____g。
(2)该纯碱样品中碳酸钠的质量分数。(写出计算过程)
(3)恰好完全反应时,所得溶液质量为_____g。
参考答案
1.C
2.A
3.D
4.C
5.C
6.A
7.D
8.C
9.B
10.B
11.C
12.B
13.b>a=c
33.3%
a
饱和溶液
14.110g
70℃时,在100g水中达到饱和时,可溶解37.8g氯化钠
小于
变大
50
26.5%
ab
15.CaCO3
CO2
16.CO2
纯碱(或苏打)
复分解反应
②④
17.
碳酸钠、硫酸钠
氯化钠
硫酸铜和碳酸钙
18.试管
锥形瓶
B
连续、均匀地
氯化钠的溶解度受温度变化的影响较小
84.2%
3
混合物
19.除去杂质氯化钙和所加入过量的氯化钡
NaCl、NaOH、Na2CO3
取少量过滤后的溶液,加入足量的CaCl2(或BaCl2等)溶液,静置,向上层清液中滴加无色酚酞溶液,溶液变红,则含有氢氧化钠
20.(1)9.6克(2)设反应前混合物中氯酸钾的质量为x,
解得:x=24.5克;
反应前混合物中氯酸钾的质量分数=。
21.(1)20;(2)84.8%;(3)200
一、单选题
1.下列对应物质的名称、俗名、化学式中,三者皆指同一种物质的是
A.汞、水银、Ag
B.碳酸钙、熟石灰、
CaCO3
C.氢氧化钠、烧碱、NaOH
D.氯化氢、盐酸
、HCl
2.根据你的经验,下列家庭小实验不能成功的是(
)
A.将黄色的玉米面和白面掺在一起搅拌后观察扩散现象
B.用甘蓝制作指示剂,检验纯碱溶液的酸性
C.某河水经活性炭净化后变成无色无味
D.食盐中掉进了沙子用溶解、过滤、蒸发的方法提纯
3.如图为甲、乙两物质(均不含结晶水)的溶解度曲线,下列说法正确的是( )
A.20℃时,100g甲饱和溶液中含甲物质的质量是25g
B.20℃时,等质量甲、乙两种溶液中含溶质的质量相等
C.甲物质的溶解度大于乙物质的溶解度解
D.50℃时,将甲、乙两种物质的饱和溶液分别降温至20℃,所得溶液的溶质质量分数一定相等
4.在pH=1的无色溶液中,下列离子能大量共存的组是 ( )
A.NO3-、Cu2+、Na+、SO42-
B.Cl-、K+、OH-、Ba2+
C.K+、SO42-、Na+、NO3-
D.Ca2+、Cl-、CO32-、Na+
5.欲除去物质中的少量杂质(括号内为杂质),所采取的方法和反应的基本反应类型均正确的是( )
选项
物
质
加入的试剂和操作
基本反应类型
A
CuO
(
Cu
)
足量稀盐酸,过滤
分解反应
B
CaO
(
CaCO3
)
高温煅烧
复分解反应
C
Cu(NO3)2溶液(
AgNO3)
足量铜粉,过滤
置换反应
D
CO2(
CO
)
将气体通入到灼热的氧化铜
化合反应
A.A
B.B
C.C
D.D
6.甲是60℃的蔗糖溶液,按如图所示进行操作。下列分析不正确的是
A.丙溶液的溶质质量分数大于丁
B.乙溶液的溶质质量分数大于甲
C.蔗糖的溶解度随温度升高而增大
D.丁溶液一定是室温时蔗糖的饱和溶液
7.食盐、食醋、小苏打等均为家庭厨房中的常见物质,利用这些物质,能做成功的家庭小实验有( )
①鉴别食盐和食醋 ②除去热水瓶中的水垢 ③检验自来水是否有钙离子 ④探究鸡蛋壳中是否含有碳酸盐
A.①②③④
B.①④
C.②③
D.①②④
8.下列生活中常见的物质与其对应的用途描述不相符的是(
)
A.氯化钠是常用的调味品
B.氢氧化钠可作炉具清洁剂
C.碳酸钠用于配制生理盐水
D.碳酸钙可用作补钙剂
9.如图是向一定量澄清石灰水中通入过量二氧化碳的反应过程。[已知:CaCO3+CO2+H2O
=
Ca(HCO3)2]。下列说法不正确的是
A.0点时的溶质是氢氧化钙
B.a点时发生反应的类型为化合反应
C.b点表示Ca(OH)2与CO2恰好完全反应
D.c点时溶质为碳酸氢钙
10.18O是科学实验中常用的一种示踪原子,用仪器可以观测到它在化学变化中的行踪。在某一饱和硫酸铜溶液(不含18O)中,加入ag带标记18O的无水硫酸铜粉末(CuSO4中的氧元素全部为18O),如果保持温度不变,其结果是(
)
A.无水硫酸铜不再溶解,ag带标记18O的无水硫酸铜粉末没有发生改变
B.溶液中可找到带标记18O的SO42-,且白色粉末变为蓝色晶体,其质量大于ag
C.溶液中可找到带标记18O的SO42-,且白色粉末变为蓝色晶体,其质量小于ag
D.有部分带标记18O的SO42-进入溶液中,但固体质量保持不变
11.某溶液中溶质可能是HCl、Na2CO3、H2SO4、CuC12中的一种或多种,为探究溶质的成分,兴趣小组的同学向盛有一定量样品的烧杯中逐滴加入Ba(OH)2稀溶液,产生沉淀的质量与加入Ba(OH)2溶液质量的变化趋势如下图所示。下列有关说法不正确的是
A.原溶液中一定没有Na2CO3和H2SO4
B.b点对应烧杯内溶液中只有一种溶质
C.c点对应烧杯内溶液中的阴离子只有OH-
D.沉淀出现前烧杯内溶液的pH不断增大
12.我国制碱工业先驱侯德榜发明了“侯氏制碱法”,其部分工艺如下:
其主要反应原理:
Ⅰ
NaCl+H2O+NH3+CO2=NaHCO3↓+NH4Cl
Ⅱ
2NaHCO3Na2CO3+H2O+CO2↑
等。
查阅资料:通常情况下,1L
水能溶解约
1L
CO2或
700L
NH3。
某兴趣小组设计了右图装置在实验室模拟该制碱过程,下列说法正确的有
①“侯氏制碱法”里的碱指的是氢氧化钠
②反应原理Ⅰ是应用了物质溶解度的差异
③右图中,B
中导气管的作用是平衡气压,C
装置用于制取
CO2
④根据
NH3和
CO2溶解度的不同,为生成更多的
NaHCO3,应该先通入
CO2再通入
NH3
⑤操作
a
的名称是过滤
⑥反应原理Ⅱ的实验可以在
A
装置中进行
⑦医疗上
NaHCO3
可用于治疗胃酸过多
⑧反应过程中的副产物
NH4Cl
是农业上常用的复合肥
A.4
个
B.5
个
C.6
个
D.7
个
二、填空题
13.a、b、c三种物质的溶解度曲线如图所示。根据图示回答问题:
(1)t1℃时,a、b、c三种物质的溶解度由大到小的顺序是_____;
(2)t2℃时,30ga物质加入50g水中,不断搅拌,所得溶液溶质质量分数为_____(结果保留到0.1%);
(3)将相同质量的t2℃时a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是_____;
(4)将t1℃时c的饱和溶液升温到t2℃,变为_____(填“饱和溶液”或“不饱和溶液”)。
14.如表为氯化钠和硝酸钾的溶解度:
10℃
20℃
30℃
40℃
50℃
60℃
70℃
80℃
NaCl
35.8
36.0
36.3
36.6
37.0
37.3
37.8
38.4
KNO3
20.9
31.6
45.8
63.9
85.5
110
138
169
(1)60℃时,KNO3的溶解度为_____;表中“37.8”的意义是
_____。
(2)20℃时KNO3
的溶解度_____(选填“大于”“小
于”)NaCl的溶解度。随着温度升高,NaCl的溶解度
_____(选填“变大”“变小”或“不变”)。
(3)20℃时,完全溶解18
g
NaCl
恰好得到饱和溶液,所需水的质量是
_____g,该溶液质量分数为
_____。
(4)20℃时,向
10
g
KNO3
固体不断加水,有关图像正确的是_____(选填编号)。
三、推断题
15.A、B、C、D、E都是初中化学常见的物质。B、D、E均为氧化物常温下B为固态,D为液态,E为气态;A、B、C中均含有同一种金属元素。它们之间的转化关系如图所示(部分生成物略去)。
写出下列物质的名称:A_____,E_____。
16.客家围屋如同城堡,可以抵御外敌入侵。现有A、B、C、D、E五种物质作为围屋的守护“卫士”,它们分别是由氢、碳、氧、钠、钙中的两种或三种元素组成的化合物。五种物质间建立起如图所示的关系才能组成守护的防线(“→”表示转化关系),其中物质A和B都是氧化物且常用作灭火剂,
C、D物质类别相同,C常用于改良酸性土壤。
(1)物质A的化学式为_____,物质E的俗名为____。
(2)物质C转化成物质D的化学方程式为______,属于____
(填基本反应类型)。
(3)现有下列物质作为“外敌”分别对围屋发起进攻,若该物质只要与两位相邻的守护“卫士”都能发生反应就能攻破防线,那么能攻入围屋的物质是_______(填标号)。
①铁
②稀盐酸
③氧化铁
④二氧化碳
17.一包白色粉末可能含有硫酸铜、碳酸钙、碳酸钠、硫酸钠、氯化钠中的一种或几种,为了确定该混合物的成分,进行如下实验:
步骤一:取少量固体于烧杯中,加水,搅拌,固体全部溶解,得到无色溶液A。
步骤二:取少量溶液A于试管中,滴加过量氯化钡溶液,有白色沉淀产生;再加入过量稀盐酸沉淀部分溶解而且有气泡产生。
(1)步骤二中写出有气泡产生的化学方程式___
(2)根据上诉实验推断该混合物的成分,一定含有_____,可能含有_____,一定不含___。
四、实验题
18.完成下列基础的学生实验。
Ⅰ.根据下列装置图,回答有关问题。
(1)写出装置图中标号仪器的名称:a___________,b___________。
(2)写出实验室用过氧化氢溶液和二氧化锰制取氧气的化学方程式___________,可选用的发生装置是___________(填字母)。
(3)写出实验室用高锰酸钾制取氧气的化学方程式___________,如用E装置来收集氧气,当导管口气泡___________放出时,再把导管口伸入盛满水的集气瓶,开始收集。
Ⅱ.根据“粗盐中难溶性杂质的去除”实验,回答有关问题。
(1)实验步骤:
①溶解 称取5.0g粗盐,逐渐加入10mL水中,直到不再溶解,剩余粗盐1.2g。
②过滤
③蒸发 请从溶解度的角度分析,实验中不采用降低溶液温度的方法得到精盐的依据是___________。
④计算产率 得到精盐3.2g,则精盐的产率为___________(计算结果保留一位小数)。
(2)整个实验中至少要进行___________次称量。
(3)从海水中获得的粗盐,经过上述实验得到的精盐属于___________(填“混合物”或“纯净物”)。
19.为除去粗盐中CaCl2、MgCl2、Na2SO4等可溶性杂质,需进行如下操作:①溶解;②依次加过量的BaCl2、NaOH、Na2CO3溶液;③过滤;④加过量盐酸;⑤蒸发、结晶。
(1)加入过量Na2CO3溶液的作用_______
(2)过滤后的滤液中含有哪些溶质?____
(3)请设计实验方案证明操作③所得溶液中含有NaOH。(写出实验步骤和现象)_____
五、计算题
20.现将30g氯酸钾与二氧化锰的混合物充分加热,冷却后称得剩余固体的质量为20.4g。
请计算:
(1)生成氧气的质量。
(2)反应前混合物中氯酸钾的质量分数。
21.为了测定某品牌纯碱(只含氯化钠)中碳酸钠的含量,取该纯碱样品25g,向样品中逐滴加入一定溶质质量分数的氯化钙溶液,充分反应,生成沉淀与加入氯化钙溶液的质量关系如图所示。计算:
(1)反应生成的碳酸钙的质量为_____g。
(2)该纯碱样品中碳酸钠的质量分数。(写出计算过程)
(3)恰好完全反应时,所得溶液质量为_____g。
参考答案
1.C
2.A
3.D
4.C
5.C
6.A
7.D
8.C
9.B
10.B
11.C
12.B
13.b>a=c
33.3%
a
饱和溶液
14.110g
70℃时,在100g水中达到饱和时,可溶解37.8g氯化钠
小于
变大
50
26.5%
ab
15.CaCO3
CO2
16.CO2
纯碱(或苏打)
复分解反应
②④
17.
碳酸钠、硫酸钠
氯化钠
硫酸铜和碳酸钙
18.试管
锥形瓶
B
连续、均匀地
氯化钠的溶解度受温度变化的影响较小
84.2%
3
混合物
19.除去杂质氯化钙和所加入过量的氯化钡
NaCl、NaOH、Na2CO3
取少量过滤后的溶液,加入足量的CaCl2(或BaCl2等)溶液,静置,向上层清液中滴加无色酚酞溶液,溶液变红,则含有氢氧化钠
20.(1)9.6克(2)设反应前混合物中氯酸钾的质量为x,
解得:x=24.5克;
反应前混合物中氯酸钾的质量分数=。
21.(1)20;(2)84.8%;(3)200
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
