2020-2021学年苏教版(2019)高一化学必修第二册9.2 探究铁及其化合物的转化 课件 (27张PPT)
文档属性
| 名称 | 2020-2021学年苏教版(2019)高一化学必修第二册9.2 探究铁及其化合物的转化 课件 (27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 26.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-23 15:52:10 | ||
图片预览







文档简介
第二单元
探究铁及其化合物的转化
专题九 从矿物到基础材料
—探究铁及其化合物的转化
铁单质陨铁
主要化合态、少量是游离态
化合态——
磁铁矿(Fe3O4)
赤铁矿(Fe2O3)
1.铁的存在
游离态——
陨铁(天石,地壳中无单质铁)
铁是银白色有金属光泽的金属,质软,熔沸点高,具有良好的导电、导热、延展性,可被磁铁吸引,也可被磁化,铁粉呈黑色
2.物理性质
磁铁矿(Fe3O4)
赤铁矿(Fe2O3)
一、铁
3.化学性质
(1)与非金属单质反应
+3
+2
3Fe+2O2 Fe3O4
点燃
较活泼,易失电子,常显+2和+3价
现象:剧烈燃烧火星四射,生成黑色固体
(集气瓶底部放细沙或少量水,防止炸裂)
现象:剧烈燃烧,产生棕褐色的烟
得出结论:氧化性Cl2>S
2Fe+3Cl2 2FeCl3
点燃
Fe+S FeS
典型的变价金属
(2)与水蒸汽的反应
铁的还原性比钠、镁、铝弱
3Fe+4H2O(g) Fe3O4 + 4H2↑
高温
(3)与酸的反应
①与非强氧化性酸反应(如盐酸、稀硫酸等)
Fe+2H+ Fe2++H2↑
Fe+2HCl FeCl2+H2↑
Fe+H2SO4 FeSO4+H2↑
思考:比较钠、镁、铝分别与水反应的条件、现象
Fe+4HNO3(稀) Fe(NO3)3+NO↑+2H2O
3Fe+8H+ + 2NO3- 3Fe2++2NO↑+4H2O
②与强氧化性酸反应
常温下,铁遇到冷的浓硫酸或浓硝酸发生钝化,加热后反应继续进行,反应不会产生氢气。
HNO3过量:
Fe过量:
Fe + 4H+ +NO3- Fe3+ +NO↑+2H2O
3Fe+8HNO3(稀) 3Fe(NO3)2+2NO↑+4H2O
(如浓硫酸、浓硝酸、稀硝酸)
(4)与盐溶液的反应
铁可以将活泼性排在其后面的金属从其盐溶液中置换出来。
Fe + Cu2+ Fe2++Cu
铁还可以与Fe3+发生归中反应生成Fe2+
2Fe3+ + Fe 3Fe2+
2FeCl3 + Fe 3FeCl2
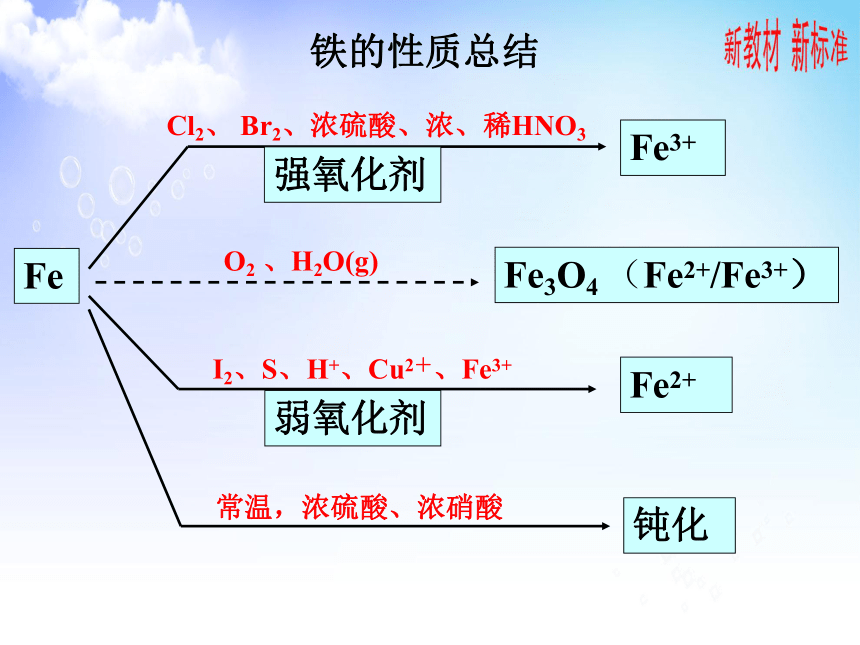
Fe
Fe2+
Fe3+
Fe3O4 (Fe2+/Fe3+)
Cl2、 Br2、浓硫酸、浓、稀HNO3
O2 、H2O(g)
I2、S、H+、Cu2+、Fe3+
强氧化剂
弱氧化剂
常温,浓硫酸、浓硝酸
钝化
铁的性质总结
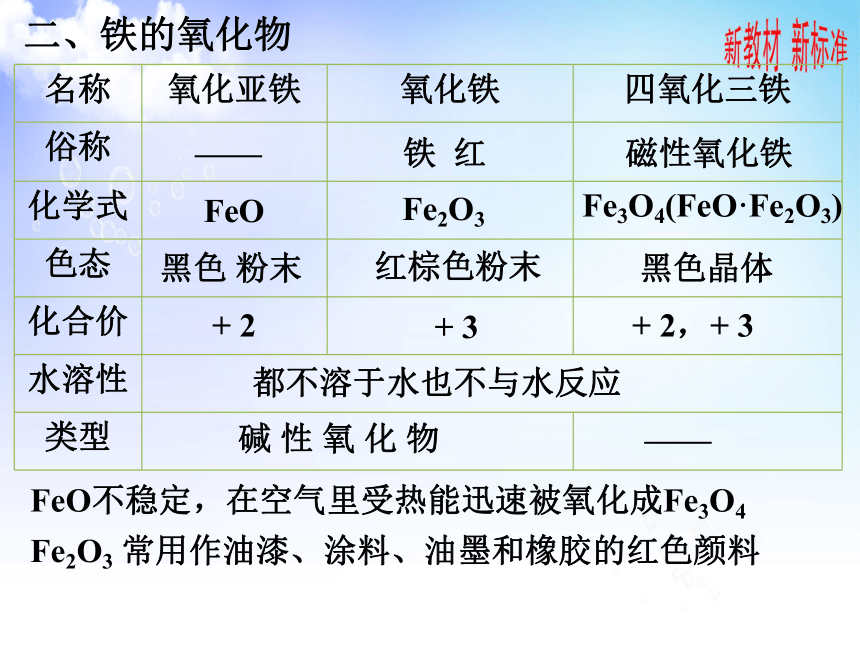
{0505E3EF-67EA-436B-97B2-0124C06EBD24}名称
氧化亚铁
氧化铁
四氧化三铁
俗称
化学式
色态
化合价
水溶性
类型
铁 红
磁性氧化铁
Fe3O4(FeO·Fe2O3)
Fe2O3
FeO
黑色 粉末
红棕色粉末
黑色晶体
+ 2,+ 3
都不溶于水也不与水反应
碱 性 氧 化 物
+ 2
+ 3
二、铁的氧化物
——
FeO不稳定,在空气里受热能迅速被氧化成Fe3O4
Fe2O3 常用作油漆、涂料、油墨和橡胶的红色颜料
——
化学性质
1.与酸反应
FeO
3FeO+10HNO3(稀) 3Fe(NO3)3+NO↑+5H2O
+3
+2
3FeO+10H+ + NO3- 3Fe3+ + NO↑+ 5H2O
FeO + 2HCl FeCl2+ H2O
Fe2O3
+3
Fe2O3 + 6HCl 2FeCl3+ 3H2O
Fe2O3 + 6H+ 2Fe3+ + 3H2O
Fe3O4(FeO·Fe2O3)
Fe3O4 + 8HCl 2FeCl3+ FeCl2 + 4H2O
Fe3O4 + 8H+ 2Fe3+ + Fe2+ + 4H2O
FeO和Fe2O3是碱性氧化物,Fe3O4不是
2.与还原剂反应
Fe2O3+3CO 2Fe+3CO2
高温
Fe3O4+4CO 3Fe+4CO2
高温
三、铁的氢氧化物
Fe(OH)2
不溶于水的白色固体
Fe(OH)3
不溶于水的红褐色固体
1.物理性质
2.化学性质
(1)与非氧化性酸反应
Fe(OH)2+2H+ Fe2++2H2O
Fe(OH)3+3H+ Fe3++3H2O
(2)稳定性
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
2Fe(OH)3 Fe2O3+3H2O
△
(3)Fe(OH)2和Fe(OH)3制备
原理:
② Fe2+ + 2OH- Fe(OH)2↓
① Fe3+ + 3OH- Fe(OH)3↓
现象:生成成红褐色沉淀
现象:先产生白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
(4)Fe(OH)2制备条件的控制
成功关键:
①所用溶液中不含氧气等氧化性物质;
②在反应过程中要采取措施,保证生成的Fe(OH)2在密闭的、隔绝空气的体系中,防止其被氧化,这样可长时间观察到白色的沉淀;
具体方法:
①FeSO4溶液要现用现配,常在溶液中加入铁粉、铁屑或铁钉,防止FeSO4被氧化变质;
②配制溶液用的蒸馏水和NaOH溶液要煮沸,除去溶解氧;
Fe2+极易被氧化
③为防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管深入FeSO4溶液液面以下,再挤出;
④向盛有FeSO4溶液的试管中加入密度比水小不与水互溶的液态有机物,以隔绝空气,如煤油、苯、汽油,不能加CCl4;
唯一深入液面下
④将反应体系置于还原性气体氛围中。
a.先在装置Ⅰ中产生FeSO4溶液;
b.利用产生的H2排尽整个装置中的空气;
c.待检验H2的纯度后,再关闭止水夹K;
d.利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液反应。
步骤:取烧杯盛 25 mL 蒸馏水,加热至沸腾,向其中逐滴加入 5~6 滴饱和FeCl3 溶液, 继续煮沸至液体呈红褐色,观察所得红褐色液体即是Fe(OH)3 胶体。
△
FeCl3+3H2O==Fe(OH)3(胶体)+3HCl
(4)Fe(OH)3胶体的制备
四、铁盐和亚铁盐
1.亚铁盐(Fe2+)
非常浅的浅绿色
Fe2+处于中间价态,既有氧化性又有还原性,主要显示还原性,能被O2、Cl2、H2O2、Br2、HNO3、KMnO4(H+)等强氧化剂氧化为Fe3+
Fe2+ + Zn Fe + Zn2+
氧化性
还原性
2Fe2+ + Cl2 2Fe3+ + 2Cl-
4Fe2+ + O2 + 4H+ 4Fe3+ + 2H2O
2Fe2+ + H2O2 + 2H+ 2Fe3+ + 2H2O
3Fe2+ + NO3- + 4H+ 3Fe3+ + NO↑ + 2H2O
5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O
氯水溴水褪色
还原产物为水
紫红色褪去
注意:
①Fe2+与强氧化性离子因发生氧化还原反应在溶液中不共存
②还可用铁氰化钾溶液{六氰合铁酸钾K3[Fe(CN)6]}检验离子Fe2+,若产生蓝色沉淀,说明含有Fe2+
2.铁盐(Fe3+)
棕黄色
Fe3+处于最高价态,只有氧化性,在溶液中能被Fe、Cu、I-、S2-、SO2等还原
Fe + 2FeCl3 3FeCl2
Fe + 2Fe3+ 3Fe2+
2Fe3+ + Cu 2Fe2+ + Cu2+
制作印刷电路板
2Fe3+ + 2I- 2Fe2+ + I2
能使淀粉-KI试纸变蓝
2Fe3+ +S2- 2Fe2+ + S↓
2Fe3+ + SO2 + 2H2O 2Fe2+ + SO42- + 4H+
特性:
Fe3+ + 3SCN- Fe(SCN)3
配制亚铁盐溶液加入铁粉、铁屑或铁钉防止氧化
在含有Fe3+的溶液中滴加KSCN溶液,反应混合液立刻显示血红色,而Fe2+遇KSCN溶液不显血红色,这种方法常用于检验溶液中是否存在Fe3+
血红色,不电离,不沉淀
Cu + 2FeCl3 2FeCl2 + CuCl2
3.检验Fe3+和Fe2+
(1)观察法
Fe2+:浅绿色
Fe3+:棕黄色
(2)加碱法(NaOH)
Fe2+:
先产生白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe3+:
直接产生红褐色沉淀
(3)加KSCN溶液法
Fe2+:
Fe3+:
加入KSCN溶液直接出现血红色
2Fe2+ + Cl2 2Fe3+ + 2Cl-
Fe3+ + 3SCN- Fe(SCN)3
Fe2+ + 2OH- Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
加入KSCN溶液无明显变化,再滴入新制氯水出现血红色
可先加KSCN溶液,无明显现象,再加入新制氯水或H2O2溶液,出现血红色,不能加酸性高锰酸钾溶液,对Fe(SCN)3 血红色有干扰;
常见的检验情况
①证明溶液中无Fe3+而有Fe2+
②证明溶液中既有Fe3+又有Fe2+
分别检验两种离子,可先取溶液加KSCN溶液,出现血红色证明有Fe3+;再重新取原溶液,加入酸性高锰酸钾溶液,紫红色褪色说明有Fe2+
Fe
2+
Fe
3+
弱还原剂
强氧化剂
Fe
弱氧化剂
强氧化剂
强还原剂
强还原剂
4.Fe、Fe2+和Fe3+相互转化
五、应用
1.氧化铁作为颜料,常被用作防锈漆;
2.铁盐被用作净水剂;
3.四氧化三铁被用作磁性材料;
4.铁元素是人体不可缺少的微量元素。
1.家庭养殖花草时,有时会施用绿矾(FeSO4·7H2O)来提供营养。
(1)你认为它应该如何保存?
(2)现由于保管不善和放置时间过长,怀疑它已经变质,试设计实验验证之。
(3)如果已经变质,为了不影响使用效果,你认为应采用何种措施?
2.为除去废水中Fe2+,常将废水中的Fe2+氧化成Fe3+,再调pH使Fe3+转化成Fe(OH)3析出。写出通入氯气使亚铁离子氧化为铁离子的离子方程式:
2Fe2+ + Cl2=2Fe3+ + 2Cl-
已知:Fe3+在pH大于1.9开始沉淀,大于等于3.7沉淀完全
Fe2+在pH大于5.85开始沉淀,大于等于8.35沉淀完全
3.下列离子方程式正确的为: ( )
A、铁和氯化铁溶液反应:Fe + Fe3+ == 2Fe2+
B、三氯化铁和硫氰化钾溶液反应:
Fe3+ + 3SCN-== Fe(SCN)3
C、铜投入氯化铁溶液:Cu + Fe3+ == Fe2+ + Cu2+
D、氯化亚铁溶液可与双氧水反应:
2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O
D
4.将铁片投入到下列溶液中,不放出气体并且使
铁片质量减轻的是 ( )
A. CuSO4溶液 B. H2SO4溶液
AgNO3溶液 D. FeCl3溶液
D
5.除去下列物质中混有的少量杂质应用怎样化学方法,写出有关反应的离子方程式。
(1)铜粉中混有铁粉:
、 。
(2)铁粉中混有铝粉:
、 。
(3)FeCl3溶液中混有FeCl2 :
、 。
(4)FeCl2溶液中混有CuCl2或FeCl3
、 。
Fe+2H+=Fe 2++H2↑
加入过量NaOH
2Fe2++Cl2=2Fe3++2Cl-
Cu2++Fe=Fe2++Cu
加入过量盐酸
2Al+2OH-+2H2O=2AlO2-+3H2↑
通入Cl2
加入过量Fe
1.铜的存在:
主要化合态、少量是游离态
孔雀石(Cu2(OH)2 CO3 )
黄铜矿(CuFeS2 )
孔雀石(CuCO3 .Cu(OH)2)
化合态——
游离态——
天然单质铜(地壳中存在)
黄铜矿(CuFeS2 )
有金属光泽的紫红色金属,密度为8.92g/cm3,属于重金属(密度大于4.5g/cm3),熔沸点高,具有良好的导电、导热、延展性
2.物理性质
六、铜的性质及用途
3.化学性质
(1)与非金属单质反应
2Cu+O2==2CuO
红色固体变黑色,可用于除去气体中的氧气
Cu+Cl2== CuCl2
点燃
剧烈燃烧,产生棕黄色的烟
①与非强氧化性酸一般不反应,不能置换出氢气
②与强氧化性酸反应:
(浓H2SO4、浓、稀HNO3)
Cu+4HNO3(浓) == Cu (NO3) 2+2NO2↑+2H2O
3Cu+8HNO3(稀) == 3Cu (NO3) 2+2NO↑+4H2O
(2)与酸反应
△
Cu + 2H2SO4(浓) == CuSO4 + SO2↑ + 2H2O
2Cu+S == Cu2S
3Cu+8H+ + 2NO3- == 3Cu2++2NO↑+4H2O
(3)与盐反应:
Cu + 2Fe3+= Cu2+ + 2Fe2+
(4)铜的锈蚀:
Cu + O2+H2O+CO2== Cu2(OH)2CO3
铜在干燥的空气中性质稳定,在潮湿的空气中易被锈蚀
4.用途
(1)铜单质及合金用于电线电缆或电器元件
(2)铜盐做杀菌剂消毒剂
探究铁及其化合物的转化
专题九 从矿物到基础材料
—探究铁及其化合物的转化
铁单质陨铁
主要化合态、少量是游离态
化合态——
磁铁矿(Fe3O4)
赤铁矿(Fe2O3)
1.铁的存在
游离态——
陨铁(天石,地壳中无单质铁)
铁是银白色有金属光泽的金属,质软,熔沸点高,具有良好的导电、导热、延展性,可被磁铁吸引,也可被磁化,铁粉呈黑色
2.物理性质
磁铁矿(Fe3O4)
赤铁矿(Fe2O3)
一、铁
3.化学性质
(1)与非金属单质反应
+3
+2
3Fe+2O2 Fe3O4
点燃
较活泼,易失电子,常显+2和+3价
现象:剧烈燃烧火星四射,生成黑色固体
(集气瓶底部放细沙或少量水,防止炸裂)
现象:剧烈燃烧,产生棕褐色的烟
得出结论:氧化性Cl2>S
2Fe+3Cl2 2FeCl3
点燃
Fe+S FeS
典型的变价金属
(2)与水蒸汽的反应
铁的还原性比钠、镁、铝弱
3Fe+4H2O(g) Fe3O4 + 4H2↑
高温
(3)与酸的反应
①与非强氧化性酸反应(如盐酸、稀硫酸等)
Fe+2H+ Fe2++H2↑
Fe+2HCl FeCl2+H2↑
Fe+H2SO4 FeSO4+H2↑
思考:比较钠、镁、铝分别与水反应的条件、现象
Fe+4HNO3(稀) Fe(NO3)3+NO↑+2H2O
3Fe+8H+ + 2NO3- 3Fe2++2NO↑+4H2O
②与强氧化性酸反应
常温下,铁遇到冷的浓硫酸或浓硝酸发生钝化,加热后反应继续进行,反应不会产生氢气。
HNO3过量:
Fe过量:
Fe + 4H+ +NO3- Fe3+ +NO↑+2H2O
3Fe+8HNO3(稀) 3Fe(NO3)2+2NO↑+4H2O
(如浓硫酸、浓硝酸、稀硝酸)
(4)与盐溶液的反应
铁可以将活泼性排在其后面的金属从其盐溶液中置换出来。
Fe + Cu2+ Fe2++Cu
铁还可以与Fe3+发生归中反应生成Fe2+
2Fe3+ + Fe 3Fe2+
2FeCl3 + Fe 3FeCl2
Fe
Fe2+
Fe3+
Fe3O4 (Fe2+/Fe3+)
Cl2、 Br2、浓硫酸、浓、稀HNO3
O2 、H2O(g)
I2、S、H+、Cu2+、Fe3+
强氧化剂
弱氧化剂
常温,浓硫酸、浓硝酸
钝化
铁的性质总结
{0505E3EF-67EA-436B-97B2-0124C06EBD24}名称
氧化亚铁
氧化铁
四氧化三铁
俗称
化学式
色态
化合价
水溶性
类型
铁 红
磁性氧化铁
Fe3O4(FeO·Fe2O3)
Fe2O3
FeO
黑色 粉末
红棕色粉末
黑色晶体
+ 2,+ 3
都不溶于水也不与水反应
碱 性 氧 化 物
+ 2
+ 3
二、铁的氧化物
——
FeO不稳定,在空气里受热能迅速被氧化成Fe3O4
Fe2O3 常用作油漆、涂料、油墨和橡胶的红色颜料
——
化学性质
1.与酸反应
FeO
3FeO+10HNO3(稀) 3Fe(NO3)3+NO↑+5H2O
+3
+2
3FeO+10H+ + NO3- 3Fe3+ + NO↑+ 5H2O
FeO + 2HCl FeCl2+ H2O
Fe2O3
+3
Fe2O3 + 6HCl 2FeCl3+ 3H2O
Fe2O3 + 6H+ 2Fe3+ + 3H2O
Fe3O4(FeO·Fe2O3)
Fe3O4 + 8HCl 2FeCl3+ FeCl2 + 4H2O
Fe3O4 + 8H+ 2Fe3+ + Fe2+ + 4H2O
FeO和Fe2O3是碱性氧化物,Fe3O4不是
2.与还原剂反应
Fe2O3+3CO 2Fe+3CO2
高温
Fe3O4+4CO 3Fe+4CO2
高温
三、铁的氢氧化物
Fe(OH)2
不溶于水的白色固体
Fe(OH)3
不溶于水的红褐色固体
1.物理性质
2.化学性质
(1)与非氧化性酸反应
Fe(OH)2+2H+ Fe2++2H2O
Fe(OH)3+3H+ Fe3++3H2O
(2)稳定性
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
2Fe(OH)3 Fe2O3+3H2O
△
(3)Fe(OH)2和Fe(OH)3制备
原理:
② Fe2+ + 2OH- Fe(OH)2↓
① Fe3+ + 3OH- Fe(OH)3↓
现象:生成成红褐色沉淀
现象:先产生白色沉淀,在空气中迅速变成灰绿色,最后变成红褐色
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
(4)Fe(OH)2制备条件的控制
成功关键:
①所用溶液中不含氧气等氧化性物质;
②在反应过程中要采取措施,保证生成的Fe(OH)2在密闭的、隔绝空气的体系中,防止其被氧化,这样可长时间观察到白色的沉淀;
具体方法:
①FeSO4溶液要现用现配,常在溶液中加入铁粉、铁屑或铁钉,防止FeSO4被氧化变质;
②配制溶液用的蒸馏水和NaOH溶液要煮沸,除去溶解氧;
Fe2+极易被氧化
③为防止滴加NaOH溶液时带入空气,可将吸有NaOH溶液的长滴管深入FeSO4溶液液面以下,再挤出;
④向盛有FeSO4溶液的试管中加入密度比水小不与水互溶的液态有机物,以隔绝空气,如煤油、苯、汽油,不能加CCl4;
唯一深入液面下
④将反应体系置于还原性气体氛围中。
a.先在装置Ⅰ中产生FeSO4溶液;
b.利用产生的H2排尽整个装置中的空气;
c.待检验H2的纯度后,再关闭止水夹K;
d.利用产生的H2把FeSO4溶液压入装置Ⅱ中与NaOH溶液反应。
步骤:取烧杯盛 25 mL 蒸馏水,加热至沸腾,向其中逐滴加入 5~6 滴饱和FeCl3 溶液, 继续煮沸至液体呈红褐色,观察所得红褐色液体即是Fe(OH)3 胶体。
△
FeCl3+3H2O==Fe(OH)3(胶体)+3HCl
(4)Fe(OH)3胶体的制备
四、铁盐和亚铁盐
1.亚铁盐(Fe2+)
非常浅的浅绿色
Fe2+处于中间价态,既有氧化性又有还原性,主要显示还原性,能被O2、Cl2、H2O2、Br2、HNO3、KMnO4(H+)等强氧化剂氧化为Fe3+
Fe2+ + Zn Fe + Zn2+
氧化性
还原性
2Fe2+ + Cl2 2Fe3+ + 2Cl-
4Fe2+ + O2 + 4H+ 4Fe3+ + 2H2O
2Fe2+ + H2O2 + 2H+ 2Fe3+ + 2H2O
3Fe2+ + NO3- + 4H+ 3Fe3+ + NO↑ + 2H2O
5Fe2+ + MnO4- + 8H+ 5Fe3+ + Mn2+ + 4H2O
氯水溴水褪色
还原产物为水
紫红色褪去
注意:
①Fe2+与强氧化性离子因发生氧化还原反应在溶液中不共存
②还可用铁氰化钾溶液{六氰合铁酸钾K3[Fe(CN)6]}检验离子Fe2+,若产生蓝色沉淀,说明含有Fe2+
2.铁盐(Fe3+)
棕黄色
Fe3+处于最高价态,只有氧化性,在溶液中能被Fe、Cu、I-、S2-、SO2等还原
Fe + 2FeCl3 3FeCl2
Fe + 2Fe3+ 3Fe2+
2Fe3+ + Cu 2Fe2+ + Cu2+
制作印刷电路板
2Fe3+ + 2I- 2Fe2+ + I2
能使淀粉-KI试纸变蓝
2Fe3+ +S2- 2Fe2+ + S↓
2Fe3+ + SO2 + 2H2O 2Fe2+ + SO42- + 4H+
特性:
Fe3+ + 3SCN- Fe(SCN)3
配制亚铁盐溶液加入铁粉、铁屑或铁钉防止氧化
在含有Fe3+的溶液中滴加KSCN溶液,反应混合液立刻显示血红色,而Fe2+遇KSCN溶液不显血红色,这种方法常用于检验溶液中是否存在Fe3+
血红色,不电离,不沉淀
Cu + 2FeCl3 2FeCl2 + CuCl2
3.检验Fe3+和Fe2+
(1)观察法
Fe2+:浅绿色
Fe3+:棕黄色
(2)加碱法(NaOH)
Fe2+:
先产生白色沉淀,迅速变成灰绿色,最后变成红褐色
Fe3+:
直接产生红褐色沉淀
(3)加KSCN溶液法
Fe2+:
Fe3+:
加入KSCN溶液直接出现血红色
2Fe2+ + Cl2 2Fe3+ + 2Cl-
Fe3+ + 3SCN- Fe(SCN)3
Fe2+ + 2OH- Fe(OH)2↓
4Fe(OH)2 + 2H2O + O2 4Fe(OH)3
加入KSCN溶液无明显变化,再滴入新制氯水出现血红色
可先加KSCN溶液,无明显现象,再加入新制氯水或H2O2溶液,出现血红色,不能加酸性高锰酸钾溶液,对Fe(SCN)3 血红色有干扰;
常见的检验情况
①证明溶液中无Fe3+而有Fe2+
②证明溶液中既有Fe3+又有Fe2+
分别检验两种离子,可先取溶液加KSCN溶液,出现血红色证明有Fe3+;再重新取原溶液,加入酸性高锰酸钾溶液,紫红色褪色说明有Fe2+
Fe
2+
Fe
3+
弱还原剂
强氧化剂
Fe
弱氧化剂
强氧化剂
强还原剂
强还原剂
4.Fe、Fe2+和Fe3+相互转化
五、应用
1.氧化铁作为颜料,常被用作防锈漆;
2.铁盐被用作净水剂;
3.四氧化三铁被用作磁性材料;
4.铁元素是人体不可缺少的微量元素。
1.家庭养殖花草时,有时会施用绿矾(FeSO4·7H2O)来提供营养。
(1)你认为它应该如何保存?
(2)现由于保管不善和放置时间过长,怀疑它已经变质,试设计实验验证之。
(3)如果已经变质,为了不影响使用效果,你认为应采用何种措施?
2.为除去废水中Fe2+,常将废水中的Fe2+氧化成Fe3+,再调pH使Fe3+转化成Fe(OH)3析出。写出通入氯气使亚铁离子氧化为铁离子的离子方程式:
2Fe2+ + Cl2=2Fe3+ + 2Cl-
已知:Fe3+在pH大于1.9开始沉淀,大于等于3.7沉淀完全
Fe2+在pH大于5.85开始沉淀,大于等于8.35沉淀完全
3.下列离子方程式正确的为: ( )
A、铁和氯化铁溶液反应:Fe + Fe3+ == 2Fe2+
B、三氯化铁和硫氰化钾溶液反应:
Fe3+ + 3SCN-== Fe(SCN)3
C、铜投入氯化铁溶液:Cu + Fe3+ == Fe2+ + Cu2+
D、氯化亚铁溶液可与双氧水反应:
2Fe2+ + H2O2 + 2H+ == 2Fe3+ + 2H2O
D
4.将铁片投入到下列溶液中,不放出气体并且使
铁片质量减轻的是 ( )
A. CuSO4溶液 B. H2SO4溶液
AgNO3溶液 D. FeCl3溶液
D
5.除去下列物质中混有的少量杂质应用怎样化学方法,写出有关反应的离子方程式。
(1)铜粉中混有铁粉:
、 。
(2)铁粉中混有铝粉:
、 。
(3)FeCl3溶液中混有FeCl2 :
、 。
(4)FeCl2溶液中混有CuCl2或FeCl3
、 。
Fe+2H+=Fe 2++H2↑
加入过量NaOH
2Fe2++Cl2=2Fe3++2Cl-
Cu2++Fe=Fe2++Cu
加入过量盐酸
2Al+2OH-+2H2O=2AlO2-+3H2↑
通入Cl2
加入过量Fe
1.铜的存在:
主要化合态、少量是游离态
孔雀石(Cu2(OH)2 CO3 )
黄铜矿(CuFeS2 )
孔雀石(CuCO3 .Cu(OH)2)
化合态——
游离态——
天然单质铜(地壳中存在)
黄铜矿(CuFeS2 )
有金属光泽的紫红色金属,密度为8.92g/cm3,属于重金属(密度大于4.5g/cm3),熔沸点高,具有良好的导电、导热、延展性
2.物理性质
六、铜的性质及用途
3.化学性质
(1)与非金属单质反应
2Cu+O2==2CuO
红色固体变黑色,可用于除去气体中的氧气
Cu+Cl2== CuCl2
点燃
剧烈燃烧,产生棕黄色的烟
①与非强氧化性酸一般不反应,不能置换出氢气
②与强氧化性酸反应:
(浓H2SO4、浓、稀HNO3)
Cu+4HNO3(浓) == Cu (NO3) 2+2NO2↑+2H2O
3Cu+8HNO3(稀) == 3Cu (NO3) 2+2NO↑+4H2O
(2)与酸反应
△
Cu + 2H2SO4(浓) == CuSO4 + SO2↑ + 2H2O
2Cu+S == Cu2S
3Cu+8H+ + 2NO3- == 3Cu2++2NO↑+4H2O
(3)与盐反应:
Cu + 2Fe3+= Cu2+ + 2Fe2+
(4)铜的锈蚀:
Cu + O2+H2O+CO2== Cu2(OH)2CO3
铜在干燥的空气中性质稳定,在潮湿的空气中易被锈蚀
4.用途
(1)铜单质及合金用于电线电缆或电器元件
(2)铜盐做杀菌剂消毒剂
