华东师大版九年级科学下册 第3章 物质的转化和元素的循环 单元测试题(含解析)
文档属性
| 名称 | 华东师大版九年级科学下册 第3章 物质的转化和元素的循环 单元测试题(含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 757.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 华东师大版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2021-06-23 18:03:19 | ||
图片预览



文档简介
第3章 物质的转化和元素的循环
一、选择题(每题3分,共45分)
1.氮肥能促进植物的枝叶繁茂,叶色浓绿。下列属于氮肥的是( )
A.KH2PO4 B.K2SO4 C.NH4NO3 D.Ca3(PO4)2
2.碳的耗用量称为“碳足迹”。一般情况下,排放的二氧化碳越多,碳足迹就越大。碳足迹的计算包括一切用于电力、建设、运输等方面的能源以及我们所使用的消耗品。以下做法可以减小碳足迹的是( )
A.减少一次性筷子的使用 B.大量使用煤、石油等燃料
C.将生活垃圾进行焚烧处理 D.以私家车代替公共交通工具出行
图1
图2
3.图2是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是( )
A.图Ⅰ中的转化1是酸雨形成的主要原因
B.图Ⅱ中可实现有机物与无机物的相互转化
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
4.下列有关生产、环保、资源问题的叙述,错误的是( )
A.长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用
B.“温室效应”主要是由二氧化碳等气体引起的
C.pH<5.6的酸性降水称为酸雨,它的形成与大气中SO2等酸性污染物增多有关
D.高炉炼铁中所需的高温和一氧化碳的生成都与焦炭有关
5.[2019·宁波] 科学家研究发现,某地区重霾污染期间,颗粒物中硫酸盐含量迅速升高。硫酸盐形成的过程中,有一步化学反应的微观示意图如图3所示。下列说法错误的是( )
图3
A.该反应是置换反应 B.甲是氧化物
C.乙是一种大气污染物 D.丙遇到空气中的水会生成硫酸
6.A~E是初中科学常见的物质,其中A是相对分子质量为16的有机物,A在空气中不完全燃烧生成B、C、D,常温下C和D是组成元素相同的气体,其中C可用于灭火,E在空气中的含量居第二位。它们之间的相互转化关系如图4所示。下列叙述错误的是( )
图4
A.A是CH4
B.E→B、E→C只能通过化合反应实现
C.E是由地壳中含量最多的元素组成的单质
D.C→D反应的化学方程式可为CO2+C2CO
7.下表中“—”表示相连的物质间能发生反应,“→”表示一种物质经一步反应可转化为另一种物质。则甲、乙、丙、丁四种物质不符合对应转化关系的是( )
选项
A
B
C
D
转化
关系
物
质
甲
Ca(OH)2
C
Fe
Na2CO3
乙
HCl
O2
HCl
Ca(OH)2
丙
Na2CO3
Fe2O3
CO2
BaCl2
丁
Ba(OH)2
CO
NaOH
H2SO4
8.工业上用氨气(NH3)制取硝酸(HNO3),工业流程为①4NH3+5O24NO+6H2O;②2NO+O22NO2;③3NO2+H2O2HNO3+NO。下列判断不正确的是( )
A.反应①中使用的催化剂需要经常更换
B.在每一步反应中氮元素的化合价都发生了改变
C.制取硝酸过程中产生的一氧化氮可循环使用
D.为实现原子利用率为100%,可在②③中控制一氧化氮、氧气和水的分子个数比为4∶3∶2
9.[2020·包头] 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如图5所示(反应条件已略去)。已知:2Cu+2H2SO4+O22CuSO4+2H2O。
图5
下列说法正确的是( )
A.步骤②中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
10.下列物质的转化在给定条件下均能实现的是( )
A.Ca(OH)2溶液Ca(NO3)2溶液CaCO3
B.KMnO4O2Cu2(OH)2CO3
C.K2SO4BaSO4Ba(NO3)2
D.Na2CO3Na2SO4NaCl
11.以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)如图6所示,下列说法不正确的是( )
图6
A.X是N2 B.分离空气属于物理变化
C.尿素属于氮肥 D.煤与氧气的反应吸收热量
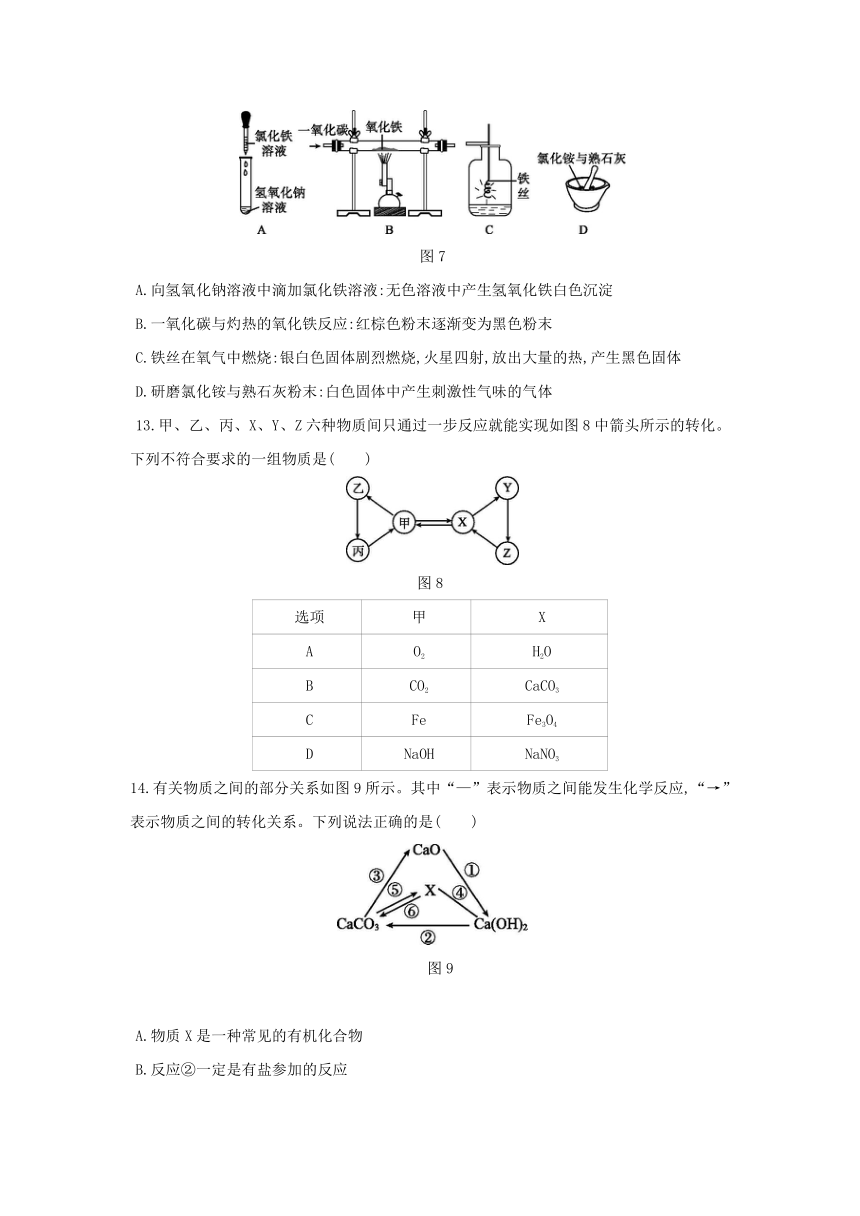
12.下列实验现象描述错误的是( )
图7
A.向氢氧化钠溶液中滴加氯化铁溶液:无色溶液中产生氢氧化铁白色沉淀
B.一氧化碳与灼热的氧化铁反应:红棕色粉末逐渐变为黑色粉末
C.铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,产生黑色固体
D.研磨氯化铵与熟石灰粉末:白色固体中产生刺激性气味的气体
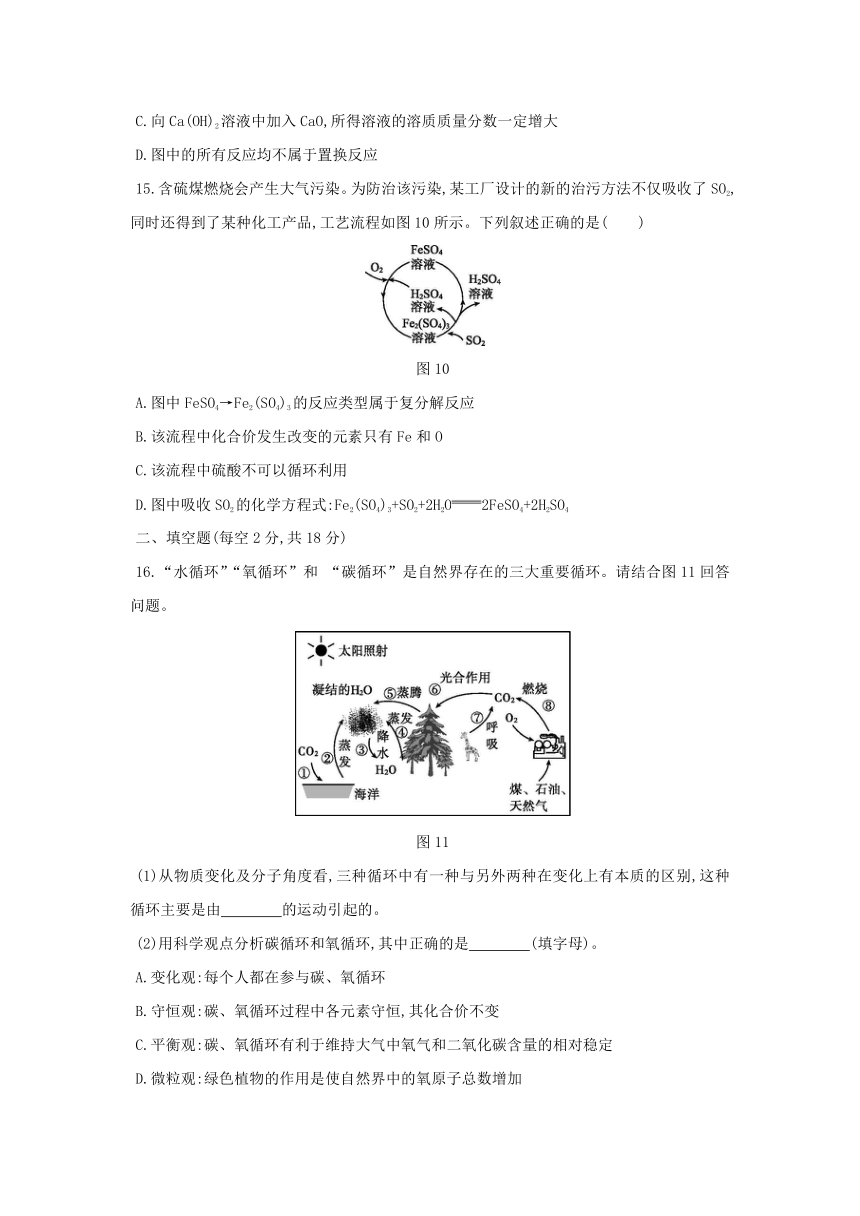
13.甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现如图8中箭头所示的转化。下列不符合要求的一组物质是( )
图8
选项
甲
X
A
O2
H2O
B
CO2
CaCO3
C
Fe
Fe3O4
D
NaOH
NaNO3
14.有关物质之间的部分关系如图9所示。其中“—”表示物质之间能发生化学反应,“→”表示物质之间的转化关系。下列说法正确的是( )
图9
A.物质X是一种常见的有机化合物
B.反应②一定是有盐参加的反应
C.向Ca(OH)2溶液中加入CaO,所得溶液的溶质质量分数一定增大
D.图中的所有反应均不属于置换反应
15.含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方法不仅吸收了SO2,同时还得到了某种化工产品,工艺流程如图10所示。下列叙述正确的是( )
图10
A.图中FeSO4→Fe2(SO4)3的反应类型属于复分解反应
B.该流程中化合价发生改变的元素只有Fe和O
C.该流程中硫酸不可以循环利用
D.图中吸收SO2的化学方程式:Fe2(SO4)3+SO2+2H2O2FeSO4+2H2SO4
二、填空题(每空2分,共18分)
16.“水循环”“氧循环”和 “碳循环”是自然界存在的三大重要循环。请结合图11回答问题。
图11
(1)从物质变化及分子角度看,三种循环中有一种与另外两种在变化上有本质的区别,这种循环主要是由 的运动引起的。?
(2)用科学观点分析碳循环和氧循环,其中正确的是 (填字母)。?
A.变化观:每个人都在参与碳、氧循环
B.守恒观:碳、氧循环过程中各元素守恒,其化合价不变
C.平衡观:碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
D.微粒观:绿色植物的作用是使自然界中的氧原子总数增加
(3)自然界中的碳循环主要是通过二氧化碳来实现的。图中消耗二氧化碳的途径有 (填数字)。近年来,大气中二氧化碳含量增加,导致温室效应加剧,因此人类要积极采取措施维持循环体系中二氧化碳的相对平衡。?
17.A~G是初中常见的物质,其中E为黑色固体。如图12为这些物质的转化关系图,其中部分生成物和反应条件已省略。
图12
(1)写出下列物质的化学式:B ,E 。?
(2)化学反应中常伴随有能量变化,B与水反应时会 (填“吸收”或“放出”)热量。?
(3)实验室不用石灰石(或大理石)与稀硫酸反应来制取C,原因是? 。?
(4)写出下列反应的化学方程式:D→F: ;
E→C: 。?
三、实验探究题(每空2分,共28分)
18.某校实验室有一瓶久置的铁屑,其成分是铁、氧化铁和水。为测定其中各成分的质量分数,某兴趣小组按如图13所示装置进行实验(装置气密性良好,固定装置已略去)。已知:氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物。
图13
部分实验步骤如下:
Ⅰ.称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
Ⅱ.连接好装置。关闭K2,打开K1,缓缓通入N2,点燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ.再次连接好装置,继续实验。关闭K1,打开K2,通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
实验数据记录如下表:
硬质玻璃管
硬质玻璃管和样品
步骤Ⅱ硬质玻璃管
和剩余固体
步骤Ⅲ硬质玻璃管
和剩余固体
质量
m1
m2
m3
m4
请回答下列问题。
(1)步骤Ⅲ丙处酒精灯的作用是 。?
(2)步骤Ⅲ硬质玻璃管中发生反应的化学方程式为 。?
(3)样品中氧化铁的质量分数为 (用含m1、m2、m3、m4的代数式表示)。若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数的测量结果将 (填“偏大”“偏小”或“不变”)。?
(4)有关样品,下列说法正确的是 (填字母)。?
A.样品中氢元素的质量为19(m2-m3)
B.样品中铁单质和氧化铁的质量总和为m3-m1
C.样品中铁单质的质量为m4-m1
D.样品中氧元素的质量为m3-m4
19.[2020·无锡] CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
(1)以CO2为原料制取炭黑的太阳能工艺如图14甲所示。
图14
①反应1的基本类型为 。?
②反应2中碳元素的化合价 (填“升高”“不变”或“降低”)。?
(2)利用NaOH溶液吸收CO2,部分转化关系如图乙。
反应①的化学方程式为 ,该转化中循环使用的物质是 。?
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂
Na2CO3
K2CO3
20 ℃最高浓度/(g/L)
212
1104
价格/(元/kg)
1.25
9.80
根据表中信息,选择K2CO3溶液作吸收液的优点是? 。?
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2OC2H5OH+3O2,研究显示,1 L“人造树叶”每天能从空气中吸收968 g CO2,则1 L“人造树叶”工作1天可得到乙醇的质量为 。?
(5)某研究小组设计如图15所示实验,探究CO2和H2在一定条件下反应的产物。
图15
查阅资料:①CO2和H2在催化剂和一定温度下反应转化为CO和H2O;②白色无水硫酸铜吸水后变为蓝色。
实验过程中观察到的主要现象有B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。?
②C装置中发生的反应的化学方程式为 。?
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是?
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?。?
四、解答题(共9分)
20.为探究CuO和C反应的最佳质量比(忽略副反应),某科学兴趣小组取17.2 g CuO和C的混合物,按不同的质量比进行实验,实验结果如图16 所示,横坐标表示混合物中CuO的质量分数,纵坐标表示生成物中Cu的质量。
(1)分析可知,CuO和C的最佳质量比对应图中的 点。?
(2)计算a点时,生成CO2的质量(写出详细计算过程)。
图16
答案
1.C [解析] NH4NO3中含有氮元素,是氮肥;KH2PO4为复合肥;K2SO4为钾肥;Ca3(PO4)2为磷肥。
2.A
3.A [解析] 图Ⅰ中的转化1是水与二氧化碳发生反应生成碳酸,不是酸雨形成的主要原因;图Ⅱ中,转化1是通过光合作用将二氧化碳和水(无机物)转化为葡萄糖(有机物),转化2是通过呼吸作用将葡萄糖(有机物)转化为二氧化碳和水(无机物);绿色植物通过光合作用,将太阳能转化成化学能储存在植物体内;碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定。
4.A 5.A
6.B [解析] A是相对分子质量为16的有机物,故A是甲烷;A在空气中不完全燃烧生成B、C、D,则B、C、D是水、二氧化碳和一氧化碳中的一种;常温下C和D是组成元素相同的气体,其中C可用于灭火,故C是二氧化碳,D是一氧化碳,B是水;E在空气中的含量居第二位,故E是氧气,代入框图,推断合理。氧气是由地壳中含量最多的元素——氧元素组成的单质。E→B、E→C不一定只能通过化合反应实现。
7.C
8.A [解析] 催化剂在化学反应中化学性质和质量是不变的,所以不用经常更换。
9.D
10.A [解析] 氢氧化钙溶液和稀硝酸反应生成了硝酸钙和水,硝酸钙溶液和氢氧化钾、二氧化碳反应生成了碳酸钙沉淀、硝酸钾和水;高锰酸钾受热分解能得到氧气,生成碱式碳酸铜除需要铜、氧气、二氧化碳外还需要水;硫酸钾中加入氢氧化钡溶液,能得到硫酸钡沉淀,但硫酸钡不溶于水,不能与氯化铵反应,更不能与氯化铵反应得到硝酸钡;碳酸钠与稀硫酸反应能得到硫酸钠,硫酸钠与稀硝酸不反应,更不能与稀硝酸反应得到氯化钠。
11.D
12.A [解析] 向氢氧化钠溶液中滴加氯化铁溶液时,氢氧化钠和氯化铁反应生成氯化钠和氢氧化铁沉淀,现象应该是无色溶液中产生红褐色沉淀。
13.D [解析] 氢氧化钠和硝酸反应会生成硝酸钠,但硝酸钠不发生任何复分解反应,不能生成氢氧化钠,不符合要求。
14.D
15.D [解析] 复分解反应过程中,元素的化合价不变,图中FeSO4→Fe2(SO4)3的过程中,铁元素由+2价变成+3价,所以该反应类型不属于复分解反应;该流程中化合价发生改变的元素为Fe、S和O;由工艺流程图可以看出,转化过程中生成了硫酸,硫酸又作为反应物参与反应,因此硫酸可循环利用;硫酸铁、水和二氧化硫反应生成硫酸亚铁和硫酸,所以图中吸收SO2的化学方程式为Fe2(SO4)3+SO2+2H2O2FeSO4+2H2SO4。
16.(1)水分子 (2)AC (3)①⑥
17.(1)CaO CuO
(2)放出
(3)生成的硫酸钙微溶于水,覆盖在石灰石(或大理石)表面,阻止反应继续进行
(4)Ca(OH)2+Na2CO3CaCO3↓+2NaOH CuO+COCu+CO2
[解析] E是黑色固体,能与硫酸反应生成G,且G能与F反应生成蓝色沉淀,则G是硫酸铜,F是氢氧化钠,E是氧化铜。氧化铜能与一氧化碳反应生成C,则C可能是二氧化碳。A能在高温下反应生成B和二氧化碳,则A是碳酸钙,B是氧化钙,氧化钙能与水反应生成氢氧化钙。代入框图,推断合理。
18.(1)点燃未反应的一氧化碳将其转化成二氧化碳,防止其污染环境
(2)Fe2O3+3CO2Fe+3CO2
(3)10(m3-m4)3(m2-m1)×100% 不变
(4)AB
[解析] (3)根据已知数据可知,样品的质量为m2-m1,氧化铁中氧元素的质量为m3-m4。则样品中氧化铁的质量为(m3-m4)÷48160×100%=10(m3-m4)3。则样品中氧化铁的质量分数为10(m3-m4)3(m2-m1)×100%。
(4)样品中水的质量为m2-m3,所以样品中氢元素的质量为(m2-m3)×218×100%=19(m2-m3);步骤Ⅱ后剩余的物质为铁和氧化铁,所以样品中铁单质和氧化铁的质量总和为m3-m1;样品中铁元素的质量为m4-m1;m3-m4仅是样品中氧化铁中氧元素的质量,而样品中氧元素的质量还包括水中氧元素的质量。
19.(1)①分解反应
②降低
(2)2NaOH+CO2Na2CO3+H2O 氢氧化钠
(3)碳酸钾吸收CO2的能力强
(4)506 g
(5)①检验是否生成水
②CuO+COCu+CO2(或CuO+COCu+CO2)
③高温条件下氢气能和氧化铜反应生成铜和水,没有反应的二氧化碳能使D中澄清石灰水变浑浊,也会产生实验中的现象
[解析] (1)①反应1中一种物质分解生成两种物质,是分解反应。②反应2中碳元素的化合价降低,由+4价变成0价。
(2)反应①中氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2Na2CO3+H2O。该转化中碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,循环使用的物质是氢氧化钠。
(4)设生成乙醇的质量为x。
2CO2+3H2OC2H5OH+3O2
88 46
968 g x
8846=968 gx x=506 g。
20.(1)b
(2)解:由图像可知,a点时CuO和C的混合物中CuO的质量为17.2 g×2043=8 g,碳的质量为17.2 g-8 g=9.2 g。由化学方程式质量关系可知,碳没有完全与氧化铜反应。
设生成CO2的质量为x。
2CuO+C2Cu+CO2↑
160 44
8 g x
16044=8 gx x=2.2 g
答:a点时,生成CO2的质量为2.2 g。
[解析] (1)由图像可知,混合物中CuO的质量分数为4043时,生成铜的质量最多,CuO和C的最佳质量比对应图中的b点。
一、选择题(每题3分,共45分)
1.氮肥能促进植物的枝叶繁茂,叶色浓绿。下列属于氮肥的是( )
A.KH2PO4 B.K2SO4 C.NH4NO3 D.Ca3(PO4)2
2.碳的耗用量称为“碳足迹”。一般情况下,排放的二氧化碳越多,碳足迹就越大。碳足迹的计算包括一切用于电力、建设、运输等方面的能源以及我们所使用的消耗品。以下做法可以减小碳足迹的是( )
A.减少一次性筷子的使用 B.大量使用煤、石油等燃料
C.将生活垃圾进行焚烧处理 D.以私家车代替公共交通工具出行
图1
图2
3.图2是自然界中碳、氧循环简图(X为H2CO3,Y为C6H12O6)。下列说法不正确的是( )
A.图Ⅰ中的转化1是酸雨形成的主要原因
B.图Ⅱ中可实现有机物与无机物的相互转化
C.绿色植物通过光合作用,将太阳能转化成化学能
D.碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
4.下列有关生产、环保、资源问题的叙述,错误的是( )
A.长期使用硫酸铵会使土壤呈酸性,应将硫酸铵与熟石灰混合使用
B.“温室效应”主要是由二氧化碳等气体引起的
C.pH<5.6的酸性降水称为酸雨,它的形成与大气中SO2等酸性污染物增多有关
D.高炉炼铁中所需的高温和一氧化碳的生成都与焦炭有关
5.[2019·宁波] 科学家研究发现,某地区重霾污染期间,颗粒物中硫酸盐含量迅速升高。硫酸盐形成的过程中,有一步化学反应的微观示意图如图3所示。下列说法错误的是( )
图3
A.该反应是置换反应 B.甲是氧化物
C.乙是一种大气污染物 D.丙遇到空气中的水会生成硫酸
6.A~E是初中科学常见的物质,其中A是相对分子质量为16的有机物,A在空气中不完全燃烧生成B、C、D,常温下C和D是组成元素相同的气体,其中C可用于灭火,E在空气中的含量居第二位。它们之间的相互转化关系如图4所示。下列叙述错误的是( )
图4
A.A是CH4
B.E→B、E→C只能通过化合反应实现
C.E是由地壳中含量最多的元素组成的单质
D.C→D反应的化学方程式可为CO2+C2CO
7.下表中“—”表示相连的物质间能发生反应,“→”表示一种物质经一步反应可转化为另一种物质。则甲、乙、丙、丁四种物质不符合对应转化关系的是( )
选项
A
B
C
D
转化
关系
物
质
甲
Ca(OH)2
C
Fe
Na2CO3
乙
HCl
O2
HCl
Ca(OH)2
丙
Na2CO3
Fe2O3
CO2
BaCl2
丁
Ba(OH)2
CO
NaOH
H2SO4
8.工业上用氨气(NH3)制取硝酸(HNO3),工业流程为①4NH3+5O24NO+6H2O;②2NO+O22NO2;③3NO2+H2O2HNO3+NO。下列判断不正确的是( )
A.反应①中使用的催化剂需要经常更换
B.在每一步反应中氮元素的化合价都发生了改变
C.制取硝酸过程中产生的一氧化氮可循环使用
D.为实现原子利用率为100%,可在②③中控制一氧化氮、氧气和水的分子个数比为4∶3∶2
9.[2020·包头] 利用废旧电池铜帽(含Cu、Zn)制取海绵铜(Cu),并得到硫酸锌溶液的主要流程如图5所示(反应条件已略去)。已知:2Cu+2H2SO4+O22CuSO4+2H2O。
图5
下列说法正确的是( )
A.步骤②中分离操作必须用到的玻璃仪器是烧杯和漏斗
B.溶液A中溶质是H2SO4、CuSO4
C.上述流程中物质B是锌,物质D是盐酸
D.A~E中都含有铜、锌两种元素的物质有A和C
10.下列物质的转化在给定条件下均能实现的是( )
A.Ca(OH)2溶液Ca(NO3)2溶液CaCO3
B.KMnO4O2Cu2(OH)2CO3
C.K2SO4BaSO4Ba(NO3)2
D.Na2CO3Na2SO4NaCl
11.以空气等为原料合成尿素[CO(NH2)2]的流程(部分产物略去)如图6所示,下列说法不正确的是( )
图6
A.X是N2 B.分离空气属于物理变化
C.尿素属于氮肥 D.煤与氧气的反应吸收热量
12.下列实验现象描述错误的是( )
图7
A.向氢氧化钠溶液中滴加氯化铁溶液:无色溶液中产生氢氧化铁白色沉淀
B.一氧化碳与灼热的氧化铁反应:红棕色粉末逐渐变为黑色粉末
C.铁丝在氧气中燃烧:银白色固体剧烈燃烧,火星四射,放出大量的热,产生黑色固体
D.研磨氯化铵与熟石灰粉末:白色固体中产生刺激性气味的气体
13.甲、乙、丙、X、Y、Z六种物质间只通过一步反应就能实现如图8中箭头所示的转化。下列不符合要求的一组物质是( )
图8
选项
甲
X
A
O2
H2O
B
CO2
CaCO3
C
Fe
Fe3O4
D
NaOH
NaNO3
14.有关物质之间的部分关系如图9所示。其中“—”表示物质之间能发生化学反应,“→”表示物质之间的转化关系。下列说法正确的是( )
图9
A.物质X是一种常见的有机化合物
B.反应②一定是有盐参加的反应
C.向Ca(OH)2溶液中加入CaO,所得溶液的溶质质量分数一定增大
D.图中的所有反应均不属于置换反应
15.含硫煤燃烧会产生大气污染。为防治该污染,某工厂设计的新的治污方法不仅吸收了SO2,同时还得到了某种化工产品,工艺流程如图10所示。下列叙述正确的是( )
图10
A.图中FeSO4→Fe2(SO4)3的反应类型属于复分解反应
B.该流程中化合价发生改变的元素只有Fe和O
C.该流程中硫酸不可以循环利用
D.图中吸收SO2的化学方程式:Fe2(SO4)3+SO2+2H2O2FeSO4+2H2SO4
二、填空题(每空2分,共18分)
16.“水循环”“氧循环”和 “碳循环”是自然界存在的三大重要循环。请结合图11回答问题。
图11
(1)从物质变化及分子角度看,三种循环中有一种与另外两种在变化上有本质的区别,这种循环主要是由 的运动引起的。?
(2)用科学观点分析碳循环和氧循环,其中正确的是 (填字母)。?
A.变化观:每个人都在参与碳、氧循环
B.守恒观:碳、氧循环过程中各元素守恒,其化合价不变
C.平衡观:碳、氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定
D.微粒观:绿色植物的作用是使自然界中的氧原子总数增加
(3)自然界中的碳循环主要是通过二氧化碳来实现的。图中消耗二氧化碳的途径有 (填数字)。近年来,大气中二氧化碳含量增加,导致温室效应加剧,因此人类要积极采取措施维持循环体系中二氧化碳的相对平衡。?
17.A~G是初中常见的物质,其中E为黑色固体。如图12为这些物质的转化关系图,其中部分生成物和反应条件已省略。
图12
(1)写出下列物质的化学式:B ,E 。?
(2)化学反应中常伴随有能量变化,B与水反应时会 (填“吸收”或“放出”)热量。?
(3)实验室不用石灰石(或大理石)与稀硫酸反应来制取C,原因是? 。?
(4)写出下列反应的化学方程式:D→F: ;
E→C: 。?
三、实验探究题(每空2分,共28分)
18.某校实验室有一瓶久置的铁屑,其成分是铁、氧化铁和水。为测定其中各成分的质量分数,某兴趣小组按如图13所示装置进行实验(装置气密性良好,固定装置已略去)。已知:氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物。
图13
部分实验步骤如下:
Ⅰ.称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
Ⅱ.连接好装置。关闭K2,打开K1,缓缓通入N2,点燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ.再次连接好装置,继续实验。关闭K1,打开K2,通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
实验数据记录如下表:
硬质玻璃管
硬质玻璃管和样品
步骤Ⅱ硬质玻璃管
和剩余固体
步骤Ⅲ硬质玻璃管
和剩余固体
质量
m1
m2
m3
m4
请回答下列问题。
(1)步骤Ⅲ丙处酒精灯的作用是 。?
(2)步骤Ⅲ硬质玻璃管中发生反应的化学方程式为 。?
(3)样品中氧化铁的质量分数为 (用含m1、m2、m3、m4的代数式表示)。若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数的测量结果将 (填“偏大”“偏小”或“不变”)。?
(4)有关样品,下列说法正确的是 (填字母)。?
A.样品中氢元素的质量为19(m2-m3)
B.样品中铁单质和氧化铁的质量总和为m3-m1
C.样品中铁单质的质量为m4-m1
D.样品中氧元素的质量为m3-m4
19.[2020·无锡] CO2是最主要的温室气体,也是巨大的碳资源,CO2的低能耗捕集、转化和利用正受到世界各国的广泛关注。
(1)以CO2为原料制取炭黑的太阳能工艺如图14甲所示。
图14
①反应1的基本类型为 。?
②反应2中碳元素的化合价 (填“升高”“不变”或“降低”)。?
(2)利用NaOH溶液吸收CO2,部分转化关系如图乙。
反应①的化学方程式为 ,该转化中循环使用的物质是 。?
(3)利用Na2CO3或K2CO3溶液吸收低浓度的CO2,将其转化为NaHCO3或KHCO3,NaHCO3或KHCO3受热分解生成高浓度的CO2储存利用,生成的Na2CO3或K2CO3循环使用以降低生产成本。
吸收剂
Na2CO3
K2CO3
20 ℃最高浓度/(g/L)
212
1104
价格/(元/kg)
1.25
9.80
根据表中信息,选择K2CO3溶液作吸收液的优点是? 。?
(4)利用一种新型“人造树叶”将CO2转化为乙醇(C2H5OH)的反应如下:2CO2+3H2OC2H5OH+3O2,研究显示,1 L“人造树叶”每天能从空气中吸收968 g CO2,则1 L“人造树叶”工作1天可得到乙醇的质量为 。?
(5)某研究小组设计如图15所示实验,探究CO2和H2在一定条件下反应的产物。
图15
查阅资料:①CO2和H2在催化剂和一定温度下反应转化为CO和H2O;②白色无水硫酸铜吸水后变为蓝色。
实验过程中观察到的主要现象有B装置中白色固体变为蓝色,C装置中黑色固体变为红色,D装置中澄清石灰水变浑浊。
①设计B装置的目的是 。?
②C装置中发生的反应的化学方程式为 。?
③研究小组反思后认为,根据上述实验现象不能确认CO2和H2反应生成了CO,理由是?
? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ? ?。?
四、解答题(共9分)
20.为探究CuO和C反应的最佳质量比(忽略副反应),某科学兴趣小组取17.2 g CuO和C的混合物,按不同的质量比进行实验,实验结果如图16 所示,横坐标表示混合物中CuO的质量分数,纵坐标表示生成物中Cu的质量。
(1)分析可知,CuO和C的最佳质量比对应图中的 点。?
(2)计算a点时,生成CO2的质量(写出详细计算过程)。
图16
答案
1.C [解析] NH4NO3中含有氮元素,是氮肥;KH2PO4为复合肥;K2SO4为钾肥;Ca3(PO4)2为磷肥。
2.A
3.A [解析] 图Ⅰ中的转化1是水与二氧化碳发生反应生成碳酸,不是酸雨形成的主要原因;图Ⅱ中,转化1是通过光合作用将二氧化碳和水(无机物)转化为葡萄糖(有机物),转化2是通过呼吸作用将葡萄糖(有机物)转化为二氧化碳和水(无机物);绿色植物通过光合作用,将太阳能转化成化学能储存在植物体内;碳循环和氧循环有利于维持大气中氧气和二氧化碳含量的相对稳定。
4.A 5.A
6.B [解析] A是相对分子质量为16的有机物,故A是甲烷;A在空气中不完全燃烧生成B、C、D,则B、C、D是水、二氧化碳和一氧化碳中的一种;常温下C和D是组成元素相同的气体,其中C可用于灭火,故C是二氧化碳,D是一氧化碳,B是水;E在空气中的含量居第二位,故E是氧气,代入框图,推断合理。氧气是由地壳中含量最多的元素——氧元素组成的单质。E→B、E→C不一定只能通过化合反应实现。
7.C
8.A [解析] 催化剂在化学反应中化学性质和质量是不变的,所以不用经常更换。
9.D
10.A [解析] 氢氧化钙溶液和稀硝酸反应生成了硝酸钙和水,硝酸钙溶液和氢氧化钾、二氧化碳反应生成了碳酸钙沉淀、硝酸钾和水;高锰酸钾受热分解能得到氧气,生成碱式碳酸铜除需要铜、氧气、二氧化碳外还需要水;硫酸钾中加入氢氧化钡溶液,能得到硫酸钡沉淀,但硫酸钡不溶于水,不能与氯化铵反应,更不能与氯化铵反应得到硝酸钡;碳酸钠与稀硫酸反应能得到硫酸钠,硫酸钠与稀硝酸不反应,更不能与稀硝酸反应得到氯化钠。
11.D
12.A [解析] 向氢氧化钠溶液中滴加氯化铁溶液时,氢氧化钠和氯化铁反应生成氯化钠和氢氧化铁沉淀,现象应该是无色溶液中产生红褐色沉淀。
13.D [解析] 氢氧化钠和硝酸反应会生成硝酸钠,但硝酸钠不发生任何复分解反应,不能生成氢氧化钠,不符合要求。
14.D
15.D [解析] 复分解反应过程中,元素的化合价不变,图中FeSO4→Fe2(SO4)3的过程中,铁元素由+2价变成+3价,所以该反应类型不属于复分解反应;该流程中化合价发生改变的元素为Fe、S和O;由工艺流程图可以看出,转化过程中生成了硫酸,硫酸又作为反应物参与反应,因此硫酸可循环利用;硫酸铁、水和二氧化硫反应生成硫酸亚铁和硫酸,所以图中吸收SO2的化学方程式为Fe2(SO4)3+SO2+2H2O2FeSO4+2H2SO4。
16.(1)水分子 (2)AC (3)①⑥
17.(1)CaO CuO
(2)放出
(3)生成的硫酸钙微溶于水,覆盖在石灰石(或大理石)表面,阻止反应继续进行
(4)Ca(OH)2+Na2CO3CaCO3↓+2NaOH CuO+COCu+CO2
[解析] E是黑色固体,能与硫酸反应生成G,且G能与F反应生成蓝色沉淀,则G是硫酸铜,F是氢氧化钠,E是氧化铜。氧化铜能与一氧化碳反应生成C,则C可能是二氧化碳。A能在高温下反应生成B和二氧化碳,则A是碳酸钙,B是氧化钙,氧化钙能与水反应生成氢氧化钙。代入框图,推断合理。
18.(1)点燃未反应的一氧化碳将其转化成二氧化碳,防止其污染环境
(2)Fe2O3+3CO2Fe+3CO2
(3)10(m3-m4)3(m2-m1)×100% 不变
(4)AB
[解析] (3)根据已知数据可知,样品的质量为m2-m1,氧化铁中氧元素的质量为m3-m4。则样品中氧化铁的质量为(m3-m4)÷48160×100%=10(m3-m4)3。则样品中氧化铁的质量分数为10(m3-m4)3(m2-m1)×100%。
(4)样品中水的质量为m2-m3,所以样品中氢元素的质量为(m2-m3)×218×100%=19(m2-m3);步骤Ⅱ后剩余的物质为铁和氧化铁,所以样品中铁单质和氧化铁的质量总和为m3-m1;样品中铁元素的质量为m4-m1;m3-m4仅是样品中氧化铁中氧元素的质量,而样品中氧元素的质量还包括水中氧元素的质量。
19.(1)①分解反应
②降低
(2)2NaOH+CO2Na2CO3+H2O 氢氧化钠
(3)碳酸钾吸收CO2的能力强
(4)506 g
(5)①检验是否生成水
②CuO+COCu+CO2(或CuO+COCu+CO2)
③高温条件下氢气能和氧化铜反应生成铜和水,没有反应的二氧化碳能使D中澄清石灰水变浑浊,也会产生实验中的现象
[解析] (1)①反应1中一种物质分解生成两种物质,是分解反应。②反应2中碳元素的化合价降低,由+4价变成0价。
(2)反应①中氢氧化钠和二氧化碳反应生成碳酸钠和水,反应的化学方程式为2NaOH+CO2Na2CO3+H2O。该转化中碳酸钠和氢氧化钙反应生成氢氧化钠和碳酸钙,循环使用的物质是氢氧化钠。
(4)设生成乙醇的质量为x。
2CO2+3H2OC2H5OH+3O2
88 46
968 g x
8846=968 gx x=506 g。
20.(1)b
(2)解:由图像可知,a点时CuO和C的混合物中CuO的质量为17.2 g×2043=8 g,碳的质量为17.2 g-8 g=9.2 g。由化学方程式质量关系可知,碳没有完全与氧化铜反应。
设生成CO2的质量为x。
2CuO+C2Cu+CO2↑
160 44
8 g x
16044=8 gx x=2.2 g
答:a点时,生成CO2的质量为2.2 g。
[解析] (1)由图像可知,混合物中CuO的质量分数为4043时,生成铜的质量最多,CuO和C的最佳质量比对应图中的b点。
同课章节目录
- 第一章 宇宙的起源与演化
- 1 我们的宇宙
- 2 热大爆炸宇宙模型
- 3 恒星的一生
- 4 星际航行和空间技术
- 第二章 地球的演化和生物圈的形成
- 1 地球的演化
- 2 生命起源
- 3 生物进化
- 4 生态平衡
- 第三章 物质的转化和元素的循环
- 1 物质的转化
- 2 自然界中的碳循环和氧循环
- 3 自然界中的氮循环
- 第四章 健康与保健
- 1 健康、亚健康和疾病
- 2 运动与健康
- 3 免疫与健康
- 4 营养与健康
- 5 卫生与健康
- 6 环境与健康
- 第五章 生物的遗传和变异
- 1 生物的遗传
- 2 生物的变异
- 第六章 能源与社会
- 1 能源和能源的分类
- 2 太阳能的利用
- 3 核能的开发与放射性防护
- 4 新能源与可持续发展
- 第七章 科学与社会发展
- 1 科学就是力量
- 2 科学推动技术发展
- 3 科学技术推动经济增长
- 4 科学技术与可持续发展
