2020-2021学年人教版高二化学选修5——1.2 有机化合物的结构特点1 课件(27张PPT)
文档属性
| 名称 | 2020-2021学年人教版高二化学选修5——1.2 有机化合物的结构特点1 课件(27张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-24 00:00:00 | ||
图片预览





文档简介
化学 · 选修5
第一章 认识有机化合物
第二节 有机化合物的结构特点
第1课时 碳原子成键特点 同分异构现象
※明确学习目标※
1、进一步认识理解有机物中碳原子的成键特点,知道有机物结构的常见表示方式。
2、进一步了解认识有机物的同分异构现象,体会物质结构的多样性决定物质性质的多样性。
H、O元素只能组成两种物质为什么C、H元素却能组成上千万种有机物?
碳原子在形成化学键的过程中易形成共价键还是离子键?为什么?
思考探究
碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子。
碳原子通过共价键与其他原子形成共价化合物。
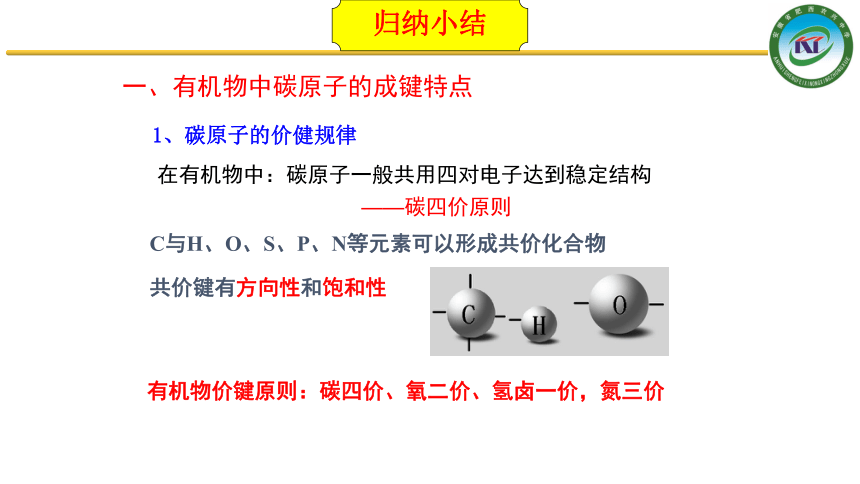
在有机物中:碳原子一般共用四对电子达到稳定结构
——碳四价原则
C与H、O、S、P、N等元素可以形成共价化合物
共价键有方向性和饱和性
有机物价键原则:碳四价、氧二价、氢卤一价,氮三价
归纳小结
一、有机物中碳原子的成键特点
1、碳原子的价健规律
温故知新
⑴请写出甲烷的分子式、电子式、结构式、结构简式。 ⑵表示甲烷空间构型的模型有哪些?
CH4
结构简式
电子式
H
..
H C H
H
..
..
..
结构式
H-C-H
H
H
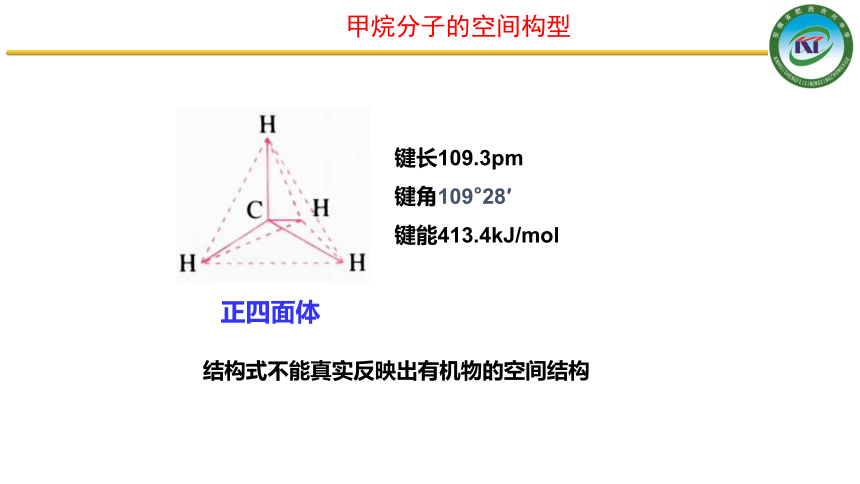
键长109.3pm
键角109°28′
键能413.4kJ/mol
正四面体
结构式不能真实反映出有机物的空间结构
甲烷分子的空间构型
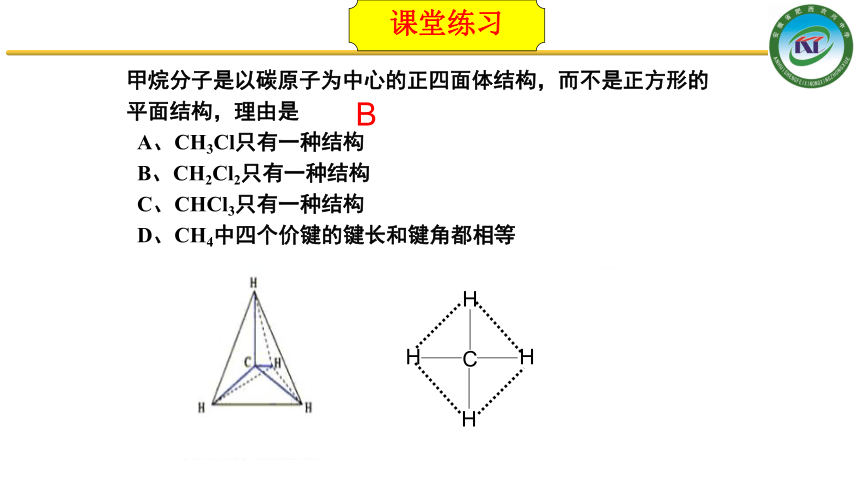
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是
A、CH3Cl只有一种结构
B、CH2Cl2只有一种结构
C、CHCl3只有一种结构
D、CH4中四个价键的键长和键角都相等
B
C
H
H
H
H
课堂练习
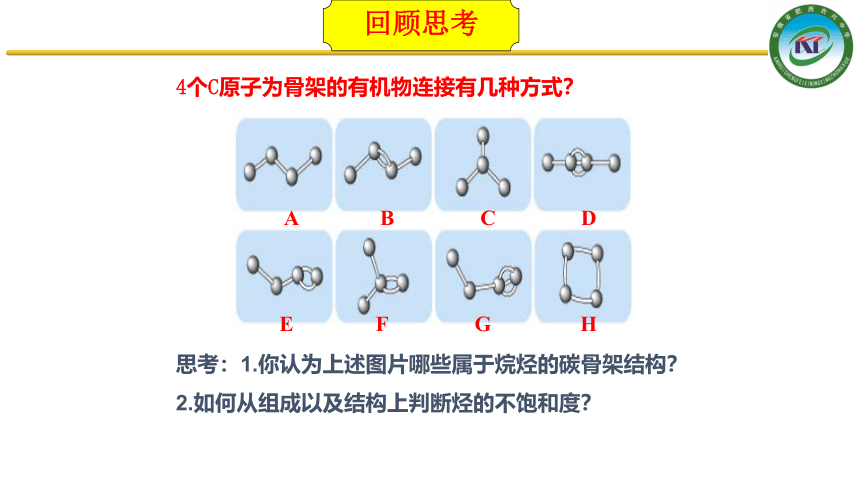
4个C原子为骨架的有机物连接有几种方式?
思考:1.你认为上述图片哪些属于烷烃的碳骨架结构?
2.如何从组成以及结构上判断烃的不饱和度?
回顾思考
A
B
C
D
E
F
G
H
2、碳原子间的结合方式
碳原子不仅能与H或其他原子形成4个共价键,碳原子之间也能相互以共价键结合。
(1)碳原子之间可以形成稳定的单键、双键、三键;
当碳原子数相同的情况下,随着双键的改变氢原子数也随之改变
(2)多个碳原子可以相互结合成长短不一的碳链,
碳链可带有支链;
(3)多个碳原子还可以相互结合成环,碳环和碳链还可以相互结合。
归纳小结
种类
表示方法
实例
分子式
用元素符号表示物质的分子组成
CH4、C3H6
最简式
(实验式)
表示物质组成的各元素原子的最简整数比
乙烯最简式为CH2,C6H12O6最简式为CH2O
电子式
用小黑点或“×”号表示原子最外层电子的成键情况
有机物的组成与结构表示方法
归纳小结
种类
表示方法
实例
结构式
用短线“—”来表示1个共价键,用“—”(单键)、“===”(双键)或“”(三键)将所有原子连接起来
结构简式
①表示单键的“—”可以省略,将与碳原子相连的其他原子写在其旁边,在右下角注明其个数
②表示碳碳双键、碳碳三键的“===”、“”不能省略
③醛基( )、羧基( )可简化成
—CHO、—COOH
CH3CH===CH2、
OHC—COOH
种类
表示方法
实例
键线式
①进一步省去碳氢元素的元素符号,只要求表示出碳碳键以及与碳原子相连的基团
②图式中的每个拐点和终点均表示一个碳原子,每个碳原子都形成四个共价键,不足的用氢原子补足
球棍模型
小球表示原子,短棍表示化学键
比例模型
用不同体积的小球表示不同原子的大小
课堂练习
CH3CH2CHCH3
CH3
C5H12的三种同分异构体的结构简式
链状、无支链
链状、有支链
链状、多支链
36.07℃
27.9℃
9.5℃
结构特点
沸点
物质的分子式相同,形成的分子的结构可能不同
结论
CH3CH2CH2CH2CH3
CH3CHCH3
CH3
CH3
球棍模型
支
链
越
多
沸
点
越
低
思考交流
小组交流完成课本P9“思考与交流”内容。
物质名称
正戊烷
异戊烷
新戊烷
结构式
相同点
不同点
沸 点
36.07℃
27.9℃
9.5℃
分子组成相同,链状结构
结构不同,出现带有支链结构
结论:支链越多,沸点越低!
常温下是气体
(5个碳原子)
1、概念:
化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构体现象
具有相同的分子式,但具有不同的结构现象的化合物互称为同分异构体
二、有机化合物的同分异构现象
以烷烃为例
碳原
子数
1
2
3
4
5
6
8
11
16
20
同分异体数
1
1
1
2
3
5
18
159
10359
366319
甲烷、乙烷、丙烷都只有1种结构;
丁烷有2种结构;戊烷有3种结构;
己烷有5种结构。
碳原子数目越多的物质,同分异构体数目也越多
思考下列有机物的关系是不是同分异构体?
第一组
第二组
第三组
对比两个有机物,它们是否为同分异构体?它们的区别是什么?
碳链异构
2、同分异构体的常见类型:
二、有机化合物的同分异构现象
对比两个有机物,它们是否为同分异构体?它们的区别是什么?
官能团位置异构
对比两个有机物,它们是否为同分异构体?它们的区别是什么?
官能团种类异构
同分异构体常见三种类型
碳链异构(如丁烷与异丁烷)
官能团位置异构(如1-丁烯与2-丁烯)
官能团种类异构(如乙醇与甲醚)
归纳小结
常见的官能团种类异构的有机物
1.单烯烃与环烷烃
2.二烯烃与炔烃
3.分子式相同的醇和醚 CH3CH2CH2OH CH3CH2OCH3
4.
5.饱和一元醛和酮
饱和一元酸和酯
氨基酸与硝基化合物
(环戊烷)
和
CH3
C
CH3
CH
CH3
互为同分异构体的是?
①
②
CH2
C
CH3
CH2
CH3
CH3
CH
CH3
C
CH3
③
√
√
课堂练习
1、完成课本P11习题(课本上做)。。
2、预习后面的内容。
※布置作业※
第一章 认识有机化合物
第二节 有机化合物的结构特点
第1课时 碳原子成键特点 同分异构现象
※明确学习目标※
1、进一步认识理解有机物中碳原子的成键特点,知道有机物结构的常见表示方式。
2、进一步了解认识有机物的同分异构现象,体会物质结构的多样性决定物质性质的多样性。
H、O元素只能组成两种物质为什么C、H元素却能组成上千万种有机物?
碳原子在形成化学键的过程中易形成共价键还是离子键?为什么?
思考探究
碳原子最外层有4个电子,不易失去或获得电子而形成阳离子或阴离子。
碳原子通过共价键与其他原子形成共价化合物。
在有机物中:碳原子一般共用四对电子达到稳定结构
——碳四价原则
C与H、O、S、P、N等元素可以形成共价化合物
共价键有方向性和饱和性
有机物价键原则:碳四价、氧二价、氢卤一价,氮三价
归纳小结
一、有机物中碳原子的成键特点
1、碳原子的价健规律
温故知新
⑴请写出甲烷的分子式、电子式、结构式、结构简式。 ⑵表示甲烷空间构型的模型有哪些?
CH4
结构简式
电子式
H
..
H C H
H
..
..
..
结构式
H-C-H
H
H
键长109.3pm
键角109°28′
键能413.4kJ/mol
正四面体
结构式不能真实反映出有机物的空间结构
甲烷分子的空间构型
甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是
A、CH3Cl只有一种结构
B、CH2Cl2只有一种结构
C、CHCl3只有一种结构
D、CH4中四个价键的键长和键角都相等
B
C
H
H
H
H
课堂练习
4个C原子为骨架的有机物连接有几种方式?
思考:1.你认为上述图片哪些属于烷烃的碳骨架结构?
2.如何从组成以及结构上判断烃的不饱和度?
回顾思考
A
B
C
D
E
F
G
H
2、碳原子间的结合方式
碳原子不仅能与H或其他原子形成4个共价键,碳原子之间也能相互以共价键结合。
(1)碳原子之间可以形成稳定的单键、双键、三键;
当碳原子数相同的情况下,随着双键的改变氢原子数也随之改变
(2)多个碳原子可以相互结合成长短不一的碳链,
碳链可带有支链;
(3)多个碳原子还可以相互结合成环,碳环和碳链还可以相互结合。
归纳小结
种类
表示方法
实例
分子式
用元素符号表示物质的分子组成
CH4、C3H6
最简式
(实验式)
表示物质组成的各元素原子的最简整数比
乙烯最简式为CH2,C6H12O6最简式为CH2O
电子式
用小黑点或“×”号表示原子最外层电子的成键情况
有机物的组成与结构表示方法
归纳小结
种类
表示方法
实例
结构式
用短线“—”来表示1个共价键,用“—”(单键)、“===”(双键)或“”(三键)将所有原子连接起来
结构简式
①表示单键的“—”可以省略,将与碳原子相连的其他原子写在其旁边,在右下角注明其个数
②表示碳碳双键、碳碳三键的“===”、“”不能省略
③醛基( )、羧基( )可简化成
—CHO、—COOH
CH3CH===CH2、
OHC—COOH
种类
表示方法
实例
键线式
①进一步省去碳氢元素的元素符号,只要求表示出碳碳键以及与碳原子相连的基团
②图式中的每个拐点和终点均表示一个碳原子,每个碳原子都形成四个共价键,不足的用氢原子补足
球棍模型
小球表示原子,短棍表示化学键
比例模型
用不同体积的小球表示不同原子的大小
课堂练习
CH3CH2CHCH3
CH3
C5H12的三种同分异构体的结构简式
链状、无支链
链状、有支链
链状、多支链
36.07℃
27.9℃
9.5℃
结构特点
沸点
物质的分子式相同,形成的分子的结构可能不同
结论
CH3CH2CH2CH2CH3
CH3CHCH3
CH3
CH3
球棍模型
支
链
越
多
沸
点
越
低
思考交流
小组交流完成课本P9“思考与交流”内容。
物质名称
正戊烷
异戊烷
新戊烷
结构式
相同点
不同点
沸 点
36.07℃
27.9℃
9.5℃
分子组成相同,链状结构
结构不同,出现带有支链结构
结论:支链越多,沸点越低!
常温下是气体
(5个碳原子)
1、概念:
化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构体现象
具有相同的分子式,但具有不同的结构现象的化合物互称为同分异构体
二、有机化合物的同分异构现象
以烷烃为例
碳原
子数
1
2
3
4
5
6
8
11
16
20
同分异体数
1
1
1
2
3
5
18
159
10359
366319
甲烷、乙烷、丙烷都只有1种结构;
丁烷有2种结构;戊烷有3种结构;
己烷有5种结构。
碳原子数目越多的物质,同分异构体数目也越多
思考下列有机物的关系是不是同分异构体?
第一组
第二组
第三组
对比两个有机物,它们是否为同分异构体?它们的区别是什么?
碳链异构
2、同分异构体的常见类型:
二、有机化合物的同分异构现象
对比两个有机物,它们是否为同分异构体?它们的区别是什么?
官能团位置异构
对比两个有机物,它们是否为同分异构体?它们的区别是什么?
官能团种类异构
同分异构体常见三种类型
碳链异构(如丁烷与异丁烷)
官能团位置异构(如1-丁烯与2-丁烯)
官能团种类异构(如乙醇与甲醚)
归纳小结
常见的官能团种类异构的有机物
1.单烯烃与环烷烃
2.二烯烃与炔烃
3.分子式相同的醇和醚 CH3CH2CH2OH CH3CH2OCH3
4.
5.饱和一元醛和酮
饱和一元酸和酯
氨基酸与硝基化合物
(环戊烷)
和
CH3
C
CH3
CH
CH3
互为同分异构体的是?
①
②
CH2
C
CH3
CH2
CH3
CH3
CH
CH3
C
CH3
③
√
√
课堂练习
1、完成课本P11习题(课本上做)。。
2、预习后面的内容。
※布置作业※
