6.3.1化学能转化为电能 课件【新教材】2020-2021学年苏教版(2019)高一化学必修第二册(56张ppt)
文档属性
| 名称 | 6.3.1化学能转化为电能 课件【新教材】2020-2021学年苏教版(2019)高一化学必修第二册(56张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-26 00:00:00 | ||
图片预览











文档简介
专题六 化学反应与能量变化
—化学能与电能的转化
第1课时
化学能转化为电能
水电站
直接从自然界取得的能源称为一次能源
(如流水、风力、原煤、石油、天然气、天然铀矿)
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
一次能源经加工、转换得到的能源称为二次能源
如电力、蒸汽等
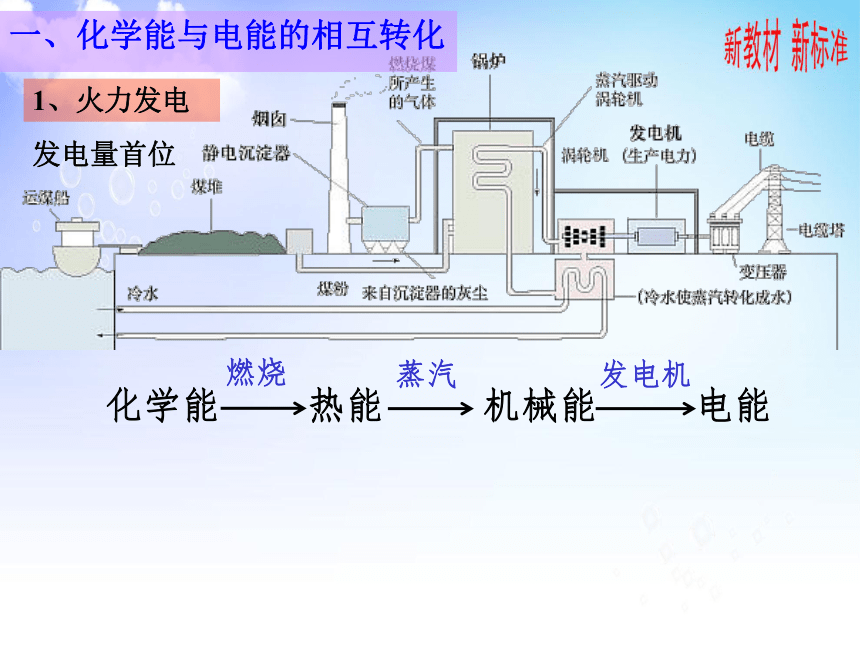
化学能 热能 机械能 电能
燃烧
蒸汽
发电机
一、化学能与电能的相互转化
1、火力发电
发电量首位
【思考与交流】
火
力
发
电
有
什
么
缺
点
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的
利用率低
化学能 电能
直接?
伏 特 和 伏 打 电 池
伏打电池的发明源于一个有趣的生物实验:在死去的青蛙腿上同时插入用导线连接着两种不同材料的电极,青蛙腿就像触电似的痉挛起来。
你知道其中的奥秘吗?
开 题
你听说过伏打电池吗?
【实验一】:将锌片、铜片插入稀硫酸,有何现象?
Cu
Zn
稀硫酸
锌片上有气泡产生,铜片上无现象
原理:
Zn + 2H+ = Zn2+ + H2↑
2e-
【实验二】锌片和铜片用导线连接后插入稀硫酸中
实验现象:
铜片上有气泡产生
Cu
Zn
稀硫酸
Zn-2e- = Zn2+
2H+ + 2e-=H2↑
产生气体的原因
Cu
Zn
稀硫酸
Zn2+
H+
H+
电流计
A
H2
-
-
电流方向
电子方向
2、组成:
①电极:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;
不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
②电解质溶液
③闭合回路
一、原电池
1、定义:把化学能转变为电能的装置.
Cu
Zn
稀硫酸
3、电极反应
2H++2e-=H2↑
负极:
Zn-2e-=Zn2+
正极:
氧化反应
还原反应
氧化还原反应
总反应:Zn + 2H+ = Zn2+ + H2↑(离子方程式)
失去电子
得到电子
Zn + H2SO4 = ZnSO4 + H2↑(化学方程式)
外电路——电子导电
电子从负极→正极
内电路——自由离子导电
阴离子移向负极
阳离子移向正极
4、原电池的闭合回路是怎样形成的?
Zn2+ H+
SO42-
e-
e-
Zn Cu
内电路
H2SO4
外电路
形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
【实验探究】
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中
形成原电池的条件
【实验探究】
形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
【实验探究】
二、 原电池的构成条件:
① 一般有两种活动性不同的金属(或非金属导体)作电极。
② 电解质溶液(电极与电解质溶液接触)。
③ 两极相连形成闭合电路。
④有一个自发的氧化还原反应
【小结】
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
2H++2e=H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
小结:
【实验探究】:将铝片、石墨插入稀硫酸溶液中,是否可以形成原电池?
石墨
Al
稀硫酸
石墨
Al
稀硫酸
(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习1
Mg
Fe
稀硫酸
(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习2
Cu
Zn
硫酸铜
【实验探究】:将锌片、铜片插入硫酸铜溶液中,是否可以形成原电池?
Cu
Zn
硫酸铜
(1)说明两个电极质量的变化情况;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习3
三、判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
负极:一般活泼的金属
正极:活泼性较弱的金属或能导电的非金属
2、根据电流方向或电子流动方向判断:
负极:电子流出、电流流入
正极:电子流入、电流流出
3、根据原电池两极发生的变化来判断:
负极:总是失电子发生氧化反应,
正极:总是得电子发生还原反应。
4、电极反应现象.
负极:不断溶解(变细),质量减少
正极:有气体产生,或质量增加(变粗)
1. 在如下图所示的8个装置中,属于原电池的有 .
④ ⑥ ⑦
e
课堂练习:
练习1、写出下列原电池的电极反应式和原电池总反应式。
负极(Fe): Fe - 2e- = Fe2+
正极(C): 2H+ + 2e- = H2↑
总反应式: Fe+ 2H+ = Fe2+ + H2↑
练习2、若把1中的稀H2SO4改为NaCl溶液,能否构成原电池,若能,请写出电极反应式和原电池总反应式。
负极(Fe) Fe - 2e- = Fe2+
正极(C) 2H2O + O2 + 4e- = 4OH-
总反应式: 2Fe+ 2H2O + O2 =2 Fe(OH)2
3讨论:
在下列(1)(2)两个装置中,Fe极分别是原电池的什么极?写出Fe极上发生反应的方程式。
Fe是负极
Fe-2e-=Fe2+
Fe是正极
2H++2e-=H2↑
(1) (2) (3)
比较Fe被腐蚀的快慢:
(1)>(3)>(2)
说明:Fe作原电池负极时,腐蚀加快,作正极时不被腐蚀。
四、金属的电化腐蚀
1、金属腐蚀
如钢铁的生锈、铜绿的形成等。
——金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程
2、金属腐蚀的本质
——金属原子失去电子而被氧化
3、金属腐蚀的类型
化学腐蚀
电化学腐蚀
(为主)
4、化学腐蚀
金属跟接触到的物质(O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀
5、电化学腐蚀
不纯的金属跟电解质溶液接触时,发生原电池反应,较活泼的金属失去电子被氧化而腐蚀
钢铁的电化腐蚀
Fe和少量的C与表面的水膜形成无数的微小原电池
Fe(负极):2Fe-4e--=2Fe2+
C(正极):O2+4e-+2H2O=4OH-
溶液中: Fe2++2OH- =Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
铁锈(Fe2O3·H2O)
C
Fe
电解质溶液 O2
Fe2+
OH-
【思考】钢铁及其制品通常为含碳的铁合金,在干燥空
气里长时间不易生锈,但在潮湿的空气里却很
快就会生锈,为什么?
化学腐蚀和电化学腐蚀的比较
化学腐蚀
电化学腐蚀
反应条件
有无电流
反应本质
相互关系
金属跟氧化剂直接接触
不纯金属或合金跟电解质溶液接触
无
有
金属
被氧化的过程
较活泼的金属
被氧化的过程
化学腐蚀和电化学腐蚀往往同时发生
以下现象与电化腐蚀无关的是:
A、黄铜(铜锌合金)制作的铜锣不易产生铜绿
B、生铁比软铁芯(几乎是纯铁)容易生锈
C、铁质器件附有铜质配件,在接触处易生铁锈
D、银质奖牌久置后表面变暗
【讨论】
1)写出钢铁在酸性较强的水膜里发生腐蚀的电极反应
Fe(负极):Fe-2e-=Fe2+
C(正极):2H++2e-=H2↑
析氢腐蚀
2)写出马口铁(铁镀锡)、白铁皮(铁镀锌)镀层破
损后,发生电化腐蚀的电极反应式,并解释铁被腐
蚀快慢的原因。
马口铁
负极(Fe)
正极(Sn)
负极(Zn)
正极(Fe)
白铁皮
:2Zn-4e-=2Zn2+
:O2+4e-+2H2O=4OH-
:2Fe-4e-=2Fe2+
:O2+4e-+2H2O=4OH-
形成原电池,铁是负极,加速腐蚀。
形成原电池,锌作负极对铁(正极)起保护作用。
五、原电池的应用
(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。
(2)判断正负极并写出电极反应。
石墨
Fe
FeCl3溶液
负极(铁):
Fe-2e-=Fe2+
正极(石墨):
2Fe3+ + 2e-=3Fe2+
1、制作干电池、蓄电池、高能电池等。
2、比较金属活动性强弱。
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A: A >B > C > D B: A > C >B > D
C: A > C >D > B D: B > D >C >A
一般情况下:
负极金属的活动性大于正极金属
C
3、比较反应速率
下列制氢气的反应速率最快的是
C.粗锌和 1mol/L 硫酸;
A.纯锌和1mol/L 硫酸;
B.纯锌和18 mol/L 硫酸;
D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
形成原电池,可以加快反应速率
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(2)
(1)
(3)
4、比较金属腐蚀的快慢
四.常见的化学电源
●一次电池
●二次电池
●高能电池
●燃料电池
锌-锰干电池
四.常见的化学电源
Ⅰ.干电池(一次电池)
电极: Zn为负极,碳棒为正极
电解液:NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2,防止产生极化现象。
负极(Zn):Zn-2e-=Zn2+
正极(C):2NH4+ + 2e-=2NH3+H2
H2 + 2MnO2 = Mn2O3+H2O 去氢
4NH3 + Zn2+ = [Zn(NH3)4]2+ 去氨
电极方程式:
四.常见的化学电源
铅蓄电池
电极:Pb为负极;PbO2为正极.
电解液:30%的H2SO4溶液
电极反应式:
负极(Pb): Pb + SO42 -2e-=PbSO4
正极(PbO2):PbO2 + 4H+ +SO42- + 2e =PbSO4 +2H2O
总电池反应:PbO2 + Pb +2H2SO4=2PbSO4↓+ 2H2O
Ⅱ.铅蓄电池(二次电池)
(1.25~1.28g/cm-3)
电极: Zn为负极,Ag2O为正极
电解液: KOH溶液
电极反应式:
负极: Zn + 2OH- -2e- = Zn(OH)2
正极: Ag2O + H2O + 2e- =2Ag + 2OH-
总反应式: Zn + Ag2O + H2O = 2Ag + Zn(OH)2
拓展创新
银锌电池
Ⅲ.高能电池(银锌电池、锂电池)
电极: Pt制作的惰性电极
电解质溶液: KOH溶液
负极: 2H2 - 4e- + 4OH- =4H2O
正极: O2 + 2H2O + 4e- =4OH-
总反应:2H2+ O2=2H2O
氢氧燃料电池
若为酸性介质,试写出电极反应式?
思考:
负极:2H2 - 4e- = 4H+
正极: O2+ 4H+ + 4e- = 2H2O
Ⅳ.新型燃料电池
(氢氧燃料电池/甲烷电池/煤气电池/海水-空气电池)
甲烷-氧气燃料电池
该电池用金属铂片插入KOH溶液中作电极,又在两极
上分别通甲烷和氧气:
负极:CH4 + 10OH- - 8e- = CO32- + 7H2O
正极:2O2 + 4H2O + 8e- = 8OH-
电池总反应式为:CH4+2O2+2KOH =K2CO3+3H2O
Ⅳ.新型燃料电池
(氢氧燃料电池/甲烷电池/煤气电池/海水-空气电池)
铝-空气-海水电池
Ⅳ.新型燃料电池
(氢氧燃料电池/甲烷电池/ 煤气电池/铝-海水-空气电池)
1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产电流。
负极:4A1-12e- = 4A13+
正极:3O2+6H2O+12e- =12OH-
电池总反应式为:4A1+3O2+6H2O=4A1(OH)3
这种海水电池比“干电池”的能量高20~50倍。
综合训练
(1)a极是( )极,电极反应式是
(2)b极是( )极,电极反应式是
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其结构如右图所示。两个电极均由多孔碳制成,通入的气体在空隙中逸出, 并在电极表面放电。
负
2H2-4e- + 4OH- = 4H2O
正
O2 + 2H2O +4e- = 4OH-
回答:
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应式为:2H2+O2=2H2O,电解质溶液为KOH溶液,反应保持在一定温度下,使生成H2O蒸发,下列叙述正确的是( )
A、H2为正极,O2为负极
B、电极反应(正极):O2+2H2O+4e=4OH-
电极反应(负极):2H2+4OH- =4H2O+4e
C、负极发生氧化反应,正极发生还原反应。
D、工作中电解质溶液PH值不断增大。
B、C
(燃料电池)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液为盐酸时的电极反应式,并指出各电极和电解质溶液的PH值的变化,若电解质溶液为KOH时又如何?
1、电解质为盐酸时:
负极:2H2-4e- = 4H+ PH值变小
正极:O2+4H++4e-=2H2O PH值变大
溶液被稀释,PH值变大
2、电解质为KOH时:
负极:2H2-4e-+4OH-=4H2O PH值变小
正极:O2+2H2O+4e-=4OH- PH值变大
溶液被稀释,PH值变小
电子表和电子计算机的电源通常用微型银-锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液
总反应式:Ag2O + H2O + Zn = Zn(OH)2 + 2Ag
下列说法正确的是( )
A、Zn是正极 ,Ag2O是负极
B、 Ag2O是正极 , Zn是负极
C、工作时,电池负极区溶液PH减少
D、工作时,电子由Ag2O极经外电路流向Zn极
B 、C
银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e- = 2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A、锌为正极,Ag2O为负极
B、锌为负极,Ag2O为正极
C、原电池工作时,负极区PH减小
D、原电池工作时,负极区PH增大
B、C
—化学能与电能的转化
第1课时
化学能转化为电能
水电站
直接从自然界取得的能源称为一次能源
(如流水、风力、原煤、石油、天然气、天然铀矿)
电能是现代社会中应用最广泛、使用最方便、污染最小的一种二次能源,又称为电力。
一次能源经加工、转换得到的能源称为二次能源
如电力、蒸汽等
化学能 热能 机械能 电能
燃烧
蒸汽
发电机
一、化学能与电能的相互转化
1、火力发电
发电量首位
【思考与交流】
火
力
发
电
有
什
么
缺
点
1.煤炭是非可再生资源,会造成能源危机
2.煤炭燃烧会产生污染性气体
3.经多次转换,能量损耗大,燃料的
利用率低
化学能 电能
直接?
伏 特 和 伏 打 电 池
伏打电池的发明源于一个有趣的生物实验:在死去的青蛙腿上同时插入用导线连接着两种不同材料的电极,青蛙腿就像触电似的痉挛起来。
你知道其中的奥秘吗?
开 题
你听说过伏打电池吗?
【实验一】:将锌片、铜片插入稀硫酸,有何现象?
Cu
Zn
稀硫酸
锌片上有气泡产生,铜片上无现象
原理:
Zn + 2H+ = Zn2+ + H2↑
2e-
【实验二】锌片和铜片用导线连接后插入稀硫酸中
实验现象:
铜片上有气泡产生
Cu
Zn
稀硫酸
Zn-2e- = Zn2+
2H+ + 2e-=H2↑
产生气体的原因
Cu
Zn
稀硫酸
Zn2+
H+
H+
电流计
A
H2
-
-
电流方向
电子方向
2、组成:
①电极:活泼金属→发生氧化反应→向外线路提供电子→原电池的负极;
不活泼金属(或石墨)→发生还原反应→接受外线路提供的电子→原电池的正极。
②电解质溶液
③闭合回路
一、原电池
1、定义:把化学能转变为电能的装置.
Cu
Zn
稀硫酸
3、电极反应
2H++2e-=H2↑
负极:
Zn-2e-=Zn2+
正极:
氧化反应
还原反应
氧化还原反应
总反应:Zn + 2H+ = Zn2+ + H2↑(离子方程式)
失去电子
得到电子
Zn + H2SO4 = ZnSO4 + H2↑(化学方程式)
外电路——电子导电
电子从负极→正极
内电路——自由离子导电
阴离子移向负极
阳离子移向正极
4、原电池的闭合回路是怎样形成的?
Zn2+ H+
SO42-
e-
e-
Zn Cu
内电路
H2SO4
外电路
形成原电池的条件
(可以)
(可以)
(可以)
(不可以)
形成条件一:
活泼性不同的两个电极
负极:较活泼的金属
正极:较不活泼的金属、石墨等
【实验探究】
(可以)
(不可以)
形成条件二:电极需插进电解质溶液中
形成原电池的条件
【实验探究】
形成原电池的条件
形成条件三:必须形成闭合回路
(不可以)
【实验探究】
二、 原电池的构成条件:
① 一般有两种活动性不同的金属(或非金属导体)作电极。
② 电解质溶液(电极与电解质溶液接触)。
③ 两极相连形成闭合电路。
④有一个自发的氧化还原反应
【小结】
氧化反应
Zn-2e=Zn2+
铜锌原电池
电解质溶液
失e,沿导线传递,有电流产生
还原反应
2H++2e=H2↑
阴离子
阳离子
总反应:
负极
正极
2H++2e- =H2↑
Zn-2e-=Zn2+
Zn+2H+=Zn2++H2↑
Zn+H2SO4=ZnSO4+H2↑
(离子方程式)
(化学方程式)
电极反应
正极:
负极:
(氧化反应)
(还原反应)
小结:
【实验探究】:将铝片、石墨插入稀硫酸溶液中,是否可以形成原电池?
石墨
Al
稀硫酸
石墨
Al
稀硫酸
(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习1
Mg
Fe
稀硫酸
(1)说明反应的现象;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习2
Cu
Zn
硫酸铜
【实验探究】:将锌片、铜片插入硫酸铜溶液中,是否可以形成原电池?
Cu
Zn
硫酸铜
(1)说明两个电极质量的变化情况;
(2)判断正负极;
(3)写出电极反应式;
(4)写出总反应的离子方程式和化学方程式。
巩固练习3
三、判断原电池正、负极的方法
1、由组成原电池的两极材料判断:
负极:一般活泼的金属
正极:活泼性较弱的金属或能导电的非金属
2、根据电流方向或电子流动方向判断:
负极:电子流出、电流流入
正极:电子流入、电流流出
3、根据原电池两极发生的变化来判断:
负极:总是失电子发生氧化反应,
正极:总是得电子发生还原反应。
4、电极反应现象.
负极:不断溶解(变细),质量减少
正极:有气体产生,或质量增加(变粗)
1. 在如下图所示的8个装置中,属于原电池的有 .
④ ⑥ ⑦
e
课堂练习:
练习1、写出下列原电池的电极反应式和原电池总反应式。
负极(Fe): Fe - 2e- = Fe2+
正极(C): 2H+ + 2e- = H2↑
总反应式: Fe+ 2H+ = Fe2+ + H2↑
练习2、若把1中的稀H2SO4改为NaCl溶液,能否构成原电池,若能,请写出电极反应式和原电池总反应式。
负极(Fe) Fe - 2e- = Fe2+
正极(C) 2H2O + O2 + 4e- = 4OH-
总反应式: 2Fe+ 2H2O + O2 =2 Fe(OH)2
3讨论:
在下列(1)(2)两个装置中,Fe极分别是原电池的什么极?写出Fe极上发生反应的方程式。
Fe是负极
Fe-2e-=Fe2+
Fe是正极
2H++2e-=H2↑
(1) (2) (3)
比较Fe被腐蚀的快慢:
(1)>(3)>(2)
说明:Fe作原电池负极时,腐蚀加快,作正极时不被腐蚀。
四、金属的电化腐蚀
1、金属腐蚀
如钢铁的生锈、铜绿的形成等。
——金属或合金与周围接触到的气体或液体进行化学反应而腐蚀损耗的过程
2、金属腐蚀的本质
——金属原子失去电子而被氧化
3、金属腐蚀的类型
化学腐蚀
电化学腐蚀
(为主)
4、化学腐蚀
金属跟接触到的物质(O2、Cl2、SO2等)直接发生化学反应而引起的腐蚀
5、电化学腐蚀
不纯的金属跟电解质溶液接触时,发生原电池反应,较活泼的金属失去电子被氧化而腐蚀
钢铁的电化腐蚀
Fe和少量的C与表面的水膜形成无数的微小原电池
Fe(负极):2Fe-4e--=2Fe2+
C(正极):O2+4e-+2H2O=4OH-
溶液中: Fe2++2OH- =Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
铁锈(Fe2O3·H2O)
C
Fe
电解质溶液 O2
Fe2+
OH-
【思考】钢铁及其制品通常为含碳的铁合金,在干燥空
气里长时间不易生锈,但在潮湿的空气里却很
快就会生锈,为什么?
化学腐蚀和电化学腐蚀的比较
化学腐蚀
电化学腐蚀
反应条件
有无电流
反应本质
相互关系
金属跟氧化剂直接接触
不纯金属或合金跟电解质溶液接触
无
有
金属
被氧化的过程
较活泼的金属
被氧化的过程
化学腐蚀和电化学腐蚀往往同时发生
以下现象与电化腐蚀无关的是:
A、黄铜(铜锌合金)制作的铜锣不易产生铜绿
B、生铁比软铁芯(几乎是纯铁)容易生锈
C、铁质器件附有铜质配件,在接触处易生铁锈
D、银质奖牌久置后表面变暗
【讨论】
1)写出钢铁在酸性较强的水膜里发生腐蚀的电极反应
Fe(负极):Fe-2e-=Fe2+
C(正极):2H++2e-=H2↑
析氢腐蚀
2)写出马口铁(铁镀锡)、白铁皮(铁镀锌)镀层破
损后,发生电化腐蚀的电极反应式,并解释铁被腐
蚀快慢的原因。
马口铁
负极(Fe)
正极(Sn)
负极(Zn)
正极(Fe)
白铁皮
:2Zn-4e-=2Zn2+
:O2+4e-+2H2O=4OH-
:2Fe-4e-=2Fe2+
:O2+4e-+2H2O=4OH-
形成原电池,铁是负极,加速腐蚀。
形成原电池,锌作负极对铁(正极)起保护作用。
五、原电池的应用
(1)将反应:2FeCl3+Fe=3FeCl2设计成原电池。
(2)判断正负极并写出电极反应。
石墨
Fe
FeCl3溶液
负极(铁):
Fe-2e-=Fe2+
正极(石墨):
2Fe3+ + 2e-=3Fe2+
1、制作干电池、蓄电池、高能电池等。
2、比较金属活动性强弱。
下列叙述中,可以说明金属甲比乙活泼性强的是
C.将甲乙作电极组成原电池时甲是负极;
A.甲和乙用导线连接插入稀盐酸溶液中,乙溶解,甲上有H2气放出;
B.在氧化–还原反应中,甲比乙失去的电子多;
D.同价态的阳离子,甲比乙的氧化性强;
把A、B、C、D四块金属泡在稀H2SO4中,用导线两两相连可以组成各种原电池。若A、B相连时,A为负极;C、D相连,D上有气泡逸出;A、C相连时A极减轻;B、D相连,B为正极。则四种金属的活泼性顺序由大到小排列为( )
A: A >B > C > D B: A > C >B > D
C: A > C >D > B D: B > D >C >A
一般情况下:
负极金属的活动性大于正极金属
C
3、比较反应速率
下列制氢气的反应速率最快的是
C.粗锌和 1mol/L 硫酸;
A.纯锌和1mol/L 硫酸;
B.纯锌和18 mol/L 硫酸;
D.粗锌和1mol/L 硫酸的反应中加入几滴CuSO4溶液。
形成原电池,可以加快反应速率
下列各情况,在其中Fe片腐蚀由快到慢的顺序是
(2)
(1)
(3)
4、比较金属腐蚀的快慢
四.常见的化学电源
●一次电池
●二次电池
●高能电池
●燃料电池
锌-锰干电池
四.常见的化学电源
Ⅰ.干电池(一次电池)
电极: Zn为负极,碳棒为正极
电解液:NH4Cl、ZnCl2和淀粉糊
另有黑色的MnO2粉末,吸收正极产生的H2,防止产生极化现象。
负极(Zn):Zn-2e-=Zn2+
正极(C):2NH4+ + 2e-=2NH3+H2
H2 + 2MnO2 = Mn2O3+H2O 去氢
4NH3 + Zn2+ = [Zn(NH3)4]2+ 去氨
电极方程式:
四.常见的化学电源
铅蓄电池
电极:Pb为负极;PbO2为正极.
电解液:30%的H2SO4溶液
电极反应式:
负极(Pb): Pb + SO42 -2e-=PbSO4
正极(PbO2):PbO2 + 4H+ +SO42- + 2e =PbSO4 +2H2O
总电池反应:PbO2 + Pb +2H2SO4=2PbSO4↓+ 2H2O
Ⅱ.铅蓄电池(二次电池)
(1.25~1.28g/cm-3)
电极: Zn为负极,Ag2O为正极
电解液: KOH溶液
电极反应式:
负极: Zn + 2OH- -2e- = Zn(OH)2
正极: Ag2O + H2O + 2e- =2Ag + 2OH-
总反应式: Zn + Ag2O + H2O = 2Ag + Zn(OH)2
拓展创新
银锌电池
Ⅲ.高能电池(银锌电池、锂电池)
电极: Pt制作的惰性电极
电解质溶液: KOH溶液
负极: 2H2 - 4e- + 4OH- =4H2O
正极: O2 + 2H2O + 4e- =4OH-
总反应:2H2+ O2=2H2O
氢氧燃料电池
若为酸性介质,试写出电极反应式?
思考:
负极:2H2 - 4e- = 4H+
正极: O2+ 4H+ + 4e- = 2H2O
Ⅳ.新型燃料电池
(氢氧燃料电池/甲烷电池/煤气电池/海水-空气电池)
甲烷-氧气燃料电池
该电池用金属铂片插入KOH溶液中作电极,又在两极
上分别通甲烷和氧气:
负极:CH4 + 10OH- - 8e- = CO32- + 7H2O
正极:2O2 + 4H2O + 8e- = 8OH-
电池总反应式为:CH4+2O2+2KOH =K2CO3+3H2O
Ⅳ.新型燃料电池
(氢氧燃料电池/甲烷电池/煤气电池/海水-空气电池)
铝-空气-海水电池
Ⅳ.新型燃料电池
(氢氧燃料电池/甲烷电池/ 煤气电池/铝-海水-空气电池)
1991年,我国首创,用作海上标志灯。以海水为电解液,靠空气中的氧使铝不断氧化而产电流。
负极:4A1-12e- = 4A13+
正极:3O2+6H2O+12e- =12OH-
电池总反应式为:4A1+3O2+6H2O=4A1(OH)3
这种海水电池比“干电池”的能量高20~50倍。
综合训练
(1)a极是( )极,电极反应式是
(2)b极是( )极,电极反应式是
美国阿波罗宇宙飞船上使用的氢氧燃料电池是一种新型的化学电源,其结构如右图所示。两个电极均由多孔碳制成,通入的气体在空隙中逸出, 并在电极表面放电。
负
2H2-4e- + 4OH- = 4H2O
正
O2 + 2H2O +4e- = 4OH-
回答:
阿波罗宇宙飞船上使用的是氢氧燃料电池,其电池反应式为:2H2+O2=2H2O,电解质溶液为KOH溶液,反应保持在一定温度下,使生成H2O蒸发,下列叙述正确的是( )
A、H2为正极,O2为负极
B、电极反应(正极):O2+2H2O+4e=4OH-
电极反应(负极):2H2+4OH- =4H2O+4e
C、负极发生氧化反应,正极发生还原反应。
D、工作中电解质溶液PH值不断增大。
B、C
(燃料电池)宇宙飞船上的氢氧燃料电池,其电池反应为:2H2+O2=2H2O,试写出电解质溶液为盐酸时的电极反应式,并指出各电极和电解质溶液的PH值的变化,若电解质溶液为KOH时又如何?
1、电解质为盐酸时:
负极:2H2-4e- = 4H+ PH值变小
正极:O2+4H++4e-=2H2O PH值变大
溶液被稀释,PH值变大
2、电解质为KOH时:
负极:2H2-4e-+4OH-=4H2O PH值变小
正极:O2+2H2O+4e-=4OH- PH值变大
溶液被稀释,PH值变小
电子表和电子计算机的电源通常用微型银-锌电池,其电极分别是Ag2O和Zn,电解质溶液为KOH溶液
总反应式:Ag2O + H2O + Zn = Zn(OH)2 + 2Ag
下列说法正确的是( )
A、Zn是正极 ,Ag2O是负极
B、 Ag2O是正极 , Zn是负极
C、工作时,电池负极区溶液PH减少
D、工作时,电子由Ag2O极经外电路流向Zn极
B 、C
银锌电池(钮扣式电池)的两个电极分别是由氧化银与少量石墨组成的活性材料和锌汞合金构成,电解质为氢氧化钾溶液,电极反应为 Zn+2OH--2e-=ZnO+H2O;Ag2O+H2O+2e- = 2Ag+2OH- ;总反应为:Ag2O+Zn=2Ag+ZnO,下列判断正确的是( )
A、锌为正极,Ag2O为负极
B、锌为负极,Ag2O为正极
C、原电池工作时,负极区PH减小
D、原电池工作时,负极区PH增大
B、C
