7.2.1 重要的含氮化工原料氨气 课件2020-2021学年苏教版(2019)高一化学必修第二册(18张PPT)
文档属性
| 名称 | 7.2.1 重要的含氮化工原料氨气 课件2020-2021学年苏教版(2019)高一化学必修第二册(18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 518.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-25 21:56:09 | ||
图片预览





文档简介
第1课时
氨气
专题七 氮与社会可持续发展
—重要的含氮化工原料
[化学史实]
弗里茨·哈伯:德国化学家,1900年获得博士学位,1908年7月首次合成氨气,1918年因为在合成氨方面的巨大贡献而获得诺贝尔化学奖。
氨气的合成一方面使氮肥大量的工业化生产,提高了粮食的产量;另一方面氨气氧化制得硝酸及TNT炸药。由于以上原因,德国才能将第一次世界大战延续了几年。
哈伯首创了使用化学毒剂的化学战,在第一次世界大战中有130万人受到化学战的伤害,其中9万人死亡。
天使 or 恶魔
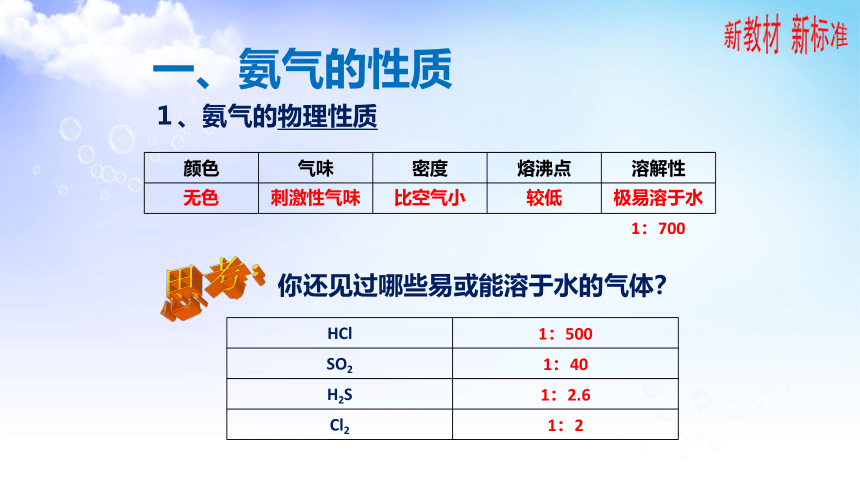
一、氨气的性质
1、氨气的物理性质
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}颜色
气味
密度
熔沸点
溶解性
无色
刺激性气味
比空气小
较低
极易溶于水
思考:
1:700
你还见过哪些易或能溶于水的气体?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}HCl
1:500
SO2
1:40
H2S
1:2.6
Cl2
1:2
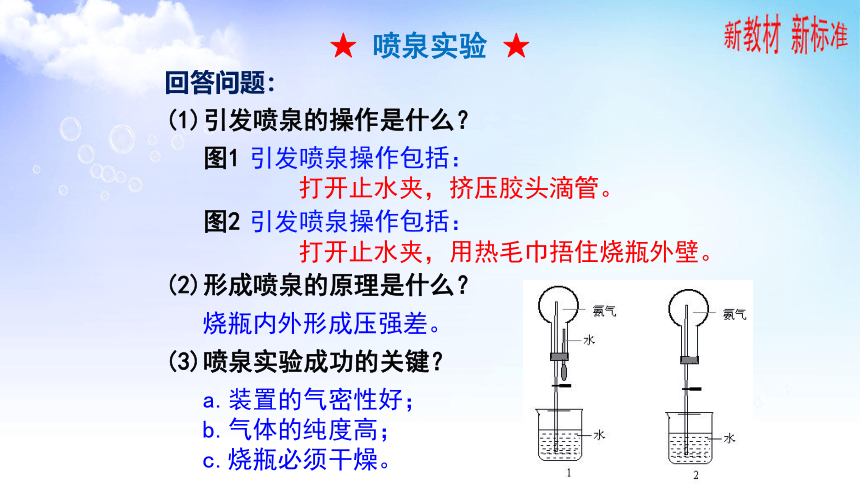
★ 喷泉实验 ★
观察实验并讨论问题:
(1)引发喷泉的操作是什么?
(3)喷泉实验成功的关键?
(2)形成喷泉的原理是什么?
实验现象:
a.烧杯内的水由玻璃管进
入烧瓶内形成喷泉;
b.烧瓶内溶液呈红色。
a.氨极易溶于水。
b.氨水显碱性。
实验结论:
(1)引发喷泉的操作是什么?
(3)喷泉实验成功的关键?
(2)形成喷泉的原理是什么?
回答问题:
图1 引发喷泉操作包括:
打开止水夹,挤压胶头滴管。
图2 引发喷泉操作包括:
打开止水夹,用热毛巾捂住烧瓶外壁。
烧瓶内外形成压强差。
a.装置的气密性好;
b.气体的纯度高;
c.烧瓶必须干燥。
★ 喷泉实验 ★
[课堂练习]
1、通过氨气的喷泉实验得到启发,哪些
溶液和气体之间也能形成喷泉?
水与SO2/HCl/NH3
NaOH溶液与Cl2/SO2/CO2
2、你能设计出一个蓝色的喷泉实验来吗?
水与NH3,烧杯里滴加石蕊试液。
思考:
氨水为什么会显碱性呢?
(1)与水反应:
NH3 + H2O ? NH3·H2O ? NH4+ + OH-
2、氨气的化学性质
(一水合氨)
氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。
NH3·H2O == NH3↑ + H2O
注:NH3·H2O 不稳定
NH3唯一的碱性气体
氨气:能使无色的酚酞溶液 ,
又能使湿润的红色的石蕊试纸 。
变蓝
变红
[课堂练习]
1、氨水中主要含有哪些微粒?
三分子:
NH3、
H2O、
NH3·H2O
三离子:
NH4+、OH-、微量H+
2、氨水与液氨有何区别?
液氨
氨水
物质种类
粒子种类
纯净物
混合物
NH3
(2)与酸反应
步骤:使两根分别蘸有浓氨水和浓盐酸的玻璃棒接近。
两根玻璃棒靠近时产生大量白烟。
现象:
(不要接触)
结论:(1)盐酸、氨水均具有挥发性,
(2)NH3、HCl不能共存。
NH3 + HCl == NH4Cl
[课堂练习]
浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?写出分别与硫酸和硝酸反应的化学方程式。
与浓硝酸:NH3 + HNO3 = NH4NO3 (产生白烟)
与浓硫酸:2NH3 + H2SO4 = (NH4)2SO4 (不产生白烟)
2.易挥发性酸 (HCl、HNO3等)遇氨气均有白烟生成;
难挥发性酸 (H2SO4、H3PO4)无此现象。
NH3 能不能用浓硫酸干燥?
不能
1.氨气与酸反应一般生成相应的铵盐。
NH3 + H+ = NH4+ (与酸反应的本质)
(3)与氧气反应 — 氨气的还原性
4NH3 + 5O2 == 4NO + 6H2O
催化剂
△
氨的催化氧化
4NH3 + 3O2 == 2N2 + 6H2O
点燃
3NH3·H2O + AlCl3 = Al(OH)3↓+ 3NH4Cl
(4)与某些盐反应 — 符合复分解反应的条件
NH3 + CO2 + NaCl + H2O == NaHCO3↓+ NH4Cl
2NH3 + 3Cl2 == N2 + 6HCl
8NH3 + 3Cl2 == N2 + 6NH4Cl
[知识拓展]
4NH3 + COCl2 == CO(NH2)2 + 2NH4Cl
2NH3 + 3CuO == 3Cu + 3H2O + N2
△
光气
3、氨气的用途
(a) 制冷剂
(b) 制氮肥
(c) 制硝酸
(d) 制纯碱
(e) 有机合成的工业原料
C
随堂演练
C
B
B
D
氨气
专题七 氮与社会可持续发展
—重要的含氮化工原料
[化学史实]
弗里茨·哈伯:德国化学家,1900年获得博士学位,1908年7月首次合成氨气,1918年因为在合成氨方面的巨大贡献而获得诺贝尔化学奖。
氨气的合成一方面使氮肥大量的工业化生产,提高了粮食的产量;另一方面氨气氧化制得硝酸及TNT炸药。由于以上原因,德国才能将第一次世界大战延续了几年。
哈伯首创了使用化学毒剂的化学战,在第一次世界大战中有130万人受到化学战的伤害,其中9万人死亡。
天使 or 恶魔
一、氨气的性质
1、氨气的物理性质
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}颜色
气味
密度
熔沸点
溶解性
无色
刺激性气味
比空气小
较低
极易溶于水
思考:
1:700
你还见过哪些易或能溶于水的气体?
{5C22544A-7EE6-4342-B048-85BDC9FD1C3A}HCl
1:500
SO2
1:40
H2S
1:2.6
Cl2
1:2
★ 喷泉实验 ★
观察实验并讨论问题:
(1)引发喷泉的操作是什么?
(3)喷泉实验成功的关键?
(2)形成喷泉的原理是什么?
实验现象:
a.烧杯内的水由玻璃管进
入烧瓶内形成喷泉;
b.烧瓶内溶液呈红色。
a.氨极易溶于水。
b.氨水显碱性。
实验结论:
(1)引发喷泉的操作是什么?
(3)喷泉实验成功的关键?
(2)形成喷泉的原理是什么?
回答问题:
图1 引发喷泉操作包括:
打开止水夹,挤压胶头滴管。
图2 引发喷泉操作包括:
打开止水夹,用热毛巾捂住烧瓶外壁。
烧瓶内外形成压强差。
a.装置的气密性好;
b.气体的纯度高;
c.烧瓶必须干燥。
★ 喷泉实验 ★
[课堂练习]
1、通过氨气的喷泉实验得到启发,哪些
溶液和气体之间也能形成喷泉?
水与SO2/HCl/NH3
NaOH溶液与Cl2/SO2/CO2
2、你能设计出一个蓝色的喷泉实验来吗?
水与NH3,烧杯里滴加石蕊试液。
思考:
氨水为什么会显碱性呢?
(1)与水反应:
NH3 + H2O ? NH3·H2O ? NH4+ + OH-
2、氨气的化学性质
(一水合氨)
氨水中含少量氢氧根离子,呈弱碱性,故能使酚酞试液变红。
NH3·H2O == NH3↑ + H2O
注:NH3·H2O 不稳定
NH3唯一的碱性气体
氨气:能使无色的酚酞溶液 ,
又能使湿润的红色的石蕊试纸 。
变蓝
变红
[课堂练习]
1、氨水中主要含有哪些微粒?
三分子:
NH3、
H2O、
NH3·H2O
三离子:
NH4+、OH-、微量H+
2、氨水与液氨有何区别?
液氨
氨水
物质种类
粒子种类
纯净物
混合物
NH3
(2)与酸反应
步骤:使两根分别蘸有浓氨水和浓盐酸的玻璃棒接近。
两根玻璃棒靠近时产生大量白烟。
现象:
(不要接触)
结论:(1)盐酸、氨水均具有挥发性,
(2)NH3、HCl不能共存。
NH3 + HCl == NH4Cl
[课堂练习]
浓氨水遇浓硫酸、浓硝酸也都会产生白烟吗?写出分别与硫酸和硝酸反应的化学方程式。
与浓硝酸:NH3 + HNO3 = NH4NO3 (产生白烟)
与浓硫酸:2NH3 + H2SO4 = (NH4)2SO4 (不产生白烟)
2.易挥发性酸 (HCl、HNO3等)遇氨气均有白烟生成;
难挥发性酸 (H2SO4、H3PO4)无此现象。
NH3 能不能用浓硫酸干燥?
不能
1.氨气与酸反应一般生成相应的铵盐。
NH3 + H+ = NH4+ (与酸反应的本质)
(3)与氧气反应 — 氨气的还原性
4NH3 + 5O2 == 4NO + 6H2O
催化剂
△
氨的催化氧化
4NH3 + 3O2 == 2N2 + 6H2O
点燃
3NH3·H2O + AlCl3 = Al(OH)3↓+ 3NH4Cl
(4)与某些盐反应 — 符合复分解反应的条件
NH3 + CO2 + NaCl + H2O == NaHCO3↓+ NH4Cl
2NH3 + 3Cl2 == N2 + 6HCl
8NH3 + 3Cl2 == N2 + 6NH4Cl
[知识拓展]
4NH3 + COCl2 == CO(NH2)2 + 2NH4Cl
2NH3 + 3CuO == 3Cu + 3H2O + N2
△
光气
3、氨气的用途
(a) 制冷剂
(b) 制氮肥
(c) 制硝酸
(d) 制纯碱
(e) 有机合成的工业原料
C
随堂演练
C
B
B
D
