7.2.2 重要的含氮化工原料 课件2020-2021学年苏教版(2019)高一化学必修第二册(23张ppt)
文档属性
| 名称 | 7.2.2 重要的含氮化工原料 课件2020-2021学年苏教版(2019)高一化学必修第二册(23张ppt) |
|
|
| 格式 | pptx | ||
| 文件大小 | 491.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-25 22:14:00 | ||
图片预览








文档简介
第2课时
硝酸
专题七 氮与社会可持续发展
—重要的含氮化工原料
[新闻现场]
某路段铝罐车发生硝酸泄露事故,造成大量红棕色烟雾,现场可以闻到刺鼻的气味。抢险人员运来纯碱进行处理,以便防止其扩散并污染附近的农田。
1、为什么在事故现场能闻到刺鼻的气味?
2、为什么可以用纯碱进行事故的处理?
一、硝酸的性质
1、硝酸的物理性质
① 纯硝酸是一种 色、易 ,有 气味
的液体。
挥发
刺激性
无
② 硝酸能与水任意比例互溶。
③ 纯硝酸的沸点是83℃,密度为1.42g/cm3。
④ 常用浓硝酸的质量分数为69%;质量分数为98%
以上的硝酸为“发烟硝酸”。
(1)不稳定性
2、硝酸的化学性质
思考:
为什么久置的浓硝酸呈黄色?
4HNO3 O2↑ + 2H2O + 4NO2↑
光照
硝酸应该使用棕色细口试剂瓶避光、低温保存,并且不能用橡皮塞。
常见的需要放在棕色瓶中的试剂有哪些?
浓HNO3、AgNO3、氯水、溴水等。
HNO3
(2)酸的通性 ( HNO3 = H+ + NO3- )
与指示剂作用
与碱反应
与金属氧化物反应
与某些盐反应
与金属反应
2HNO3+CuO=Cu(NO3)2+H2O
HNO3+NaOH=NaNO3+H2O
2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O
Cu+4HNO3(浓)= Cu(NO3)2+2NO2 ↑+2H2O
稀硝酸与石蕊试液变红,加热不褪色,
浓硝酸与石蕊试液变红,加热褪色。
思考:
为什么可以使用铁器盛放浓硫酸或浓硝酸?
要点一:HNO3不管浓稀都具有强氧化性,
且氧化性 浓HNO3 > 稀HNO3
(3)强氧化性
要点二:HNO3的强氧化性的具体体现:
① 与金属反应
② 与非金属反应
③ 与还原性的化合物反应
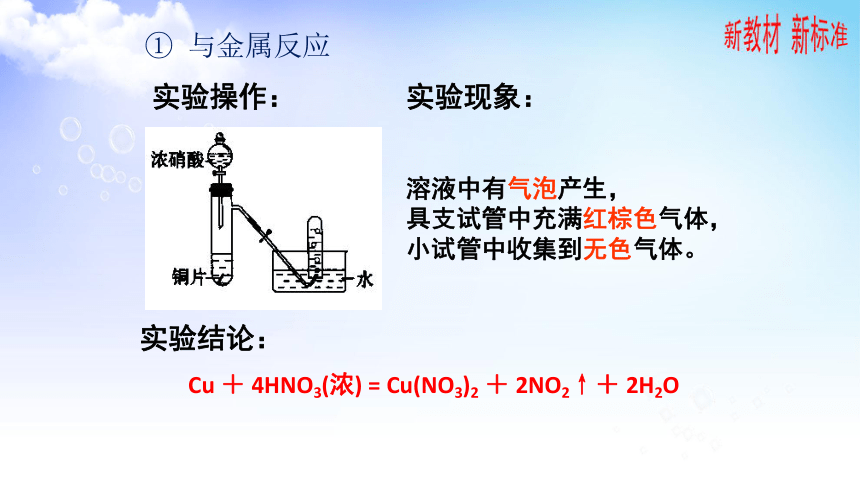
实验现象:
实验结论:
实验操作:
溶液中有气泡产生,
具支试管中充满红棕色气体,小试管中收集到无色气体。
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O
① 与金属反应
实验现象:
实验结论:
实验操作:
溶液中有气泡产生,
具支试管、小试管中气体均为无色。
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
① 与金属反应
a. 和几乎所有金属反应(除金、铂等少数金属外)
b. 与任何金属反应均不生成H2,说明呈现氧化性的不是H+而是HNO3,但由于H+的量决定HNO3的量,所以硝酸发生化学反应时要特别关注H+的浓度。
c. 与金属反应既体现氧化性,又体现酸性。
d. 铁、铝遇冷浓硝酸发生钝化,原因是在铁、铝表面氧化生成一层致密的氧化膜,阻止反应进一步发生。
[归纳总结]
e. Cu等较不活泼的金属与浓硝酸反应得到NO2,与稀硝酸反应得NO。
[归纳总结]
f. Mg、Zn、Fe等较活泼的金属与稀硝酸反应根据稀HNO3的浓度不同可得到NO、N2O、 N2、NH4NO3等不同产物。
g. 硝酸与变价金属(如Fe)反应,根据硝酸的量的多少分别得到低价、高价或两种价态共存的混合物。
② 与非金属反应
B
C
P
S
I2
+ HNO3(浓)
H3BO3
CO2
H3PO4
H2SO4
HIO3
+ NO2
③ 与还原性的化合物反应
如含 S2-、SO32-、Fe2+、I- 等的化合物反应。
3FeO+10HNO3(稀) = 3Fe(NO3)3+NO↑+5H2O
3H2S+2HNO3(稀) = 3S↓+2NO↑+4H2O
(4)与有机物反应
硝化反应:
酯化反应:
△
+ HNO3
浓硫酸
与含有苯环结构的蛋白质作用,呈黄色。
CH3CH2ONO2 + H2O
-NO2 + H2O
颜色反应:
CH3CH2OH+HNO3
浓硫酸
△
HO-NO2
CH3CH2O-H
-H HO-NO2
硝基苯
硝酸乙酯
硝酸乙酯、硝化甘油、硝化纤维
硝基苯、三硝基甲苯
[化学史实]
玻尔是丹麦的物理学家。第二次世界大战
期间,德军即将占领丹麦,玻尔被迫离开自己
的祖国。他坚信以后一定能返回祖国,决定把
心爱的诺贝尔奖章留下。为了不使奖章落入德
军手中,他把奖章溶解在一种溶液中。
战后,玻尔从溶液中提取出金,然后又重新铸成了奖章。玻尔是用什么溶液使金质奖章溶解的呢?
这种溶液就是王水。王水的氧化性比硝酸还强,可以使金、铂溶解。这位伟大的科学家不仅用他的知识和智慧保住奖章,还用他那蔑视敌人、热爱祖国的精神,鼓舞着后人。
(1)重要的化工原料:
制炸药、染料、塑料、硝酸盐等。
(2)重要的化学试剂:
溶解难溶物、合成物质等。
(3)制作王水(浓硝酸和浓盐酸体积比为1∶3)。
3、硝酸的用途
二、硝酸与金属反应的计算
A
B
★ 工业制取硝酸的流程 ★
N2
NH3
NO
NO2
HNO3
H2
H2O
O2
O2
N2 + 3H2 2NH3
高温、高压
催化剂
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
4NH3 + 5O2 4NO + 6H2O
催化剂
△
合成塔
氧化炉
吸收塔
随堂演练
1.
C
D
2.
B
随堂演练
3. 不同浓度的硝酸分别与足量的锌完全反应,还原产物分别是NO2、NO和NH4NO3 ,若这些产物的物质的量相等,则参加反应的HNO3 的物质的量之比是 ( )
A.2: 4: 5 B.1: 2: 5
C.1: 2: 2 D.1: 1: 1
B
4.
[思维拓展]
铁在热的稀硝酸中反应其主要还原产物为N2O,而在冷的稀硝酸中反应其主要产物为NO,当溶液更稀时,还原产物是NH4+,请分析下图回答有关问题:
c (H+)
a
a
b
c
d
b
c
d
n (Fe)
V气体线
(标况)
o
1、假设在任意气体产生的曲线段内只有一种还原
产物,判断从o点到a点时还原产物应为( )。
NO
2、判断从a点到b点时还原产物为( )。
其原因是 。
反应放热 温度升高
N2O
3、试配平由b到c点的化学方程式。
Fe + HNO3 ==== Fe(NO3)3 + + H2O
4、已知到达d点时,反应完全结束,此时溶液中主
要的阳离子为( )且分析c、d点投入金
属铁的物质的量之比n cFe : n dFe = ( : )
8
8
30
3
9
NH4NO3
Fe2+ NH4+
2 3
[思维拓展]
硝酸
专题七 氮与社会可持续发展
—重要的含氮化工原料
[新闻现场]
某路段铝罐车发生硝酸泄露事故,造成大量红棕色烟雾,现场可以闻到刺鼻的气味。抢险人员运来纯碱进行处理,以便防止其扩散并污染附近的农田。
1、为什么在事故现场能闻到刺鼻的气味?
2、为什么可以用纯碱进行事故的处理?
一、硝酸的性质
1、硝酸的物理性质
① 纯硝酸是一种 色、易 ,有 气味
的液体。
挥发
刺激性
无
② 硝酸能与水任意比例互溶。
③ 纯硝酸的沸点是83℃,密度为1.42g/cm3。
④ 常用浓硝酸的质量分数为69%;质量分数为98%
以上的硝酸为“发烟硝酸”。
(1)不稳定性
2、硝酸的化学性质
思考:
为什么久置的浓硝酸呈黄色?
4HNO3 O2↑ + 2H2O + 4NO2↑
光照
硝酸应该使用棕色细口试剂瓶避光、低温保存,并且不能用橡皮塞。
常见的需要放在棕色瓶中的试剂有哪些?
浓HNO3、AgNO3、氯水、溴水等。
HNO3
(2)酸的通性 ( HNO3 = H+ + NO3- )
与指示剂作用
与碱反应
与金属氧化物反应
与某些盐反应
与金属反应
2HNO3+CuO=Cu(NO3)2+H2O
HNO3+NaOH=NaNO3+H2O
2HNO3+CaCO3=Ca(NO3)2+CO2↑+H2O
Cu+4HNO3(浓)= Cu(NO3)2+2NO2 ↑+2H2O
稀硝酸与石蕊试液变红,加热不褪色,
浓硝酸与石蕊试液变红,加热褪色。
思考:
为什么可以使用铁器盛放浓硫酸或浓硝酸?
要点一:HNO3不管浓稀都具有强氧化性,
且氧化性 浓HNO3 > 稀HNO3
(3)强氧化性
要点二:HNO3的强氧化性的具体体现:
① 与金属反应
② 与非金属反应
③ 与还原性的化合物反应
实验现象:
实验结论:
实验操作:
溶液中有气泡产生,
具支试管中充满红棕色气体,小试管中收集到无色气体。
Cu + 4HNO3(浓) = Cu(NO3)2 + 2NO2↑+ 2H2O
① 与金属反应
实验现象:
实验结论:
实验操作:
溶液中有气泡产生,
具支试管、小试管中气体均为无色。
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO↑+ 4H2O
① 与金属反应
a. 和几乎所有金属反应(除金、铂等少数金属外)
b. 与任何金属反应均不生成H2,说明呈现氧化性的不是H+而是HNO3,但由于H+的量决定HNO3的量,所以硝酸发生化学反应时要特别关注H+的浓度。
c. 与金属反应既体现氧化性,又体现酸性。
d. 铁、铝遇冷浓硝酸发生钝化,原因是在铁、铝表面氧化生成一层致密的氧化膜,阻止反应进一步发生。
[归纳总结]
e. Cu等较不活泼的金属与浓硝酸反应得到NO2,与稀硝酸反应得NO。
[归纳总结]
f. Mg、Zn、Fe等较活泼的金属与稀硝酸反应根据稀HNO3的浓度不同可得到NO、N2O、 N2、NH4NO3等不同产物。
g. 硝酸与变价金属(如Fe)反应,根据硝酸的量的多少分别得到低价、高价或两种价态共存的混合物。
② 与非金属反应
B
C
P
S
I2
+ HNO3(浓)
H3BO3
CO2
H3PO4
H2SO4
HIO3
+ NO2
③ 与还原性的化合物反应
如含 S2-、SO32-、Fe2+、I- 等的化合物反应。
3FeO+10HNO3(稀) = 3Fe(NO3)3+NO↑+5H2O
3H2S+2HNO3(稀) = 3S↓+2NO↑+4H2O
(4)与有机物反应
硝化反应:
酯化反应:
△
+ HNO3
浓硫酸
与含有苯环结构的蛋白质作用,呈黄色。
CH3CH2ONO2 + H2O
-NO2 + H2O
颜色反应:
CH3CH2OH+HNO3
浓硫酸
△
HO-NO2
CH3CH2O-H
-H HO-NO2
硝基苯
硝酸乙酯
硝酸乙酯、硝化甘油、硝化纤维
硝基苯、三硝基甲苯
[化学史实]
玻尔是丹麦的物理学家。第二次世界大战
期间,德军即将占领丹麦,玻尔被迫离开自己
的祖国。他坚信以后一定能返回祖国,决定把
心爱的诺贝尔奖章留下。为了不使奖章落入德
军手中,他把奖章溶解在一种溶液中。
战后,玻尔从溶液中提取出金,然后又重新铸成了奖章。玻尔是用什么溶液使金质奖章溶解的呢?
这种溶液就是王水。王水的氧化性比硝酸还强,可以使金、铂溶解。这位伟大的科学家不仅用他的知识和智慧保住奖章,还用他那蔑视敌人、热爱祖国的精神,鼓舞着后人。
(1)重要的化工原料:
制炸药、染料、塑料、硝酸盐等。
(2)重要的化学试剂:
溶解难溶物、合成物质等。
(3)制作王水(浓硝酸和浓盐酸体积比为1∶3)。
3、硝酸的用途
二、硝酸与金属反应的计算
A
B
★ 工业制取硝酸的流程 ★
N2
NH3
NO
NO2
HNO3
H2
H2O
O2
O2
N2 + 3H2 2NH3
高温、高压
催化剂
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
4NH3 + 5O2 4NO + 6H2O
催化剂
△
合成塔
氧化炉
吸收塔
随堂演练
1.
C
D
2.
B
随堂演练
3. 不同浓度的硝酸分别与足量的锌完全反应,还原产物分别是NO2、NO和NH4NO3 ,若这些产物的物质的量相等,则参加反应的HNO3 的物质的量之比是 ( )
A.2: 4: 5 B.1: 2: 5
C.1: 2: 2 D.1: 1: 1
B
4.
[思维拓展]
铁在热的稀硝酸中反应其主要还原产物为N2O,而在冷的稀硝酸中反应其主要产物为NO,当溶液更稀时,还原产物是NH4+,请分析下图回答有关问题:
c (H+)
a
a
b
c
d
b
c
d
n (Fe)
V气体线
(标况)
o
1、假设在任意气体产生的曲线段内只有一种还原
产物,判断从o点到a点时还原产物应为( )。
NO
2、判断从a点到b点时还原产物为( )。
其原因是 。
反应放热 温度升高
N2O
3、试配平由b到c点的化学方程式。
Fe + HNO3 ==== Fe(NO3)3 + + H2O
4、已知到达d点时,反应完全结束,此时溶液中主
要的阳离子为( )且分析c、d点投入金
属铁的物质的量之比n cFe : n dFe = ( : )
8
8
30
3
9
NH4NO3
Fe2+ NH4+
2 3
[思维拓展]
