8.2.4 糖类蛋白质和氨基酸 课件 2020.2021学年苏教版(2019)高一化学必修第二册(62张PPT)
文档属性
| 名称 | 8.2.4 糖类蛋白质和氨基酸 课件 2020.2021学年苏教版(2019)高一化学必修第二册(62张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 9.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-25 22:14:24 | ||
图片预览









文档简介
第4课时
糖类蛋白质和氨基酸
专题八 有机化合物的获得与应用
—食品中的有机化合物
糖
一、糖类的组成和分类
(一)糖类的组成
由C、H、O三种元素组成的一类有机化合物。
通式为Cn(H2O)m ,也称碳水化合物。
注意:
1. 糖类通式只说明糖类由C、H、O三种元素组成,
并不反映糖类的结构。
2. 属于糖类不一定符合通式,(如鼠李糖:C6H12O5)
符合通式不一定属于糖类。(如 HCHO、CH3COOH)
糖类
碳水化合物
甜味物质
糖类
强调:
1. 糖的定义:
多羟基醛或多羟基酮,和它们的脱水缩合物。
(二)糖类的定义
单糖
低聚糖
多糖
糖
(不能水解的糖)
(1mol糖水解后能产生2~10 mol单糖)
(1mol糖水解后能产生很多摩尔单糖)
(能否水解以及水解产物的多少)
淀粉、纤维素
蔗糖、麦芽糖、乳糖
葡萄糖、果糖、核糖、脱氧核糖
2. 糖的分类:
天然高分子化合物
二、葡萄糖与果糖 (单糖)
(一)葡萄糖
1. 存在
2. 物理性质
葡萄及其它带有甜味的水果、蜂蜜中,
植物的种子、叶、根、花中,
动物的血液、脑脊液和淋巴液中。
色 体,熔点为 ,
有 味,但甜度不如蔗糖, 溶于水。
无
晶
146℃
甜
易
无色晶体
易溶于水
有甜味
葡萄糖
C C C C C C
O
H
OH OH OH OH OH
H
H H H H H
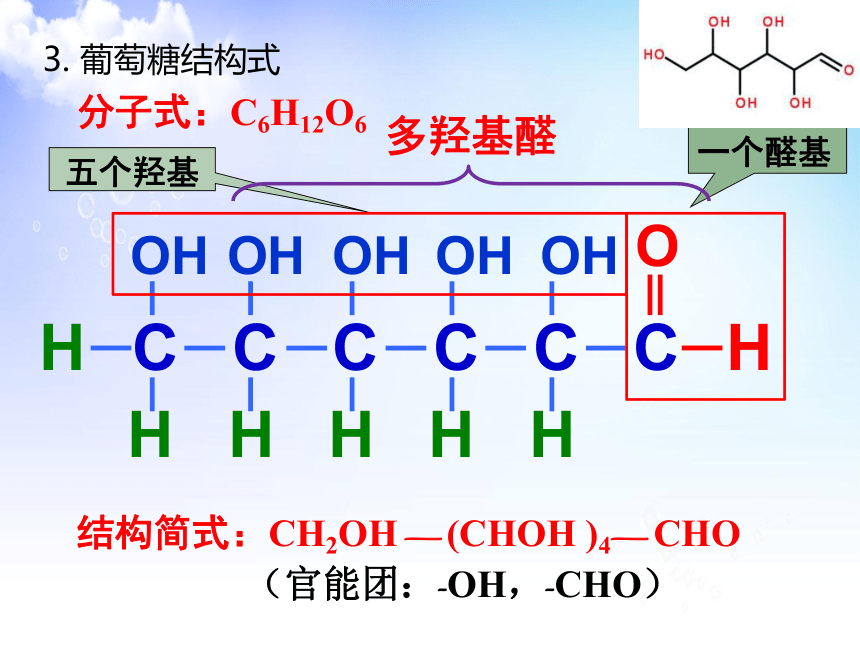
3. 葡萄糖结构式
多羟基醛
一个醛基
五个羟基
结构简式:CH2OH — (CHOH )4— CHO
分子式:C6H12O6
(官能团:-OH,-CHO)
4. 葡萄糖的化学性质 ★
(1)醛基的性质
① 氧化成酸
CH2OH (CHOH)4 CHO
(葡萄糖酸钠)
2
3
CH 2OH(CHOH)4COONH4 + Ag + H2O + NH3
CH2OH(CHOH)4CHO + [Ag(NH3)2]OH
水浴加热
CH2OH(CHOH)4CHO + Cu(OH)2 + NaOH
加热
CH2OH(CHOH)4COONa + Cu2O↓ + H2O
3
2
2
现象:
a、新制银镜反应
b、新制Cu(OH)2反应
不加热
加热
绛蓝色
砖红色沉淀
分子中有多个羟基
分子中有醛基
工业制镜
医学上检验尿糖
② 还原成醇
CH2OH(CHOH)4CHO + H2
催化剂
加热
己六醇
CH2OH(CHOH)4CH2OH
4. 葡萄糖的化学性质 ★
(2)羟基的性质
酯化反应
五乙酸葡萄糖酯
+
CHO
(CHOOCCH3)4
CH2OOCCH3
H2O
+
CH3COOH
CHO
(CHOH)4
CH2OH
5
5
浓H2SO4
△
CH2OH (CHOH)4 CHO
(3)在体内生理氧化反应
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
C6H12O6 2CH3CH2OH + 2CO2
酒曲酶
(4)发酵生成酒精
— 人体能量的主要来源
△H = - 2804 kJ·mol-1
4. 葡萄糖的化学性质 ★
葡萄糖的化学性质归纳
1. 氧化反应
a、燃烧
b、与新制Ag(NH3)2OH反应
c、与新制Cu(OH)2反应
d、生理氧化
2. 加成反应 ——与H2加成
3. 与酸发生酯化反应
4. 与活泼金属反应
5. 发酵成醇
可用于检验醛基
1. 营养物质
3. 制药工业
4. 制酒工业
5. 葡萄糖的用途
2. 制镜工业
分子式:C6H12O6
葡萄糖与果糖互为同分异构体。
二、葡萄糖与果糖 (单糖)
(二)果糖
与H2加成、酯化反应。
化学性质:
官能团:
羟基:-OH
羰基
结构简式:
CH2—CH—CH—CH—C—CH2OH
OH OH OH OH O
多羟基酮
(最甜的天然糖)
还原性糖
物质
性质
葡萄糖
果糖
存在
颜色状态
熔点
味道
溶解性
分子式
结构简式
水果、蜂蜜、人和动物体内
水果、蜂蜜中
无色晶体
无色晶体,不易结晶
通常为黏稠液体
146℃
103℃ - 105℃
有甜味
最甜的糖
易溶于水,稍溶于乙醇,
不溶于乙醚
易溶于水、乙醇、乙醚
C6H12O6
C6H12O6
1. 在一定的条件下,既可以发生氧化反应
又可以发生还原反应,还可以和酸发生
酯化反应的是 ( )
A. 乙醇 B. 乙醛
C. 乙酸 D. 葡萄糖
D
[知识巩固]
2. 下列关于糖的说法正确的是 ( )
A. 糖类中除含有C、H、O三种元素外,还
可能含有其他元素
B. 葡萄糖是多羟基醛
C. 能发生银镜反应的物质一定属于醛类
D. 糖类可划分为单糖、低聚糖、多糖三类
BD
能发生银镜反应的物质:
所有醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖。
3. 下列关于葡萄糖的说法中,错误的是( )
A. 葡萄糖的分子式是C6H12O6
B. 葡萄糖是碳水化合物,因为它的分子是
由6个C原子和6个H2O分子组成的
C. 葡萄糖是一种多羟基醛,因而具有醛和
多元醇的性质
D. 葡萄糖是单糖
B
4. 葡萄糖是单糖的原因是 ( )
A. 在糖类中含碳原子数最少??
B. 不能水解成为更简单的糖
C. 结构最简单????????????????
D. 分子中只有一个醛基
B
5. 下列有机物既能在常温下溶于水,又能
发生银镜反应的是 ( )
A. 甲醇??? B. 甲酸乙酯?
C. 葡萄糖? D. 苯酚
C
蔗糖
稀硫酸
C6H12O6 + C6H12O6
(葡萄糖) (果糖)
C12H22O11 + H2O
(蔗糖)
C12H22O11 + H2O 2 C6H12O6
(麦芽糖) (葡萄糖)
酸或酶
分子式都为 C12H22O11
麦芽糖
二
糖
同分异构体
还原糖?
三、蔗糖与麦芽糖 (二糖)
对比实验:
银氨溶液
银氨溶液
热水浴
热水浴
无现象
产生
银镜
热水浴
热水浴
20%蔗糖
溶液
20%麦芽糖溶液
无还原性
有还原性
蔗糖
麦芽糖
化学性质
同分异构体
② 水解反应
(蔗糖)
C6H12O6 + C6H12O6
C12H22O11 + H2O
稀硫酸
① 蔗糖不能发生银镜反应,也不和新制氢氧化铜反应
(葡萄糖) (果糖)
① 还原性: 能发生银镜反应(分子中含有醛基), 还原性糖
② 水解反应: 产物为葡萄糖一种
C12H22O11 + H2O 2 C6H12O6
(麦芽糖) (葡萄糖)
酸或酶
(一)蔗糖
(二)麦芽糖
(还原性糖)
(非还原性糖)
三、蔗糖与麦芽糖 (二糖)
注意
1、蔗糖、麦芽糖水解反应:
2、水解产物中醛基的验证:
加入NaOH目的:
中和硫酸,使溶液显碱性,
以防银氨溶液或新制Cu(OH)2失效。
稀硫酸做催化剂
水解反应后先加入NaOH溶液,
再加入银氨溶液或新制Cu(OH)2。
四、淀粉与纤维素 (多糖)
(C6H10O5)n
淀粉、纤维素的结构比较
(1) 淀粉、纤维素的分子式为:
(2) 但是葡萄糖分子间的结合方式不同,
其中含有的单糖单元(C6H10O5)的数值n,
取值各不相同,只有大致的范围。
(C6H10O5)n
都是由多个葡萄糖脱水形成的。
不是同分异构体关系,因为它们的n值不同
都是混合物
小结:高分子化合物都为混合物,都没有固定的熔沸点
天然高分子化合物
遇碘变蓝色
水解最终生成葡萄糖
(C6H10O5)n + nH2O nC6H12O6
淀粉 葡萄糖
酶或酸
2.化学性质
无色无味粉末状物质,不溶于冷水······
1.物理性质
(无还原性)
C6H12O6 2C2H5OH + 2CO2
酒化酶
应用: 酿酒
在热水中产生糊化作用
(一)淀粉
淀粉溶液
稀H2SO4
△
水解液
银镜
NaOH溶液
银氨溶液
△
淀粉溶液
稀H2SO4
△
水解液
碘水
溶液变蓝
(2)证明淀粉未完全水解:
(1)证明淀粉已经开始水解:
(3)证明淀粉部分水解:
(1)+(2)
【探究】设计实验方案进行淀粉水解及水解程度的检验?
淀粉液
硫酸
加热
水解液
碘水
现象A
NaOH
溶液
中和液
银氨溶液
水浴加热
现象B
现象
结论
现象A
现象B
溶液变蓝
无银镜生成
淀粉没有水解
溶液变蓝
有银镜生成
淀粉部分水解
溶液无现象
有银镜生成
淀粉完全水解
(一)淀粉
3. 淀粉的用途
(1)在体内被酶水解成葡萄糖供给人体利用;
(2)重要的食品工业原料,可用于制葡萄糖、酿醋、
酿酒,也是药片中的赋形剂(辅料)。
C6H12O6 2 C2H5OH + 2 CO2
催化剂
(C6H10O5)n + n H2O n C6H12O6
淀粉 葡萄糖
酸或酶
淀粉酿酒过程:
淀粉在淀粉酶作用下,先转化为麦芽糖,再转化为
葡萄糖,在酒化酶的作用下,转化为乙醇:
(一)淀粉
纤维素是绿色植物通过 生成的,在植物
中构成 网络,是植物体的支撑物质。
光合作用
细胞壁
棉花
竹子
(二)纤维素
1. 纤维素的物理性质
① 是___色___味的具有_____状结构的物质;
② 一般___溶于水和有机溶剂;但在一定条件
下,某些酸、碱和盐的水溶液可是纤维素
或 。
白
无
纤维
不
溶胀
溶解
2. 纤维素的化学性质
(1)不显还原性
(2)可发生水解,但比淀粉水解_____。
困难
(C6H10O5)n + n H2O n C6H12O6
强酸或酶
△
纤维素
葡萄糖
(3)酯化反应
[C6H7O2(OH)3]n
如:与硝酸反应,生成纤维素硝酸酯
与醋酸反应,生成纤维素乙酸酯
俗名:硝酸纤维
俗名:醋酸纤维
(1). 制造纤维素硝酸酯(硝酸纤维)。
根据含N 量分为火棉(含N量较高,用于制造无烟火药)、胶棉(含N量较低,用于制赛璐珞和喷漆)
(2). 制造纤维素乙酸酯(醋酸纤维)。
不易着火,用于制胶片
(3). 制造黏胶纤维(NaOH、CS2处理后所得,其中的长纤维称人造丝,短纤维称人造棉)
3.纤维素的用途(6个方面)
纯棉上衣
麻布
法国棉麻
(4). 棉麻纤维大量用于纺织工业
(5). 木材、稻草、麦秸、蔗渣等用于造纸
(6). 食物中的纤维素有利于人的消化。
淀粉
纤维素
通 式
结 构
相对分子量
相互关系
物理性质
小结:淀粉、纤维素的结构和物理性质比较
(C6H10O5)n (C6H10O5)n
n值由几百到几千 几千个葡萄糖单元
葡萄糖单元
白色无气味无味道 白色无气味无味道
不溶于冷水,热水糊化 不溶于水也不溶于
一般有机溶剂
十几万→几十万 几十万→几百万
1 、不是同分异构体 2、不是同系物
3、均属天然高分子化合物
淀粉、纤维素的化学性质比较
结构特征
化学性质
用途
淀
粉
纤
维
素
无醛基
每个单元中
有三个羟基
无醛基
每个单元中
有三个羟基
1.遇碘单质呈蓝色
2.无还原性
3.能水解成葡萄糖
1.无还原性
2.能水解成葡萄糖
3.酯化反应
食用
制葡萄糖和酒精
制硝酸纤维
醋酸纤维
粘胶纤维
造纸
1. 下列各物质中,属于纯净物的是 ( )
A.葡萄糖 B.淀粉
C. 纤维素 D.聚氯乙烯
A
[知识巩固]
2. 淀粉和纤维素都可以用(C6H10O5)n表示分子
组成,所以它们是 ( )
A.同分异构体 B.同一种物质
C.同系物 D.多糖类物质
3. 棉花纤维素的平均相对分子质量为174960,
平均每个分子中所含葡萄糖单元的数目为
( )
A.1080 B.1800 C.972 D.1000
D
A
4. 淀粉和纤维素不属于同分异构体的原因是
( )
A.组成元素不同
B.物理性质、化学性质不同
C.包含的单糖单元数目不相同
D.分子结构不相同
5. 向淀粉中加入少量稀硫酸,并加热使之发
生水解,为测定水解程度所需下列试剂是
① 氢氧化钠溶液 ② 银氨溶液 ③ 新制氢
氧化铜 ④ 碘水 ⑤ 氯化钡溶液 ( )
A.①⑤ B.②④ C.①③④ D.②③④
C
C
[感知生活]
你能举例说说你身边的蛋白质吗?
生
细胞
蛋白质
碳、氢、氧、
氮、硫、磷
有机高分子
物体
必需
①③④⑤⑥
③④
②
⑤
向 (NH4)2SO4 饱和溶液
中加入鸡蛋清溶液后,
有沉淀析出,沉淀加入
到蒸馏水中时又溶解
(NH4)2SO4 饱和溶液
能降低鸡蛋清在水
中的溶解度,但不
改变鸡蛋清的性质
降低
盐析
轻金属盐
铵盐
促进
可逆
沉淀溶解
加热后,鸡蛋
清沉淀,凝结
的鸡蛋清放入
蒸馏水中不溶
解
加入CuSO4溶液
后,鸡蛋清沉
淀,凝结的鸡蛋
清放入蒸馏水中
不溶解
加入乙醇的水溶
液后,鸡蛋清沉
淀,凝结的鸡蛋
清放入蒸馏水中
不溶解
加热、CuSO4溶液、乙醇都能使蛋白质的性质
发生改变
紫外线照射、加热
酸、碱、
重金属盐、有机物(乙醇、苯酚、甲醛等)
性质
不可逆
杀菌消毒
鸡蛋清溶液变黄色
分子中含
有苯环的蛋白质能与浓硝酸发生颜色反应
有烧焦羽毛的特殊气味
物理
可逆
溶解
分离和提纯
化学
不可逆
变化
改变
D
A
氨基酸
氨基酸
蛋白质
离羧基最近的碳原子上
羧基(—COOH)
氨基(—NH2)
天然蛋白质水解的最终产物都是α-氨基酸
[问题讨论]
水解时肽的断键处在什么地方?
R—C—O—R’
O
H2N—CH2—C—N—CH2—COOH
O
H
(1)(2)(3)
(1)(2)(3)
氨基酸的化学性质:
与酸反应的化学方程式:
(1)两性:既能与酸反应又能与碱反应。
CH2COOH + HCl → CH2COOH
NH2
NH3+
Cl-
与碱反应的化学方程式:
CH2COOH + NaOH → CH2COONa + H2O
NH2
NH2
(2)脱水缩合(取代反应)
写出氨基乙酸与氨基乙酸脱水生成二肽的
方程式:
H2NCH2COOH
+ H2NCH2COOH
肽键
α-氨基酸
多肽
蛋白质
合成
合成
水解
水解
D
A
C
D
A
C
A
糖类蛋白质和氨基酸
专题八 有机化合物的获得与应用
—食品中的有机化合物
糖
一、糖类的组成和分类
(一)糖类的组成
由C、H、O三种元素组成的一类有机化合物。
通式为Cn(H2O)m ,也称碳水化合物。
注意:
1. 糖类通式只说明糖类由C、H、O三种元素组成,
并不反映糖类的结构。
2. 属于糖类不一定符合通式,(如鼠李糖:C6H12O5)
符合通式不一定属于糖类。(如 HCHO、CH3COOH)
糖类
碳水化合物
甜味物质
糖类
强调:
1. 糖的定义:
多羟基醛或多羟基酮,和它们的脱水缩合物。
(二)糖类的定义
单糖
低聚糖
多糖
糖
(不能水解的糖)
(1mol糖水解后能产生2~10 mol单糖)
(1mol糖水解后能产生很多摩尔单糖)
(能否水解以及水解产物的多少)
淀粉、纤维素
蔗糖、麦芽糖、乳糖
葡萄糖、果糖、核糖、脱氧核糖
2. 糖的分类:
天然高分子化合物
二、葡萄糖与果糖 (单糖)
(一)葡萄糖
1. 存在
2. 物理性质
葡萄及其它带有甜味的水果、蜂蜜中,
植物的种子、叶、根、花中,
动物的血液、脑脊液和淋巴液中。
色 体,熔点为 ,
有 味,但甜度不如蔗糖, 溶于水。
无
晶
146℃
甜
易
无色晶体
易溶于水
有甜味
葡萄糖
C C C C C C
O
H
OH OH OH OH OH
H
H H H H H
3. 葡萄糖结构式
多羟基醛
一个醛基
五个羟基
结构简式:CH2OH — (CHOH )4— CHO
分子式:C6H12O6
(官能团:-OH,-CHO)
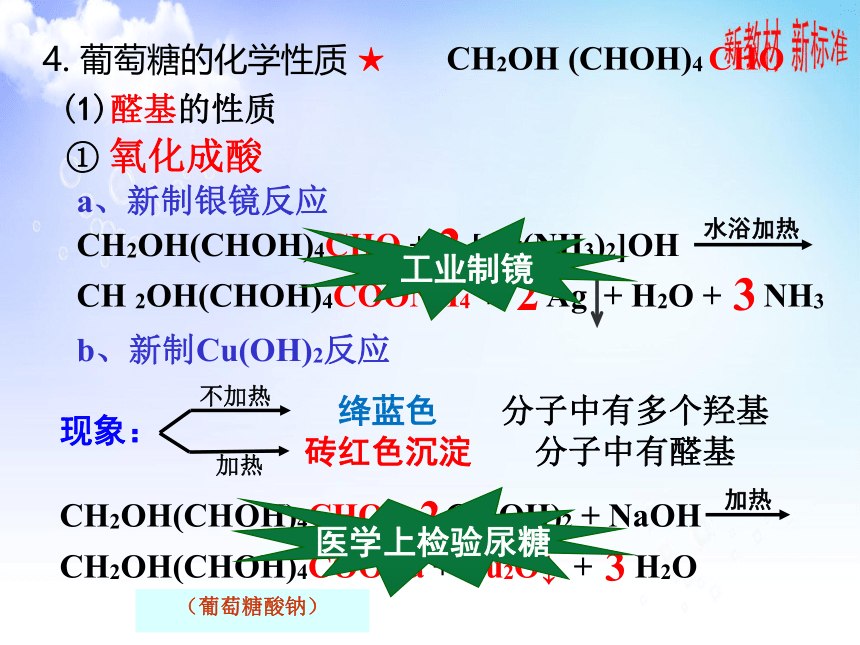
4. 葡萄糖的化学性质 ★
(1)醛基的性质
① 氧化成酸
CH2OH (CHOH)4 CHO
(葡萄糖酸钠)
2
3
CH 2OH(CHOH)4COONH4 + Ag + H2O + NH3
CH2OH(CHOH)4CHO + [Ag(NH3)2]OH
水浴加热
CH2OH(CHOH)4CHO + Cu(OH)2 + NaOH
加热
CH2OH(CHOH)4COONa + Cu2O↓ + H2O
3
2
2
现象:
a、新制银镜反应
b、新制Cu(OH)2反应
不加热
加热
绛蓝色
砖红色沉淀
分子中有多个羟基
分子中有醛基
工业制镜
医学上检验尿糖
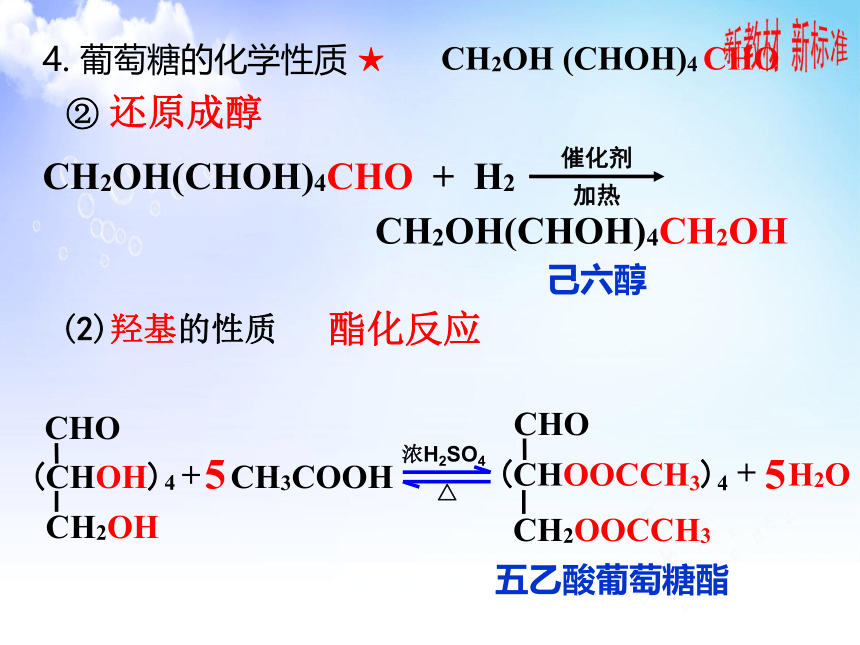
② 还原成醇
CH2OH(CHOH)4CHO + H2
催化剂
加热
己六醇
CH2OH(CHOH)4CH2OH
4. 葡萄糖的化学性质 ★
(2)羟基的性质
酯化反应
五乙酸葡萄糖酯
+
CHO
(CHOOCCH3)4
CH2OOCCH3
H2O
+
CH3COOH
CHO
(CHOH)4
CH2OH
5
5
浓H2SO4
△
CH2OH (CHOH)4 CHO
(3)在体内生理氧化反应
C6H12O6(s) + 6O2(g) → 6CO2(g) + 6H2O(l)
C6H12O6 2CH3CH2OH + 2CO2
酒曲酶
(4)发酵生成酒精
— 人体能量的主要来源
△H = - 2804 kJ·mol-1
4. 葡萄糖的化学性质 ★
葡萄糖的化学性质归纳
1. 氧化反应
a、燃烧
b、与新制Ag(NH3)2OH反应
c、与新制Cu(OH)2反应
d、生理氧化
2. 加成反应 ——与H2加成
3. 与酸发生酯化反应
4. 与活泼金属反应
5. 发酵成醇
可用于检验醛基
1. 营养物质
3. 制药工业
4. 制酒工业
5. 葡萄糖的用途
2. 制镜工业
分子式:C6H12O6
葡萄糖与果糖互为同分异构体。
二、葡萄糖与果糖 (单糖)
(二)果糖
与H2加成、酯化反应。
化学性质:
官能团:
羟基:-OH
羰基
结构简式:
CH2—CH—CH—CH—C—CH2OH
OH OH OH OH O
多羟基酮
(最甜的天然糖)
还原性糖
物质
性质
葡萄糖
果糖
存在
颜色状态
熔点
味道
溶解性
分子式
结构简式
水果、蜂蜜、人和动物体内
水果、蜂蜜中
无色晶体
无色晶体,不易结晶
通常为黏稠液体
146℃
103℃ - 105℃
有甜味
最甜的糖
易溶于水,稍溶于乙醇,
不溶于乙醚
易溶于水、乙醇、乙醚
C6H12O6
C6H12O6
1. 在一定的条件下,既可以发生氧化反应
又可以发生还原反应,还可以和酸发生
酯化反应的是 ( )
A. 乙醇 B. 乙醛
C. 乙酸 D. 葡萄糖
D
[知识巩固]
2. 下列关于糖的说法正确的是 ( )
A. 糖类中除含有C、H、O三种元素外,还
可能含有其他元素
B. 葡萄糖是多羟基醛
C. 能发生银镜反应的物质一定属于醛类
D. 糖类可划分为单糖、低聚糖、多糖三类
BD
能发生银镜反应的物质:
所有醛、甲酸、甲酸盐、甲酸酯、葡萄糖、麦芽糖。
3. 下列关于葡萄糖的说法中,错误的是( )
A. 葡萄糖的分子式是C6H12O6
B. 葡萄糖是碳水化合物,因为它的分子是
由6个C原子和6个H2O分子组成的
C. 葡萄糖是一种多羟基醛,因而具有醛和
多元醇的性质
D. 葡萄糖是单糖
B
4. 葡萄糖是单糖的原因是 ( )
A. 在糖类中含碳原子数最少??
B. 不能水解成为更简单的糖
C. 结构最简单????????????????
D. 分子中只有一个醛基
B
5. 下列有机物既能在常温下溶于水,又能
发生银镜反应的是 ( )
A. 甲醇??? B. 甲酸乙酯?
C. 葡萄糖? D. 苯酚
C
蔗糖
稀硫酸
C6H12O6 + C6H12O6
(葡萄糖) (果糖)
C12H22O11 + H2O
(蔗糖)
C12H22O11 + H2O 2 C6H12O6
(麦芽糖) (葡萄糖)
酸或酶
分子式都为 C12H22O11
麦芽糖
二
糖
同分异构体
还原糖?
三、蔗糖与麦芽糖 (二糖)
对比实验:
银氨溶液
银氨溶液
热水浴
热水浴
无现象
产生
银镜
热水浴
热水浴
20%蔗糖
溶液
20%麦芽糖溶液
无还原性
有还原性
蔗糖
麦芽糖
化学性质
同分异构体
② 水解反应
(蔗糖)
C6H12O6 + C6H12O6
C12H22O11 + H2O
稀硫酸
① 蔗糖不能发生银镜反应,也不和新制氢氧化铜反应
(葡萄糖) (果糖)
① 还原性: 能发生银镜反应(分子中含有醛基), 还原性糖
② 水解反应: 产物为葡萄糖一种
C12H22O11 + H2O 2 C6H12O6
(麦芽糖) (葡萄糖)
酸或酶
(一)蔗糖
(二)麦芽糖
(还原性糖)
(非还原性糖)
三、蔗糖与麦芽糖 (二糖)
注意
1、蔗糖、麦芽糖水解反应:
2、水解产物中醛基的验证:
加入NaOH目的:
中和硫酸,使溶液显碱性,
以防银氨溶液或新制Cu(OH)2失效。
稀硫酸做催化剂
水解反应后先加入NaOH溶液,
再加入银氨溶液或新制Cu(OH)2。
四、淀粉与纤维素 (多糖)
(C6H10O5)n
淀粉、纤维素的结构比较
(1) 淀粉、纤维素的分子式为:
(2) 但是葡萄糖分子间的结合方式不同,
其中含有的单糖单元(C6H10O5)的数值n,
取值各不相同,只有大致的范围。
(C6H10O5)n
都是由多个葡萄糖脱水形成的。
不是同分异构体关系,因为它们的n值不同
都是混合物
小结:高分子化合物都为混合物,都没有固定的熔沸点
天然高分子化合物
遇碘变蓝色
水解最终生成葡萄糖
(C6H10O5)n + nH2O nC6H12O6
淀粉 葡萄糖
酶或酸
2.化学性质
无色无味粉末状物质,不溶于冷水······
1.物理性质
(无还原性)
C6H12O6 2C2H5OH + 2CO2
酒化酶
应用: 酿酒
在热水中产生糊化作用
(一)淀粉
淀粉溶液
稀H2SO4
△
水解液
银镜
NaOH溶液
银氨溶液
△
淀粉溶液
稀H2SO4
△
水解液
碘水
溶液变蓝
(2)证明淀粉未完全水解:
(1)证明淀粉已经开始水解:
(3)证明淀粉部分水解:
(1)+(2)
【探究】设计实验方案进行淀粉水解及水解程度的检验?
淀粉液
硫酸
加热
水解液
碘水
现象A
NaOH
溶液
中和液
银氨溶液
水浴加热
现象B
现象
结论
现象A
现象B
溶液变蓝
无银镜生成
淀粉没有水解
溶液变蓝
有银镜生成
淀粉部分水解
溶液无现象
有银镜生成
淀粉完全水解
(一)淀粉
3. 淀粉的用途
(1)在体内被酶水解成葡萄糖供给人体利用;
(2)重要的食品工业原料,可用于制葡萄糖、酿醋、
酿酒,也是药片中的赋形剂(辅料)。
C6H12O6 2 C2H5OH + 2 CO2
催化剂
(C6H10O5)n + n H2O n C6H12O6
淀粉 葡萄糖
酸或酶
淀粉酿酒过程:
淀粉在淀粉酶作用下,先转化为麦芽糖,再转化为
葡萄糖,在酒化酶的作用下,转化为乙醇:
(一)淀粉
纤维素是绿色植物通过 生成的,在植物
中构成 网络,是植物体的支撑物质。
光合作用
细胞壁
棉花
竹子
(二)纤维素
1. 纤维素的物理性质
① 是___色___味的具有_____状结构的物质;
② 一般___溶于水和有机溶剂;但在一定条件
下,某些酸、碱和盐的水溶液可是纤维素
或 。
白
无
纤维
不
溶胀
溶解
2. 纤维素的化学性质
(1)不显还原性
(2)可发生水解,但比淀粉水解_____。
困难
(C6H10O5)n + n H2O n C6H12O6
强酸或酶
△
纤维素
葡萄糖
(3)酯化反应
[C6H7O2(OH)3]n
如:与硝酸反应,生成纤维素硝酸酯
与醋酸反应,生成纤维素乙酸酯
俗名:硝酸纤维
俗名:醋酸纤维
(1). 制造纤维素硝酸酯(硝酸纤维)。
根据含N 量分为火棉(含N量较高,用于制造无烟火药)、胶棉(含N量较低,用于制赛璐珞和喷漆)
(2). 制造纤维素乙酸酯(醋酸纤维)。
不易着火,用于制胶片
(3). 制造黏胶纤维(NaOH、CS2处理后所得,其中的长纤维称人造丝,短纤维称人造棉)
3.纤维素的用途(6个方面)
纯棉上衣
麻布
法国棉麻
(4). 棉麻纤维大量用于纺织工业
(5). 木材、稻草、麦秸、蔗渣等用于造纸
(6). 食物中的纤维素有利于人的消化。
淀粉
纤维素
通 式
结 构
相对分子量
相互关系
物理性质
小结:淀粉、纤维素的结构和物理性质比较
(C6H10O5)n (C6H10O5)n
n值由几百到几千 几千个葡萄糖单元
葡萄糖单元
白色无气味无味道 白色无气味无味道
不溶于冷水,热水糊化 不溶于水也不溶于
一般有机溶剂
十几万→几十万 几十万→几百万
1 、不是同分异构体 2、不是同系物
3、均属天然高分子化合物
淀粉、纤维素的化学性质比较
结构特征
化学性质
用途
淀
粉
纤
维
素
无醛基
每个单元中
有三个羟基
无醛基
每个单元中
有三个羟基
1.遇碘单质呈蓝色
2.无还原性
3.能水解成葡萄糖
1.无还原性
2.能水解成葡萄糖
3.酯化反应
食用
制葡萄糖和酒精
制硝酸纤维
醋酸纤维
粘胶纤维
造纸
1. 下列各物质中,属于纯净物的是 ( )
A.葡萄糖 B.淀粉
C. 纤维素 D.聚氯乙烯
A
[知识巩固]
2. 淀粉和纤维素都可以用(C6H10O5)n表示分子
组成,所以它们是 ( )
A.同分异构体 B.同一种物质
C.同系物 D.多糖类物质
3. 棉花纤维素的平均相对分子质量为174960,
平均每个分子中所含葡萄糖单元的数目为
( )
A.1080 B.1800 C.972 D.1000
D
A
4. 淀粉和纤维素不属于同分异构体的原因是
( )
A.组成元素不同
B.物理性质、化学性质不同
C.包含的单糖单元数目不相同
D.分子结构不相同
5. 向淀粉中加入少量稀硫酸,并加热使之发
生水解,为测定水解程度所需下列试剂是
① 氢氧化钠溶液 ② 银氨溶液 ③ 新制氢
氧化铜 ④ 碘水 ⑤ 氯化钡溶液 ( )
A.①⑤ B.②④ C.①③④ D.②③④
C
C
[感知生活]
你能举例说说你身边的蛋白质吗?
生
细胞
蛋白质
碳、氢、氧、
氮、硫、磷
有机高分子
物体
必需
①③④⑤⑥
③④
②
⑤
向 (NH4)2SO4 饱和溶液
中加入鸡蛋清溶液后,
有沉淀析出,沉淀加入
到蒸馏水中时又溶解
(NH4)2SO4 饱和溶液
能降低鸡蛋清在水
中的溶解度,但不
改变鸡蛋清的性质
降低
盐析
轻金属盐
铵盐
促进
可逆
沉淀溶解
加热后,鸡蛋
清沉淀,凝结
的鸡蛋清放入
蒸馏水中不溶
解
加入CuSO4溶液
后,鸡蛋清沉
淀,凝结的鸡蛋
清放入蒸馏水中
不溶解
加入乙醇的水溶
液后,鸡蛋清沉
淀,凝结的鸡蛋
清放入蒸馏水中
不溶解
加热、CuSO4溶液、乙醇都能使蛋白质的性质
发生改变
紫外线照射、加热
酸、碱、
重金属盐、有机物(乙醇、苯酚、甲醛等)
性质
不可逆
杀菌消毒
鸡蛋清溶液变黄色
分子中含
有苯环的蛋白质能与浓硝酸发生颜色反应
有烧焦羽毛的特殊气味
物理
可逆
溶解
分离和提纯
化学
不可逆
变化
改变
D
A
氨基酸
氨基酸
蛋白质
离羧基最近的碳原子上
羧基(—COOH)
氨基(—NH2)
天然蛋白质水解的最终产物都是α-氨基酸
[问题讨论]
水解时肽的断键处在什么地方?
R—C—O—R’
O
H2N—CH2—C—N—CH2—COOH
O
H
(1)(2)(3)
(1)(2)(3)
氨基酸的化学性质:
与酸反应的化学方程式:
(1)两性:既能与酸反应又能与碱反应。
CH2COOH + HCl → CH2COOH
NH2
NH3+
Cl-
与碱反应的化学方程式:
CH2COOH + NaOH → CH2COONa + H2O
NH2
NH2
(2)脱水缩合(取代反应)
写出氨基乙酸与氨基乙酸脱水生成二肽的
方程式:
H2NCH2COOH
+ H2NCH2COOH
肽键
α-氨基酸
多肽
蛋白质
合成
合成
水解
水解
D
A
C
D
A
C
A
