7.1 氮的固定 课件2020-2021学年苏教版(2019)高一化学必修第二册(37张PPT)
文档属性
| 名称 | 7.1 氮的固定 课件2020-2021学年苏教版(2019)高一化学必修第二册(37张PPT) |
|
|
| 格式 | pptx | ||
| 文件大小 | 58.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-25 22:16:03 | ||
图片预览











文档简介
专题七 氮与社会可持续发展
—氮的固定
第1课时
氮的固定
火箭发射的燃料
2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H = -1096.7 kJ/mol
庄稼施用的化肥
丰收的田野
与
快乐的农民
(一) 氮的存在
1.以游离态存在于空气中
— 氮气(约占空气体积的78%)
2.以化合态存在于多种无机物和有机物
— 硝酸盐、蛋白质等
一、氮气分子的结构和性质
(二) 氮气分子的结构和性质
1.电子式:
2.结构式:
3.化学性质:通常情况下很不活泼。
4.物理性质:无色无味的气体, 难溶于水,
熔沸点低, 密度比空气略小。
(与空气密度相近, 只能用排水法收集N2)
N≡N
N2+3H2
高温、高压
催化剂
2NH3
(2)与活泼金属反应
工业合成氨
(合成氨反应)
N2 + 3Mg Mg3N2
点燃
(1)与氢气反应
(3)与氧气反应
5.氮气的化学性质
6、氮气的用途:
(1)是合成氨、制硝酸的重要原料
放电
N2 + O2 2NO
(3)医学上,用液氮作冷冻剂
(2)保护气:焊接金属;灯泡的填充气体;保存粮食、罐头、水果
猜猜看:
美丽的闪电除了给我们带来的视觉和听觉上的冲击,还带来了什么?
(一) 定义
将空气中游离态的氮转化为含氮化合物叫作氮的固定。
二、氮的固定
(二) 分类
自然固氮:生物固氮 — 豆科植物的根瘤菌 90%
高能固氮 — 闪电、火山爆发 10%
人工固氮:合成氨
仿生固氮(某些金属有机化合物可起到根瘤菌
的作用)
根瘤菌
与大豆、
蚕豆等豆科
植物共生的
根瘤菌中存
在固氮酶,
能在常温常
压下把空气
中的氮气转
变为氨。
(三)生物固氮
雷雨是如何将空气中氮气生成肥料的,它的成分是什么 ?
思考:
雷雨发庄稼,闪电有助于生成氮氧化物。
雷雨天氮的固定:
放电
N2
NO
NO2
HNO3
硝酸盐
O2
水
土壤矿物
O2
涉及的主要反应:
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
N2 + O2 == 2NO
放电
(四)高能固氮
N2 + 3H2
高温、高压
催化剂
2NH3
该反应有什么特点?如何提高氨的产量?
(5)人工固氮——合成氨
①为植物生长提供足够的氮肥。
②缓解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
③改变了世界粮食生产的历史,使人类免受饥荒之苦。
20%
氮气、氢气
(5)人工固氮——合成氨
(1)反应原理
ΔH=-92.4 kJ· mol-1
(2)原料:氮气与氢气。
(4)合成氨的工艺:
③反应为可逆反应,达到平衡时混合气体中氨气约占 ,然后分离出氨气后,将未反应的 送回合成塔循环使用。
(5)合成氨的意义:
(3)条件:高温、高压、催化剂。
①在较高温度下将混合气体加压后送入合成塔反应。
②反应放出的大量的热可以用来预热原料气,以达到反应所需的温度,节约能源。
工业合成氨气示意图:
(1)X为氨气,Y为氢气与氮气混合物。
(2)高温、高压、催化剂有利于加快反应速率。
(3)从反应后的混合气体中分离出氨气,未反应的原料气循环使用有利于提高原料(氮气、氢气)的利用率。
氮肥的种类:
铵态化肥都来源于NH3
硝态化肥:硝酸盐
尿素(CO(NH2)2)
NH4Cl
NH4HCO3
(NH4)2SO4
铵态化肥
天才还是魔鬼?
哈伯(F.Haber 1868—1934)
他因攻克氨的合成这一世界难题,将无数人从饥饿的死亡线上拯救出来;他也因发明大量化学武器并用于战争,使无数人伤残致死;他是诺贝尔化学奖得主受人尊敬,他也是战争魔鬼遭人唾骂。
氮肥的生产和使用
三、氮的循环
1、一氧化氮(NO)
(1)物理性质
常温下为无色、无味的气体,微溶于水。在大气中达到一定浓度时有毒,NO使人体中毒的原理与CO相似,都是与血红蛋白结合,使其失去输送氧气的功能。
(2)化学性质具有还原性易被氧化故,只能用排水法收集
(3)用途:
在生物学方面有独特作用,人体中极少量的NO会促进血管扩张,防止血栓塞等。
+4
+2
0
-2
得4e-
失4e-
四、氮的常见氧化物及转化
2NO + O2 2NO2
2、二氧化氮(NO2)
(1)物理性质:
常温下为红棕色、有刺激性气味的气体,与水反应。在大气中达到一定浓度时有毒。只能用向上排空气法收集
(2)化学性质
得2e-
失2e-
+4
+5
+2
②NO2与NaOH溶液反应
①NO2与水反应
2NO2+2NaOH ==NaNO2+NaNO3+H2O
用于NO2的尾气吸收
2、如何除去NO中NO2?
1、如何收集NO和NO2气体?
○ NO只能用排水法,
○ NO2只能用向上排气法。
○ 将混合气通过水洗。
3、NO2与溴蒸汽如何鉴别?
○ 水洗法
○ 四氯化碳法
○ AgNO3溶液法
[课堂练习]
现给你一集体瓶二氧化氮,将其倒置于水槽中,问集气瓶内会有什么变化?
红棕色气体消失,水位上升,最后水充满集气瓶的2/3,无色气体充满集气瓶的1/3。
思考:
3NO2 + H2O == 2HNO3 + NO
你认为此实验对工业生产硝酸有什么启示?
充分利用原料,减少污染物的排放
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
……
思考:
4NO + 3O2 + 2H2O == 4HNO3
4NO2 + O2 + 2H2O == 4HNO3
1.NO2 或 NO2 和 NO 的混合气体溶于水
2.NO2 和 O2 的混合气体溶于水
3.NO 和 O2 的混合气体溶于水
4.NO2 、NO 和 O2 的混合气体溶于水
氮氧化物溶于水的有关计算
例1:将12mLNO2与O2混合气体被水充分吸收后,发现剩余2mL气体,问原混合气体体积各为多少?
讨论:(1)若剩余气体为O2,则
4NO2 + O2 + 2H2O === 4HNO3 ΔV
4V 1V 5V
若剩余气体为O2, 则反应的NO2与O2为10mL, V(NO2) = 10mL×4/5 = 8mL,
V(O2) = 12mL - 8mL = 4mL,
V(NO2) : V(O2) = 8:4 = 2:1
(2)若剩余气体是NO,则
3NO2 + H2O === 2HNO3 + NO
2mL
若剩余气体为NO, 则NO2过量为6mL,
所以参与反应②的NO2与O2为6mL,
V(NO2) = 6mL + 6mL×4/5 = 10.8mL,
V(O2) = 12mL - 10.8mL = 1.2mL,
V(NO2) : V(O2) = 10.8 : 1.2 = 9:1
4NO2 + O2 + 2H2O === 4HNO3 ΔV
4V 1V 5V
①
②
例2:将体积为10mL的试管倒置于盛水的水槽中,先向试管中注入一定量的NO,再通入O2,两种气体共为10mL,水面逐渐上升,至余3mL气体时为止。求原混合气体中NO和O2各多少毫升?
根据刚才的分析可以知道,在不知道具体哪个多的情况下有气体剩余,则剩余气体可能是NO;也可能是O2
解(1)若剩余气体为NO,则O2完全反应,设O2的体积为x
4NO + 3O2 + 2H2O = 4HNO3
4 3
x
4x/3
4x/3 + x = (10-3) = 7mL
x = 3mL V(NO) = 7mL
(2)若剩余气体为O2,则NO完全反应,设NO的体积为y
4NO + 3O2 + 2H2O = 4HNO3
4 3
3y/4
y
y + 3y/4 = (10-3) = 7mL
y = 4mL V(O2) = 6mL
总结:
(1)若将充满NO2的试管倒扣在水槽中
3NO2 + H2O = 2HNO3 + NO
继续向试管中通入氧气
水逐渐充满试管
①×2+②得:
4NO2 + O2 +2H2O = 4HNO3
结论:红棕色消失,上升试管体积 ?的水
2NO + O2 == 2NO2 ①
3NO2 + H2O == 2HNO3 + NO ②
(2)若将NO2和O2同时通入水中的反应
同理①×2+②×3得:
4NO + 3O2 + 2H2O = 4HNO3
(3)若是NO与O2呢?
V(NO2):V(O2)
=4:1,恰好完全反应。无气体剩余。
<4:1,O2过量,剩余气体为O2。
>4:1,NO2过量,剩余气体为NO?。
V(NO):V(O2)
=4:3,恰好完全反应。无气体剩余。
<4:3,O2过量,剩余气体为O2。
>4:3,NO过量,剩余气体为NO。
4NO2 + O2 +2H2O = 4HNO3
N2O、NO、N2O3、NO2、N2O4、N2O5
2NO2
N2O4
无色
红棕色
无色
(NO2和N2O4均无纯净可言)
思考:二氧化氮是硝酸的酸酐吗?为什么?
[知识拓展]
3NO2 + H2O == 2HNO3 + NO
N2O5 + H2O == 2HNO3
无色
笑气
红棕色
1998年诺贝尔奖获得者伊格纳罗
伊格纳罗发现
一氧化氮(NO)
是人体内保护
机体抵抗心血
管疾病与其他
疾病的信号分
子。
. NO
1、起固定氮作用的化学反应是 ( )
A.N2与H2在一定条件下反应生成NH3
B.硝酸工厂用NH3氧化制NO
C.雷雨时空气中的N2转化为NO
D.由NH3制碳酸氢铵和硫酸铵
2、上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法错误的是 ( )
A.NO是具有刺激性的红棕色气体
B.NO是汽车尾气的有害成分之一
C.NO在人体的血管系统能促进血管扩展
D.NO能够与人体血红蛋白结合,造成人体缺氧中毒
随堂演练
A C
A
3、将充满NO和NO2的混合气体45mL的试管,倒立于水
中,一段时间后,气体的体积为35mL,原混合气体中,NO和NO2的体积比为 ( )
A.2:1 B.2:7 C.7:2 D.9:7
解析: 3NO2 + H2O = 2HNO3 + NO △V
3 1 3-1=2
(45-35)= 10 mL
A
15 mL
V(NO2) = 15 mL,V(NO) = 30 mL;
V(NO2) :V(NO) = 1:2
随堂演练
—氮的固定
第1课时
氮的固定
火箭发射的燃料
2N2H4(g) + N2O4(g) = 3N2(g) + 4H2O(l) △H = -1096.7 kJ/mol
庄稼施用的化肥
丰收的田野
与
快乐的农民
(一) 氮的存在
1.以游离态存在于空气中
— 氮气(约占空气体积的78%)
2.以化合态存在于多种无机物和有机物
— 硝酸盐、蛋白质等
一、氮气分子的结构和性质
(二) 氮气分子的结构和性质
1.电子式:
2.结构式:
3.化学性质:通常情况下很不活泼。
4.物理性质:无色无味的气体, 难溶于水,
熔沸点低, 密度比空气略小。
(与空气密度相近, 只能用排水法收集N2)
N≡N
N2+3H2
高温、高压
催化剂
2NH3
(2)与活泼金属反应
工业合成氨
(合成氨反应)
N2 + 3Mg Mg3N2
点燃
(1)与氢气反应
(3)与氧气反应
5.氮气的化学性质
6、氮气的用途:
(1)是合成氨、制硝酸的重要原料
放电
N2 + O2 2NO
(3)医学上,用液氮作冷冻剂
(2)保护气:焊接金属;灯泡的填充气体;保存粮食、罐头、水果
猜猜看:
美丽的闪电除了给我们带来的视觉和听觉上的冲击,还带来了什么?
(一) 定义
将空气中游离态的氮转化为含氮化合物叫作氮的固定。
二、氮的固定
(二) 分类
自然固氮:生物固氮 — 豆科植物的根瘤菌 90%
高能固氮 — 闪电、火山爆发 10%
人工固氮:合成氨
仿生固氮(某些金属有机化合物可起到根瘤菌
的作用)
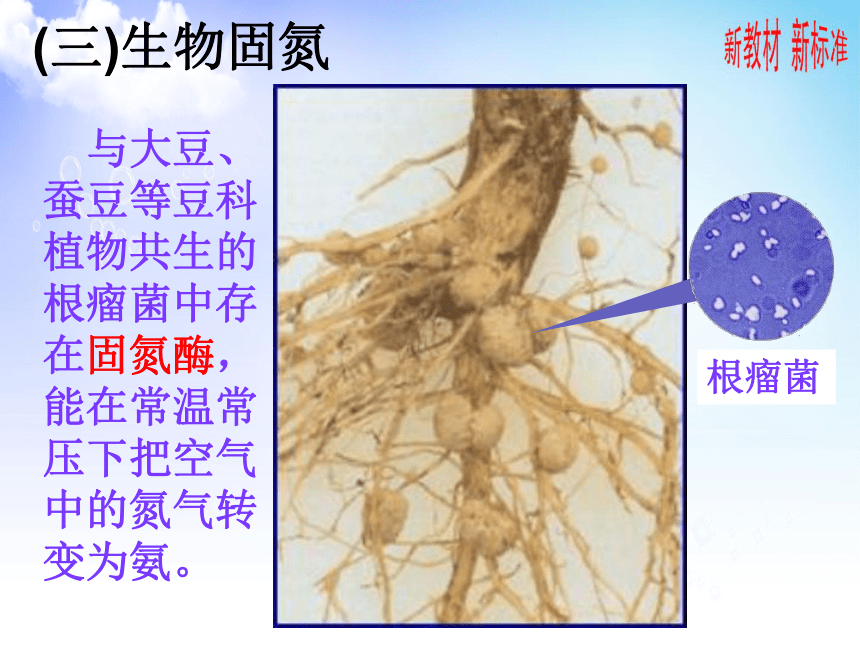
根瘤菌
与大豆、
蚕豆等豆科
植物共生的
根瘤菌中存
在固氮酶,
能在常温常
压下把空气
中的氮气转
变为氨。
(三)生物固氮
雷雨是如何将空气中氮气生成肥料的,它的成分是什么 ?
思考:
雷雨发庄稼,闪电有助于生成氮氧化物。
雷雨天氮的固定:
放电
N2
NO
NO2
HNO3
硝酸盐
O2
水
土壤矿物
O2
涉及的主要反应:
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
N2 + O2 == 2NO
放电
(四)高能固氮
N2 + 3H2
高温、高压
催化剂
2NH3
该反应有什么特点?如何提高氨的产量?
(5)人工固氮——合成氨
①为植物生长提供足够的氮肥。
②缓解了地球上有限的耕地资源与庞大的粮食需求之间的矛盾。
③改变了世界粮食生产的历史,使人类免受饥荒之苦。
20%
氮气、氢气
(5)人工固氮——合成氨
(1)反应原理
ΔH=-92.4 kJ· mol-1
(2)原料:氮气与氢气。
(4)合成氨的工艺:
③反应为可逆反应,达到平衡时混合气体中氨气约占 ,然后分离出氨气后,将未反应的 送回合成塔循环使用。
(5)合成氨的意义:
(3)条件:高温、高压、催化剂。
①在较高温度下将混合气体加压后送入合成塔反应。
②反应放出的大量的热可以用来预热原料气,以达到反应所需的温度,节约能源。
工业合成氨气示意图:
(1)X为氨气,Y为氢气与氮气混合物。
(2)高温、高压、催化剂有利于加快反应速率。
(3)从反应后的混合气体中分离出氨气,未反应的原料气循环使用有利于提高原料(氮气、氢气)的利用率。
氮肥的种类:
铵态化肥都来源于NH3
硝态化肥:硝酸盐
尿素(CO(NH2)2)
NH4Cl
NH4HCO3
(NH4)2SO4
铵态化肥
天才还是魔鬼?
哈伯(F.Haber 1868—1934)
他因攻克氨的合成这一世界难题,将无数人从饥饿的死亡线上拯救出来;他也因发明大量化学武器并用于战争,使无数人伤残致死;他是诺贝尔化学奖得主受人尊敬,他也是战争魔鬼遭人唾骂。
氮肥的生产和使用
三、氮的循环
1、一氧化氮(NO)
(1)物理性质
常温下为无色、无味的气体,微溶于水。在大气中达到一定浓度时有毒,NO使人体中毒的原理与CO相似,都是与血红蛋白结合,使其失去输送氧气的功能。
(2)化学性质具有还原性易被氧化故,只能用排水法收集
(3)用途:
在生物学方面有独特作用,人体中极少量的NO会促进血管扩张,防止血栓塞等。
+4
+2
0
-2
得4e-
失4e-
四、氮的常见氧化物及转化
2NO + O2 2NO2
2、二氧化氮(NO2)
(1)物理性质:
常温下为红棕色、有刺激性气味的气体,与水反应。在大气中达到一定浓度时有毒。只能用向上排空气法收集
(2)化学性质
得2e-
失2e-
+4
+5
+2
②NO2与NaOH溶液反应
①NO2与水反应
2NO2+2NaOH ==NaNO2+NaNO3+H2O
用于NO2的尾气吸收
2、如何除去NO中NO2?
1、如何收集NO和NO2气体?
○ NO只能用排水法,
○ NO2只能用向上排气法。
○ 将混合气通过水洗。
3、NO2与溴蒸汽如何鉴别?
○ 水洗法
○ 四氯化碳法
○ AgNO3溶液法
[课堂练习]
现给你一集体瓶二氧化氮,将其倒置于水槽中,问集气瓶内会有什么变化?
红棕色气体消失,水位上升,最后水充满集气瓶的2/3,无色气体充满集气瓶的1/3。
思考:
3NO2 + H2O == 2HNO3 + NO
你认为此实验对工业生产硝酸有什么启示?
充分利用原料,减少污染物的排放
2NO + O2 == 2NO2
3NO2 + H2O == 2HNO3 + NO
……
思考:
4NO + 3O2 + 2H2O == 4HNO3
4NO2 + O2 + 2H2O == 4HNO3
1.NO2 或 NO2 和 NO 的混合气体溶于水
2.NO2 和 O2 的混合气体溶于水
3.NO 和 O2 的混合气体溶于水
4.NO2 、NO 和 O2 的混合气体溶于水
氮氧化物溶于水的有关计算
例1:将12mLNO2与O2混合气体被水充分吸收后,发现剩余2mL气体,问原混合气体体积各为多少?
讨论:(1)若剩余气体为O2,则
4NO2 + O2 + 2H2O === 4HNO3 ΔV
4V 1V 5V
若剩余气体为O2, 则反应的NO2与O2为10mL, V(NO2) = 10mL×4/5 = 8mL,
V(O2) = 12mL - 8mL = 4mL,
V(NO2) : V(O2) = 8:4 = 2:1
(2)若剩余气体是NO,则
3NO2 + H2O === 2HNO3 + NO
2mL
若剩余气体为NO, 则NO2过量为6mL,
所以参与反应②的NO2与O2为6mL,
V(NO2) = 6mL + 6mL×4/5 = 10.8mL,
V(O2) = 12mL - 10.8mL = 1.2mL,
V(NO2) : V(O2) = 10.8 : 1.2 = 9:1
4NO2 + O2 + 2H2O === 4HNO3 ΔV
4V 1V 5V
①
②
例2:将体积为10mL的试管倒置于盛水的水槽中,先向试管中注入一定量的NO,再通入O2,两种气体共为10mL,水面逐渐上升,至余3mL气体时为止。求原混合气体中NO和O2各多少毫升?
根据刚才的分析可以知道,在不知道具体哪个多的情况下有气体剩余,则剩余气体可能是NO;也可能是O2
解(1)若剩余气体为NO,则O2完全反应,设O2的体积为x
4NO + 3O2 + 2H2O = 4HNO3
4 3
x
4x/3
4x/3 + x = (10-3) = 7mL
x = 3mL V(NO) = 7mL
(2)若剩余气体为O2,则NO完全反应,设NO的体积为y
4NO + 3O2 + 2H2O = 4HNO3
4 3
3y/4
y
y + 3y/4 = (10-3) = 7mL
y = 4mL V(O2) = 6mL
总结:
(1)若将充满NO2的试管倒扣在水槽中
3NO2 + H2O = 2HNO3 + NO
继续向试管中通入氧气
水逐渐充满试管
①×2+②得:
4NO2 + O2 +2H2O = 4HNO3
结论:红棕色消失,上升试管体积 ?的水
2NO + O2 == 2NO2 ①
3NO2 + H2O == 2HNO3 + NO ②
(2)若将NO2和O2同时通入水中的反应
同理①×2+②×3得:
4NO + 3O2 + 2H2O = 4HNO3
(3)若是NO与O2呢?
V(NO2):V(O2)
=4:1,恰好完全反应。无气体剩余。
<4:1,O2过量,剩余气体为O2。
>4:1,NO2过量,剩余气体为NO?。
V(NO):V(O2)
=4:3,恰好完全反应。无气体剩余。
<4:3,O2过量,剩余气体为O2。
>4:3,NO过量,剩余气体为NO。
4NO2 + O2 +2H2O = 4HNO3
N2O、NO、N2O3、NO2、N2O4、N2O5
2NO2
N2O4
无色
红棕色
无色
(NO2和N2O4均无纯净可言)
思考:二氧化氮是硝酸的酸酐吗?为什么?
[知识拓展]
3NO2 + H2O == 2HNO3 + NO
N2O5 + H2O == 2HNO3
无色
笑气
红棕色
1998年诺贝尔奖获得者伊格纳罗
伊格纳罗发现
一氧化氮(NO)
是人体内保护
机体抵抗心血
管疾病与其他
疾病的信号分
子。
. NO
1、起固定氮作用的化学反应是 ( )
A.N2与H2在一定条件下反应生成NH3
B.硝酸工厂用NH3氧化制NO
C.雷雨时空气中的N2转化为NO
D.由NH3制碳酸氢铵和硫酸铵
2、上世纪80年代后期人们逐渐认识到,NO在人体内起着多方面的重要生理作用。下列关于NO的说法错误的是 ( )
A.NO是具有刺激性的红棕色气体
B.NO是汽车尾气的有害成分之一
C.NO在人体的血管系统能促进血管扩展
D.NO能够与人体血红蛋白结合,造成人体缺氧中毒
随堂演练
A C
A
3、将充满NO和NO2的混合气体45mL的试管,倒立于水
中,一段时间后,气体的体积为35mL,原混合气体中,NO和NO2的体积比为 ( )
A.2:1 B.2:7 C.7:2 D.9:7
解析: 3NO2 + H2O = 2HNO3 + NO △V
3 1 3-1=2
(45-35)= 10 mL
A
15 mL
V(NO2) = 15 mL,V(NO) = 30 mL;
V(NO2) :V(NO) = 1:2
随堂演练
