(高考命题热点)以数学函数表征平衡常数 课件(58张ppt)
文档属性
| 名称 | (高考命题热点)以数学函数表征平衡常数 课件(58张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-25 00:00:00 | ||
图片预览







文档简介
(共58张PPT)
(高考命题热点)以数学函数表征平衡常数
下列叙述错误的是(
)
A.溶液pH=4时,c(M+)<3.0×10-4mol/L
B.MA的溶度积Ksp(MA
)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
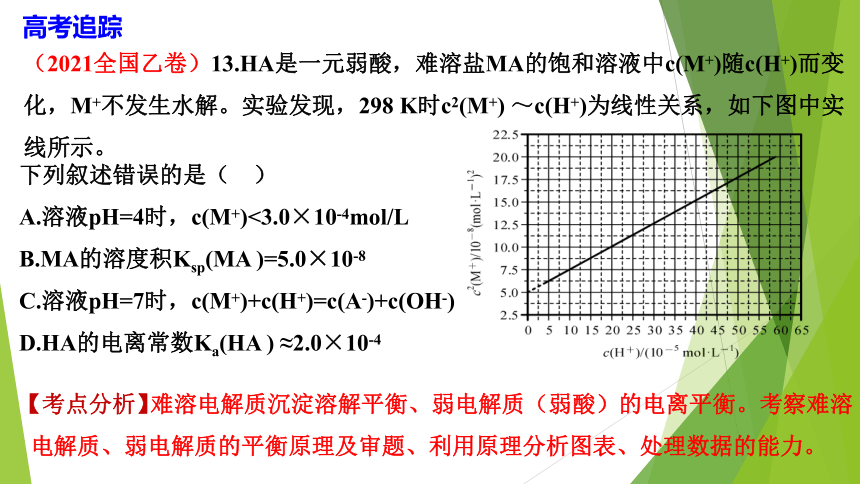
(2021全国乙卷)13.HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298
K时c2(M+)
~c(H+)为线性关系,如下图中实线所示。
【考点分析】
难溶电解质沉淀溶解平衡、弱电解质(弱酸)的电离平衡。考察难溶电解质、弱电解质的平衡原理及审题、利用原理分析图表、处理数据的能力。
高考追踪
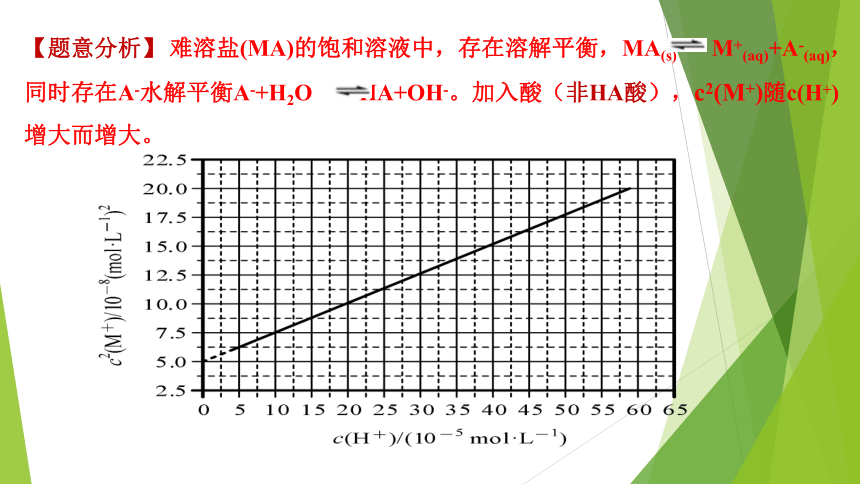
【题意分析】
难溶盐(MA)的饱和溶液中,存在溶解平衡,MA(s)
M+(aq)+A-(aq),同时存在A-水解平衡A-+H2O
HA+OH-。加入酸(非HA酸),c2(M+)随c(H+)增大而增大。
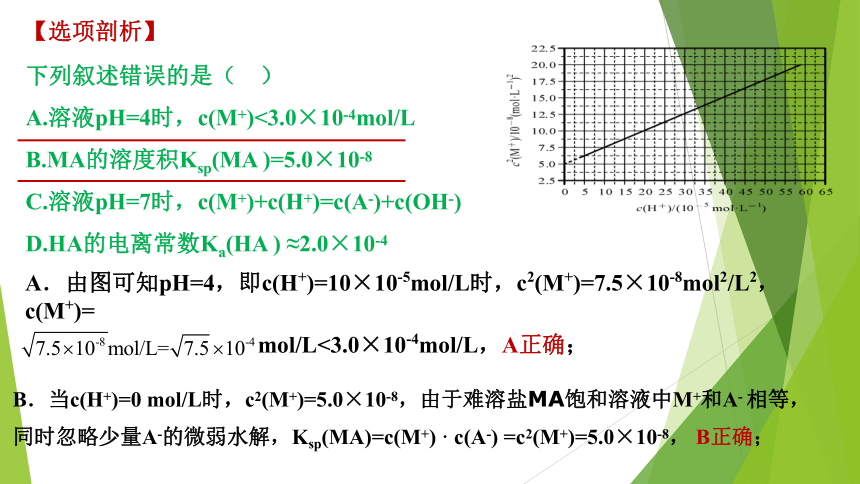
【选项剖析】
A.由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=
mol/L<3.0×10-4mol/L,A正确;
B.当c(H+)=0
mol/L时,c2(M+)=5.0×10-8,由于难溶盐MA饱和溶液中M+和A-
相等,同时忽略少量A-的微弱水解,Ksp(MA)=c(M+)
·
c(A-)
=c2(M+)=5.0×10-8,
B正确;
下列叙述错误的是(
)
A.溶液pH=4时,c(M+)<3.0×10-4mol/L
B.MA的溶度积Ksp(MA
)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
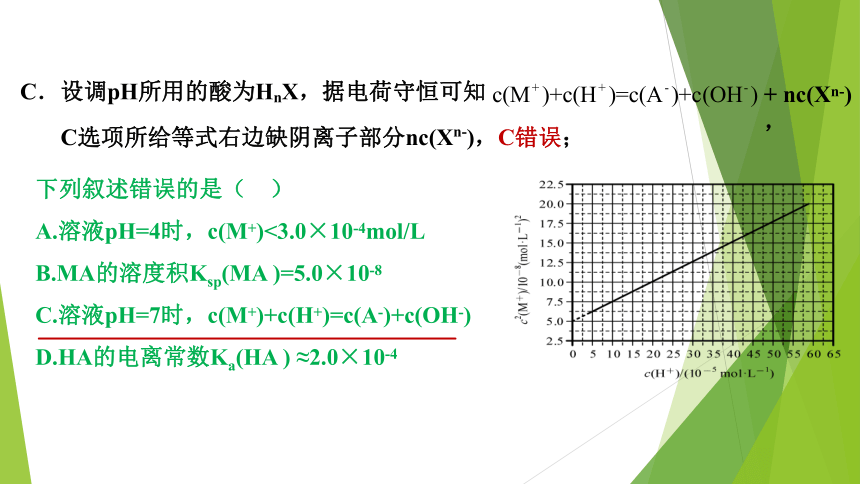
C.设调pH所用的酸为HnX,据电荷守恒可知
C选项所给等式右边缺阴离子部分nc(Xn-),C错误;
+
nc(Xn-),
下列叙述错误的是(
)
A.溶液pH=4时,c(M+)<3.0×10-4mol/L
B.MA的溶度积Ksp(MA
)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
下列叙述错误的是(
)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
故选C。
【备考启示】综合性强,难度大,对能力要求高,涉及利用图像提供信息。题目不断创新,变化情景和坐标。在复习过程中,必须进行专项训练,让学生掌握解决这类题的必备知识电离平衡、溶解平衡、电荷守恒、物料守恒、离子浓度大小关系、简单计算等,掌握解读图像信息的方法、分析推理方法、解题步骤和方法等关键能力,引导学生做题时注重细节,注意陷阱,避免不必要的失分。
解析:
难溶盐MA的饱和溶液中,存在:
MA?
M++A?
A?
+H2O?
HA+
OH?
溶液中存在:
物料守恒:c(M+)=
c(A?)+c(HA)。
电荷守恒:c(M+)+c(H+)=c(A?)+c(OH?)
加入酸存在:
A?
+
H+?
HA
若在MA的饱和溶液中,加入酸调整c(H+),则电荷守恒发生变化。
在MA溶液中,随着c(H+)增大,c2(M+)增大。由图中可以找出几个特殊点:
c(H+)=0
c2(M+)=5.0×10-8
(mol/L)2
c(M+)=5.01/2×10-4mol/L
c(H+)=10-4mol/L
c2(M+)=7.5×10-8
(mol/L)2
c(M+)=7.51/2×10-4mol/L
c(H+)=2×10-4mol/L
c2(M+)=10×10-8
(mol/L)2
c(M+)=101/2×10-4mol/L
c(H+)=3×10-4mol/L
c2(M+)=12.5×10-8
(mol/L)2
c(M+)=12.51/2×10-4mol/L
解法一:
Ksp(MA)=
c(M+)×c(A?)
Ka(HA)=
c(H+)×c(A?)/
c(HA)
推导得出:
Ka=
c(H+)×[Ksp/c(M+)]/[c(M+)-c(A?)]=c(H+)×[Ksp/c(M+)]/[c(M+)-Ksp/c(M+)]
变形后可得:
Ka×c(M+)=(
Ka+
c(H+))×Ksp/c(M+)
Ka×c2(M+)=(
Ka+
c(H+))×Ksp
代入数字可得:
Ka×5.0×10-8=(
Ka+0)×Ksp
①
Ka×7.5×10-8=(
Ka+10-4)×Ksp
②
Ka×10×10-8=(
Ka+2×10-4)×Ksp
③
解方程可得:Ka(HA)=2.0×10-4
Ksp(MA
)=5.0×10-8
解法二:由图像可知,c(H+)=0
c2(M+)=5.0×10-8
(mol/L)2
c(M+)=5.01/2×10-4mol/L
若忽略A?水解,Ksp(MA)=
c(M+)×c(A?)=
c2(M+)=5.0×10-8
(mol/L)2
Ka(HA)=
c(H+)×c(A?)/
c(HA)
推导得出:
Ka=
c(H+)×[Ksp/c(M+)]/[c(M+)-c(A?)]=c(H+)×[Ksp/c(M+)]/[c(M+)-Ksp/c(M+)]
变形后可得:Ka×c(M+)=(
Ka+
c(H+))×Ksp/c(M+)
Ka×c2(M+)=(
Ka+
c(H+))×Ksp
由图像可知,c(H+)=2×10-4mol/L
c2(M+)=10.0×10-8
(mol/L)2
Ka×10.0×10-8=(
Ka+2×10-4)×5.0×10-8
解方程可得:Ka(HA)=2.0×10-4
或者
由图像可知,c(H+)=10-4mol/L
c2(M+)=7.5×10-8
(mol/L)2
Ka×7.5×10-8=(
Ka+10-4)×5.0×10-8
解方程可得:Ka(HA)=2.0×10-4
【考点分析】
(2021全国甲卷)
此题考察难溶电解质沉淀溶解平衡理论知识。具体考察学生读图、通过图像提供的数据信息,深入考查学生信息整合能力,并利用图中信息,考察Ksp的计算,离子浓度关系和离子浓度变化规律。
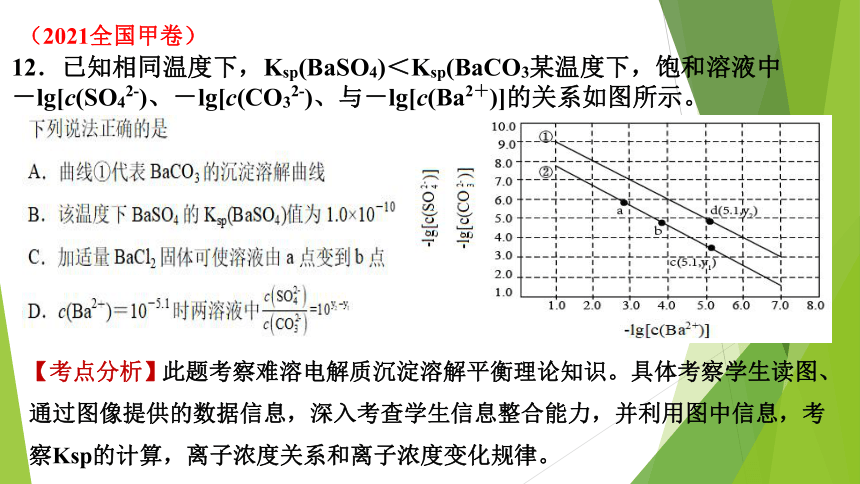
12.已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3某温度下,饱和溶液中-lg[c(SO42-)、-lg[c(CO32-)、与-lg[c(Ba2+)]的关系如图所示。
因Ksp(BaSO4)<
Ksp(BaCO3),则-lg[Ksp(BaCO3)]<-lg[Ksp(BaSO4)],由此可知曲线①为-lg[c(Ba2+)]与-lg[c(SO42-))]的关系,曲线②为-lg[c(Ba2+)]与-lg[c(CO32-)]的关系。
【题意分析】
此题关键问题是判断两条直线各代表何种难溶电解质。BaCO3、BaSO4均为难溶物,饱和溶液中-lg[c(Ba2+)]+{-lg[c(SO42-)]}=-lg[c(Ba2+)×
c([c(SO42-)]=-lg[Ksp(BaSO4)],同理可知溶液中-lg[c(Ba2+)]+{-lg[c(SO42-)]}=-lg[Ksp(BaCO3)],
BaSO4
BaCO3
【选项剖析】
BaSO4
BaCO3
A.由题可知,曲线上的点均为饱和溶液中微粒浓度关系,由上述分析可知,曲线①为BaSO4的沉淀溶解曲线,选项A错误;
B.曲线①为BaSO4溶液中-lg[c(Ba2+)]与-lg[c(SO42-)]的关系,由图可知,当溶液中-lg[c(Ba2+)]=3时,-lg[c(SO42-)=7,则-lg[Ksp(BaSO4)]=7+3=10,因此Ksp(BaSO4)=1.0×10-10,选项B正确;
【选项剖析】
BaSO4
BaCO3
C.向饱和BaSO4溶液中加入适量BaCl2固体后,溶液中c(Ba2+)增大,根据温度不变则Ksp(BaSO4)不变可知,溶液中c(SO42-)将减小,因此a点将沿曲线①向左上方移动,选项C错误;
D.由图可知,当溶液中c(Ba2+)=10-5.1时,两溶液中
=
=
选项D错误;答案选B。
(3)①由lgKp2~1/T图可知,反应2NOCl(g)?2NO(g)+Cl2(g),1/T值越大,温度越低,lgKp2越小,降低温度,平衡逆移,说明NOCl分解为NO和Cl2,属于吸热反应,△H大于0。
同理,由lgKp1~1/T图可知,反应2NO(g)+2ICl(g)?2NOCl(g)+
I2(g),温度越低,lgKp2越大,属于放热反应,△H小于0。
(2021全国乙卷28节选)
②由2NO(g)+2ICl(g)?2NOCl(g)+I2(g)和2NOCl(g)?2NO(g)+Cl2(g)相加,可以得到2ICl(g)
?Cl2(g)+I2(g),反应2ICl(g)
?Cl2(g)+I2(g)的平衡常数:K=
Kp1×Kp2
反应2ICl(g)
?Cl2(g)+I2(g)的△H大小的推理过程:选取图像中,两个不相同温度的lgKp1和lgKp2值。
①最左侧点(高温):lgKp1=-1.3
lgKp2=-2.6
②最右侧点(低温):lgKp1=-0.6
lgKp2=-3.5
解法一:代入计算,比较大小即可。
最左侧点(高温):K=Kp1×Kp2=10-3.9
最右侧点(低温):
K=Kp1×Kp2=10-4.1
由数据分析可知,降低温度,反应2ICl(g)=Cl2(g)+I2(g)平衡常数减小,平衡逆移,该反应的△H大于0。
解法二:
K=Kp1×Kp2
lgK
=lg(Kp1×Kp2)=lgKp1+lgKp2
选取图像中,两个不同温度的lgKp1和lgKp2值之和,比较大小即可。
①最左侧点(高温):
lgK=lgKp1+lgKp2=-3.9
②最右侧点(低温):
lgK=lgKp1+lgKp2=-4.1
由数据分析可知,降低温度,(lgKp1+lgKp2)减小,说明反应2ICl(g)=Cl2(g)+I2(g)平衡常数减小,平衡逆移,该反应的△H大于0。
一
以反比例函数为载体
1.透过平衡常数绘图像
结合合适的平衡常数表达式选择自变量和因变量构建反比例函数。
[典例1] 用反比例函数图像表征一定温度下Na2CO3溶液中关于水解平衡常数表达式中的相关量。
[答案]
[点评] 总之,函数图像的自主构建关键是结合平衡常数表达式选择合适的自变量和因变量,使其满足反比例函数定义即可,如氢氟酸的电离平衡常数为Ka=c(H+)·c(F-),若自变量为c(H+)则因变量为c(F-),若自变量为c(F-)则因变量为c(H+)。
2.结合图像看平衡常数
先看图形中横、纵坐标的含义,然后再对照相应的平衡常数表达式,找出相关关系式。
D
C
以一次函数为载体
一次函数表达式:y=kx+b(k,b是常数,k≠0)。这类题一般有两种来源,第一种在离子积、电离平衡常数、水解平衡常数、溶度积等的表达式的基础上直接变形而来;第二种由在离子积、电离平衡常数、水解平衡常数、溶度积等的表达式的两侧同时取对数值再适当变化而来。
[典例4] 用一次函数图像表征某温度下Na2CO3溶液中关于水解平衡常数表达式中的相关量。
[答案]
[典例5] 用一次函数图像表征某温度下Fe(OH)3悬浊液中关于溶度积表达式中相关量。
则若以lgc(Fe3+)为纵坐标、lgc(OH-)为横坐标的关系符合一次函数,函数图像如图a所示。
②对溶度积等式两侧同时取负对数计算得
-lgKsp=-lg[c(Fe3+)·c3(OH-)],
-lgKsp=-lgc(Fe3+)-lgc3(OH-),
-lgKsp=-lgc(Fe3+)-3lgc(OH-),
则若以-lgc(Fe3+)为纵坐标、-lgc(OH-)为横坐标的关系符合一次函数,函数图像如图b所示。
[答案]
[点评] 总之,绘制图像其他类型的推导根据情况以此类推(可以自由规定横纵坐标)。
D
B
D
3.某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种
离子(M2+),所需S2-最低浓度的对数值lg
c(S2-)与lg
c
(M2+)的关系如图所示。下列说法正确的是( )
A.三种离子对应的硫化物中Ksp(CuS)最小,约为1×
10-20
B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大
C.可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2
D.向浓度均为1×10-5
mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4
mol·L-1的Na2S溶液,Zn2+先沉淀
C
解析:向横坐标作一垂线,与三条斜线相交,此时c(S2-)相同,而
c(Cu2+)mol·L-1,c(Cu2+)=10-25
mol·L-1,Ksp(CuS)=10-35,A项错误;向MnS的悬浊液中加水,促进溶解,溶解平衡正向移动,但依然是MnS的饱和溶液,c(S2-)不变,B项错误;因为Ksp(ZnS)
(高考命题热点)以数学函数表征平衡常数
下列叙述错误的是(
)
A.溶液pH=4时,c(M+)<3.0×10-4mol/L
B.MA的溶度积Ksp(MA
)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
(2021全国乙卷)13.HA是一元弱酸,难溶盐MA的饱和溶液中c(M+)随c(H+)而变化,M+不发生水解。实验发现,298
K时c2(M+)
~c(H+)为线性关系,如下图中实线所示。
【考点分析】
难溶电解质沉淀溶解平衡、弱电解质(弱酸)的电离平衡。考察难溶电解质、弱电解质的平衡原理及审题、利用原理分析图表、处理数据的能力。
高考追踪
【题意分析】
难溶盐(MA)的饱和溶液中,存在溶解平衡,MA(s)
M+(aq)+A-(aq),同时存在A-水解平衡A-+H2O
HA+OH-。加入酸(非HA酸),c2(M+)随c(H+)增大而增大。
【选项剖析】
A.由图可知pH=4,即c(H+)=10×10-5mol/L时,c2(M+)=7.5×10-8mol2/L2,c(M+)=
mol/L<3.0×10-4mol/L,A正确;
B.当c(H+)=0
mol/L时,c2(M+)=5.0×10-8,由于难溶盐MA饱和溶液中M+和A-
相等,同时忽略少量A-的微弱水解,Ksp(MA)=c(M+)
·
c(A-)
=c2(M+)=5.0×10-8,
B正确;
下列叙述错误的是(
)
A.溶液pH=4时,c(M+)<3.0×10-4mol/L
B.MA的溶度积Ksp(MA
)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
C.设调pH所用的酸为HnX,据电荷守恒可知
C选项所给等式右边缺阴离子部分nc(Xn-),C错误;
+
nc(Xn-),
下列叙述错误的是(
)
A.溶液pH=4时,c(M+)<3.0×10-4mol/L
B.MA的溶度积Ksp(MA
)=5.0×10-8
C.溶液pH=7时,c(M+)+c(H+)=c(A-)+c(OH-)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
下列叙述错误的是(
)
D.HA的电离常数Ka(HA
)
≈2.0×10-4
故选C。
【备考启示】综合性强,难度大,对能力要求高,涉及利用图像提供信息。题目不断创新,变化情景和坐标。在复习过程中,必须进行专项训练,让学生掌握解决这类题的必备知识电离平衡、溶解平衡、电荷守恒、物料守恒、离子浓度大小关系、简单计算等,掌握解读图像信息的方法、分析推理方法、解题步骤和方法等关键能力,引导学生做题时注重细节,注意陷阱,避免不必要的失分。
解析:
难溶盐MA的饱和溶液中,存在:
MA?
M++A?
A?
+H2O?
HA+
OH?
溶液中存在:
物料守恒:c(M+)=
c(A?)+c(HA)。
电荷守恒:c(M+)+c(H+)=c(A?)+c(OH?)
加入酸存在:
A?
+
H+?
HA
若在MA的饱和溶液中,加入酸调整c(H+),则电荷守恒发生变化。
在MA溶液中,随着c(H+)增大,c2(M+)增大。由图中可以找出几个特殊点:
c(H+)=0
c2(M+)=5.0×10-8
(mol/L)2
c(M+)=5.01/2×10-4mol/L
c(H+)=10-4mol/L
c2(M+)=7.5×10-8
(mol/L)2
c(M+)=7.51/2×10-4mol/L
c(H+)=2×10-4mol/L
c2(M+)=10×10-8
(mol/L)2
c(M+)=101/2×10-4mol/L
c(H+)=3×10-4mol/L
c2(M+)=12.5×10-8
(mol/L)2
c(M+)=12.51/2×10-4mol/L
解法一:
Ksp(MA)=
c(M+)×c(A?)
Ka(HA)=
c(H+)×c(A?)/
c(HA)
推导得出:
Ka=
c(H+)×[Ksp/c(M+)]/[c(M+)-c(A?)]=c(H+)×[Ksp/c(M+)]/[c(M+)-Ksp/c(M+)]
变形后可得:
Ka×c(M+)=(
Ka+
c(H+))×Ksp/c(M+)
Ka×c2(M+)=(
Ka+
c(H+))×Ksp
代入数字可得:
Ka×5.0×10-8=(
Ka+0)×Ksp
①
Ka×7.5×10-8=(
Ka+10-4)×Ksp
②
Ka×10×10-8=(
Ka+2×10-4)×Ksp
③
解方程可得:Ka(HA)=2.0×10-4
Ksp(MA
)=5.0×10-8
解法二:由图像可知,c(H+)=0
c2(M+)=5.0×10-8
(mol/L)2
c(M+)=5.01/2×10-4mol/L
若忽略A?水解,Ksp(MA)=
c(M+)×c(A?)=
c2(M+)=5.0×10-8
(mol/L)2
Ka(HA)=
c(H+)×c(A?)/
c(HA)
推导得出:
Ka=
c(H+)×[Ksp/c(M+)]/[c(M+)-c(A?)]=c(H+)×[Ksp/c(M+)]/[c(M+)-Ksp/c(M+)]
变形后可得:Ka×c(M+)=(
Ka+
c(H+))×Ksp/c(M+)
Ka×c2(M+)=(
Ka+
c(H+))×Ksp
由图像可知,c(H+)=2×10-4mol/L
c2(M+)=10.0×10-8
(mol/L)2
Ka×10.0×10-8=(
Ka+2×10-4)×5.0×10-8
解方程可得:Ka(HA)=2.0×10-4
或者
由图像可知,c(H+)=10-4mol/L
c2(M+)=7.5×10-8
(mol/L)2
Ka×7.5×10-8=(
Ka+10-4)×5.0×10-8
解方程可得:Ka(HA)=2.0×10-4
【考点分析】
(2021全国甲卷)
此题考察难溶电解质沉淀溶解平衡理论知识。具体考察学生读图、通过图像提供的数据信息,深入考查学生信息整合能力,并利用图中信息,考察Ksp的计算,离子浓度关系和离子浓度变化规律。
12.已知相同温度下,Ksp(BaSO4)<Ksp(BaCO3某温度下,饱和溶液中-lg[c(SO42-)、-lg[c(CO32-)、与-lg[c(Ba2+)]的关系如图所示。
因Ksp(BaSO4)<
Ksp(BaCO3),则-lg[Ksp(BaCO3)]<-lg[Ksp(BaSO4)],由此可知曲线①为-lg[c(Ba2+)]与-lg[c(SO42-))]的关系,曲线②为-lg[c(Ba2+)]与-lg[c(CO32-)]的关系。
【题意分析】
此题关键问题是判断两条直线各代表何种难溶电解质。BaCO3、BaSO4均为难溶物,饱和溶液中-lg[c(Ba2+)]+{-lg[c(SO42-)]}=-lg[c(Ba2+)×
c([c(SO42-)]=-lg[Ksp(BaSO4)],同理可知溶液中-lg[c(Ba2+)]+{-lg[c(SO42-)]}=-lg[Ksp(BaCO3)],
BaSO4
BaCO3
【选项剖析】
BaSO4
BaCO3
A.由题可知,曲线上的点均为饱和溶液中微粒浓度关系,由上述分析可知,曲线①为BaSO4的沉淀溶解曲线,选项A错误;
B.曲线①为BaSO4溶液中-lg[c(Ba2+)]与-lg[c(SO42-)]的关系,由图可知,当溶液中-lg[c(Ba2+)]=3时,-lg[c(SO42-)=7,则-lg[Ksp(BaSO4)]=7+3=10,因此Ksp(BaSO4)=1.0×10-10,选项B正确;
【选项剖析】
BaSO4
BaCO3
C.向饱和BaSO4溶液中加入适量BaCl2固体后,溶液中c(Ba2+)增大,根据温度不变则Ksp(BaSO4)不变可知,溶液中c(SO42-)将减小,因此a点将沿曲线①向左上方移动,选项C错误;
D.由图可知,当溶液中c(Ba2+)=10-5.1时,两溶液中
=
=
选项D错误;答案选B。
(3)①由lgKp2~1/T图可知,反应2NOCl(g)?2NO(g)+Cl2(g),1/T值越大,温度越低,lgKp2越小,降低温度,平衡逆移,说明NOCl分解为NO和Cl2,属于吸热反应,△H大于0。
同理,由lgKp1~1/T图可知,反应2NO(g)+2ICl(g)?2NOCl(g)+
I2(g),温度越低,lgKp2越大,属于放热反应,△H小于0。
(2021全国乙卷28节选)
②由2NO(g)+2ICl(g)?2NOCl(g)+I2(g)和2NOCl(g)?2NO(g)+Cl2(g)相加,可以得到2ICl(g)
?Cl2(g)+I2(g),反应2ICl(g)
?Cl2(g)+I2(g)的平衡常数:K=
Kp1×Kp2
反应2ICl(g)
?Cl2(g)+I2(g)的△H大小的推理过程:选取图像中,两个不相同温度的lgKp1和lgKp2值。
①最左侧点(高温):lgKp1=-1.3
lgKp2=-2.6
②最右侧点(低温):lgKp1=-0.6
lgKp2=-3.5
解法一:代入计算,比较大小即可。
最左侧点(高温):K=Kp1×Kp2=10-3.9
最右侧点(低温):
K=Kp1×Kp2=10-4.1
由数据分析可知,降低温度,反应2ICl(g)=Cl2(g)+I2(g)平衡常数减小,平衡逆移,该反应的△H大于0。
解法二:
K=Kp1×Kp2
lgK
=lg(Kp1×Kp2)=lgKp1+lgKp2
选取图像中,两个不同温度的lgKp1和lgKp2值之和,比较大小即可。
①最左侧点(高温):
lgK=lgKp1+lgKp2=-3.9
②最右侧点(低温):
lgK=lgKp1+lgKp2=-4.1
由数据分析可知,降低温度,(lgKp1+lgKp2)减小,说明反应2ICl(g)=Cl2(g)+I2(g)平衡常数减小,平衡逆移,该反应的△H大于0。
一
以反比例函数为载体
1.透过平衡常数绘图像
结合合适的平衡常数表达式选择自变量和因变量构建反比例函数。
[典例1] 用反比例函数图像表征一定温度下Na2CO3溶液中关于水解平衡常数表达式中的相关量。
[答案]
[点评] 总之,函数图像的自主构建关键是结合平衡常数表达式选择合适的自变量和因变量,使其满足反比例函数定义即可,如氢氟酸的电离平衡常数为Ka=c(H+)·c(F-),若自变量为c(H+)则因变量为c(F-),若自变量为c(F-)则因变量为c(H+)。
2.结合图像看平衡常数
先看图形中横、纵坐标的含义,然后再对照相应的平衡常数表达式,找出相关关系式。
D
C
以一次函数为载体
一次函数表达式:y=kx+b(k,b是常数,k≠0)。这类题一般有两种来源,第一种在离子积、电离平衡常数、水解平衡常数、溶度积等的表达式的基础上直接变形而来;第二种由在离子积、电离平衡常数、水解平衡常数、溶度积等的表达式的两侧同时取对数值再适当变化而来。
[典例4] 用一次函数图像表征某温度下Na2CO3溶液中关于水解平衡常数表达式中的相关量。
[答案]
[典例5] 用一次函数图像表征某温度下Fe(OH)3悬浊液中关于溶度积表达式中相关量。
则若以lgc(Fe3+)为纵坐标、lgc(OH-)为横坐标的关系符合一次函数,函数图像如图a所示。
②对溶度积等式两侧同时取负对数计算得
-lgKsp=-lg[c(Fe3+)·c3(OH-)],
-lgKsp=-lgc(Fe3+)-lgc3(OH-),
-lgKsp=-lgc(Fe3+)-3lgc(OH-),
则若以-lgc(Fe3+)为纵坐标、-lgc(OH-)为横坐标的关系符合一次函数,函数图像如图b所示。
[答案]
[点评] 总之,绘制图像其他类型的推导根据情况以此类推(可以自由规定横纵坐标)。
D
B
D
3.某温度时,可用K2S沉淀Cu2+、Mn2+、Zn2+三种
离子(M2+),所需S2-最低浓度的对数值lg
c(S2-)与lg
c
(M2+)的关系如图所示。下列说法正确的是( )
A.三种离子对应的硫化物中Ksp(CuS)最小,约为1×
10-20
B.向MnS的悬浊液中加入少量水,沉淀溶解平衡向溶解的方向移动,c(S2-)增大
C.可用MnS除去MnCl2溶液中混有的少量杂质ZnCl2
D.向浓度均为1×10-5
mol·L-1的Cu2+、Zn2+、Mn2+混合溶液中逐滴加入1×10-4
mol·L-1的Na2S溶液,Zn2+先沉淀
C
解析:向横坐标作一垂线,与三条斜线相交,此时c(S2-)相同,而
c(Cu2+)
mol·L-1,Ksp(CuS)=10-35,A项错误;向MnS的悬浊液中加水,促进溶解,溶解平衡正向移动,但依然是MnS的饱和溶液,c(S2-)不变,B项错误;因为Ksp(ZnS)
同课章节目录
