3.1 第1课时 醇 精品课件(人教版选修5)
文档属性
| 名称 | 3.1 第1课时 醇 精品课件(人教版选修5) |

|
|
| 格式 | zip | ||
| 文件大小 | 979.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-15 00:00:00 | ||
图片预览









文档简介
(共41张PPT)
醇 酚
掌握:(1)乙醇的消去反应、氧化反应;
(2)苯酚的弱酸性、与溴的反应等重要的化学性质.
认识:乙二醇、丙三醇、苯酚的物理性质和用途.
知道:醇和酚的结构特点.
第1课时 醇
一、醇类
1.概念
与烃基或苯环侧链上的碳原子相连的化合物称
为醇.
2.分类
根据醇分子里含 的数目,醇可分为:
羟基
羟基
[读教材·填要点]
(1)一元醇:如甲醇的结构简式: ;
(2)二元醇:如乙二醇的结构简式: ;
(3)多元醇:如丙三醇的结构简式: .
CH3OH
3.分子通式
饱和一元醇的分子通式为 .
CnH2n+2O CnH2n+1OH
或
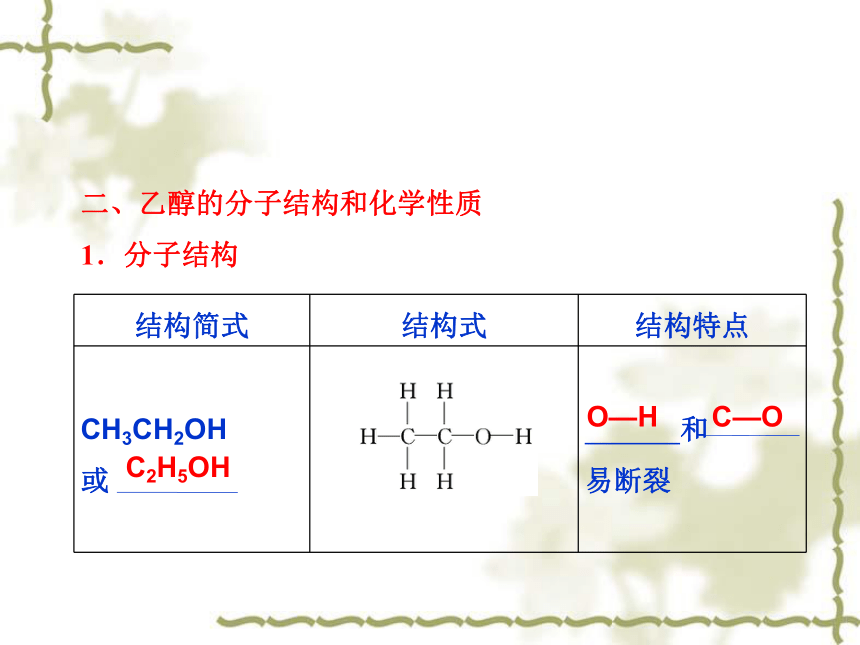
二、乙醇的分子结构和化学性质
1.分子结构
结构简式 结构式 结构特点
CH3CH2OH
或
和
易断裂
C2H5OH
O—H
C—O
2.化学性质
(1)和钠反应
化学方程式为:
.
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
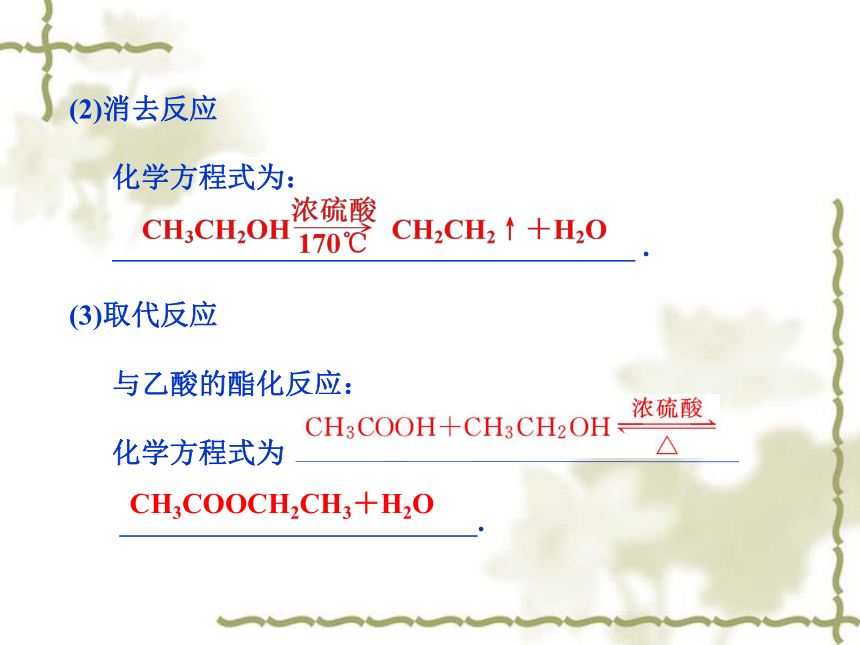
(2)消去反应
化学方程式为:
.
(3)取代反应
与乙酸的酯化反应:
化学方程式为
.
CH3COOCH2CH3+H2O
(4)氧化反应
①催化氧化反应
化学方程式为:
.
②乙醇能被高锰酸钾酸性溶液或重铬酸钾酸性溶液氧化,先生成 ,最后生成 .
乙醛
乙酸
[先思考·再交流]
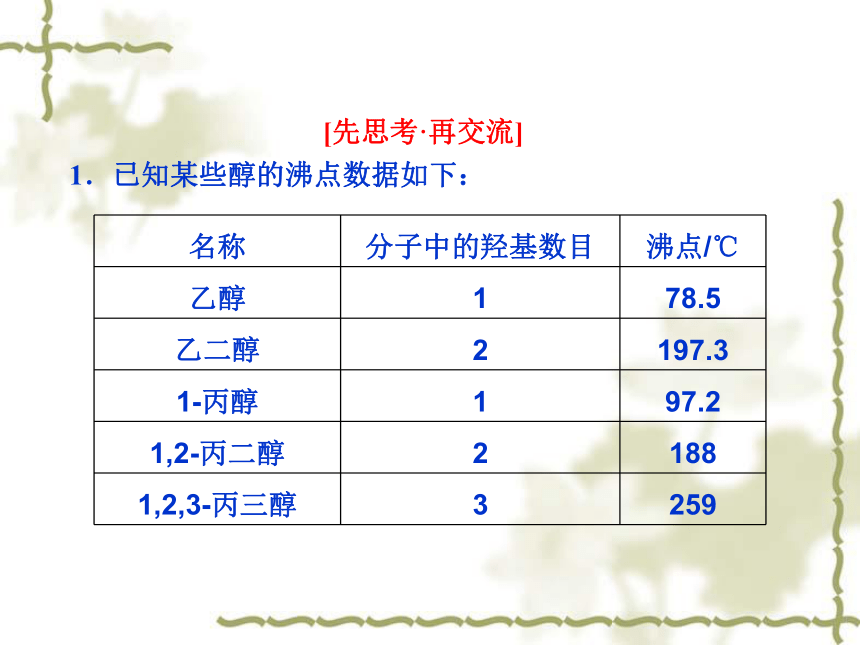
1.已知某些醇的沸点数据如下:
名称 分子中的羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1 丙醇 1 97.2
1,2 丙二醇 2 188
1,2,3 丙三醇 3 259
通过上述表格中的数据,你能得出醇类物质沸点变化的哪些递变规律?
分析:通过表格中乙醇、1 丙醇的沸点数据可知,随着碳原子数的增多,醇的沸点升高;由1 丙醇、1,2 丙二醇、1,2,3 丙三醇的沸点数据可知,醇分子中羟基数目越多,沸点越高.
答案:①饱和一元醇中,随着碳原子数的增多,沸点升高.②碳原子数相同时,羟基数目越多,沸点越高.
2.你知道如何检验酒精中是否含水吗?还有,如何除去酒
精中的水分呢?
分析:无水CuSO4遇水后生成CuSO4·5H2O,颜色由白色变成蓝色,可用于水的检验;由于乙醇和水能形成恒沸液,故不能通过直接蒸馏的方法分离二者,而是先加入CaO,与水反应生成Ca(OH)2,然后再加热蒸出乙醇.
答案:常加入无水硫酸铜固体,若发现白色固体变蓝,则证明酒精中有水;若酒精中有水,向其中加入CaO后再蒸馏,可得到无水乙醇.
3.上网查询:交警用“吹气法”检查司机是否酒后驾车的原理
是什么?
分析:若司机酒后驾车,则司机对着仪器吹气后,乙醇能与装置中的重铬酸钾发生反应:
3C2H5OH+2K2Cr2O7+8H2SO4―→
(橙红色)
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O.
(绿色)
重铬酸钾由橙红色变成绿色时,说明司机酒后驾车.
答案:3C2H5OH+2K2Cr2O7+8H2SO4―→
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O.
要点一 乙醇消去反应的实验探究———————————
1.实验装置
2.实验步骤
在长颈圆底烧瓶中加入乙醇和浓硫酸(体积比约为1∶3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸.加热混合液,使液体温度迅速升到170℃,将生成的气体分别通入高锰酸钾酸性溶液和溴的四氯化碳溶液中,观察并记录实验现象.
3.注意事项
(1)配制体积比为1∶3的乙醇与浓硫酸混合液时,要注
意在烧杯中先加入95%乙醇,然后滴加浓硫酸,边滴加边搅拌,冷却备用(相当于浓硫酸的稀释),浓硫酸起催化剂和脱水剂的作用.
(2)加热混合液时,温度要迅速上升到并稳定于170℃左右,
因为在140℃时主要产物是乙醚.
(3)由于反应物都是液体而无固体,所以要向烧瓶中加入
碎瓷片,以防液体受热时发生暴沸.
(4)温度计的玻璃泡要置于反应液的中央位置,因为需要
测量的是反应液的温度.
由于浓H2SO4具有强氧化性,它可将乙醇氧化为C或CO2,而本身被还原为SO2.实验时可用氢氧化钠溶液除去混在乙烯中的CO2、SO2等杂质,防止SO2干扰乙烯与溴的四氯化碳溶液和高锰酸钾酸性溶液的反应.
[例1] (2011·天津汇文中学期中)如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.
请回答:
(1)实验步骤
①_____________________________________________;
②在各装置中注入相应的试剂(如图所示);
③______________________;实验时,烧瓶中液体混合物
逐渐变黑.
(2)能够说明乙烯具有还原性的现象是________;装置甲的作
用是__________________________________.
若无甲装置,是否也能检验乙烯具有还原性,简述其理
由:___________________________________________.
[解析] (1)①制取气体的装置气密性必须良好,实验前需要检验装置的气密性.
②实验室制乙烯时应使反应混合物的温度迅速升至170℃,而减少乙醚的生成.
(2)乙烯具有还原性是根据氧化剂KMnO4酸性溶液退色来判断的.由于烧瓶中混合物变黑,则说明生成了碳,联想浓H2SO4具有强氧化性,可知在乙烯中含有还原性气体SO2,由于SO2也会使KMnO4酸性溶液退色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净SO2,则装置甲的作用是除去SO2.
[答案] (1)组装仪器,检验装置的气密性 加热,使温度迅速升到170℃
(2)乙中KMnO4酸性溶液紫色褪去 除去乙烯中混有的SO2、CO2等酸性气体 不能,SO2具有还原性,也可以使KMnO4酸性溶液退色
1.(2011·朝阳期末)某化学兴趣小组用如图Ⅰ所示的装置
进行探究实验.当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色.
(1)该实验中生成乙烯的化学方程式为________________________________________________.
(2)一些同学认为,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性,因为棕黑色物质与浓硫酸反应可能生成某种气体.该气体使溴水褪色的化学反应方程式为:_____________________________________________.
另一些同学经过细致观察后认为,试管中另一个现象可证明反应中有乙烯生成且乙烯具有不饱和性.这个现象是________________________________________________.
解析:(1)乙醇在浓H2SO4的催化作用下加热至170℃,发生消去反应生成乙烯.
(2)由于浓H2SO4有强氧化性,会与乙醇反应而产生SO2,而SO2也能使溴水褪色,发生的反应为:
SO2+Br2+2H2O===2HBr+H2SO4,
但乙烯与Br2发生加成时会生成密度比水大且不溶于水的油状液体 .
要点二 醇的消去反应和催化氧化反应规律———
1.醇的消去反应规律
(1)醇分子中,连有羟基的碳原子的相邻碳原子上必须连
有氢原子时,才能发生消去反应.
(2)若醇分子中与羟基相连的碳原子无相邻碳原子或其相邻
碳原子上无氢原子,则不能发生消去反应.如CH3OH、(CH3)3CCH2OH不能发生消去反应.
2.醇的催化氧化规律
醇分子中,羟基上的氢原子和与羟基相连的碳原子上的氢原子结合外来的氧原子生成水,而形成了 .
(2)形如 的醇,被催化氧化生成酮.
(3)形如 的醇,一般不能发生催化氧化.
[例2] 分子式为C4H10O的下列四种有机物中:
能被催化氧化为含相同碳原子数的醛的是 ( )
A.①和② B.②和③
C.①和③ D.③和④
[解析] 醇催化氧化生成醛时,醇应具有RCH2OH结构,催化氧化生成酮时具有 结构.
[答案] C
2.下列醇类不能发生催化氧化的是 ( )
.
解析: 分子结构中与羟基相连
的碳原子上没有氢原子,不能发生催化氧化.
答案:D
乙醇分子结构的断键部位与相应的化学性质是容易混淆内容,学生误认为乙醇的脱水反应都是消去反应,误认为凡是醇都能发生消去反应或都能被氧化为醛.
[例] 溴乙烷和乙醇都能发生消去反应,它们有什么异同?请填写下表:
CH3CH2Br CH3CH2OH
反应条件
化学键的断裂
化学键的生成
反应产物
[答案]
CH3CH2Br CH3CH2OH
反应条件 NaOH乙醇溶液,
加热 浓硫酸,加热到
化学键的断裂 C—Br、C—H C—O、C—H
化学键的生成
反应产物 CH2===CH2、HBr CH2===CH2、H2O
醇 酚
掌握:(1)乙醇的消去反应、氧化反应;
(2)苯酚的弱酸性、与溴的反应等重要的化学性质.
认识:乙二醇、丙三醇、苯酚的物理性质和用途.
知道:醇和酚的结构特点.
第1课时 醇
一、醇类
1.概念
与烃基或苯环侧链上的碳原子相连的化合物称
为醇.
2.分类
根据醇分子里含 的数目,醇可分为:
羟基
羟基
[读教材·填要点]
(1)一元醇:如甲醇的结构简式: ;
(2)二元醇:如乙二醇的结构简式: ;
(3)多元醇:如丙三醇的结构简式: .
CH3OH
3.分子通式
饱和一元醇的分子通式为 .
CnH2n+2O CnH2n+1OH
或
二、乙醇的分子结构和化学性质
1.分子结构
结构简式 结构式 结构特点
CH3CH2OH
或
和
易断裂
C2H5OH
O—H
C—O
2.化学性质
(1)和钠反应
化学方程式为:
.
2CH3CH2OH+2Na―→2CH3CH2ONa+H2↑
(2)消去反应
化学方程式为:
.
(3)取代反应
与乙酸的酯化反应:
化学方程式为
.
CH3COOCH2CH3+H2O
(4)氧化反应
①催化氧化反应
化学方程式为:
.
②乙醇能被高锰酸钾酸性溶液或重铬酸钾酸性溶液氧化,先生成 ,最后生成 .
乙醛
乙酸
[先思考·再交流]
1.已知某些醇的沸点数据如下:
名称 分子中的羟基数目 沸点/℃
乙醇 1 78.5
乙二醇 2 197.3
1 丙醇 1 97.2
1,2 丙二醇 2 188
1,2,3 丙三醇 3 259
通过上述表格中的数据,你能得出醇类物质沸点变化的哪些递变规律?
分析:通过表格中乙醇、1 丙醇的沸点数据可知,随着碳原子数的增多,醇的沸点升高;由1 丙醇、1,2 丙二醇、1,2,3 丙三醇的沸点数据可知,醇分子中羟基数目越多,沸点越高.
答案:①饱和一元醇中,随着碳原子数的增多,沸点升高.②碳原子数相同时,羟基数目越多,沸点越高.
2.你知道如何检验酒精中是否含水吗?还有,如何除去酒
精中的水分呢?
分析:无水CuSO4遇水后生成CuSO4·5H2O,颜色由白色变成蓝色,可用于水的检验;由于乙醇和水能形成恒沸液,故不能通过直接蒸馏的方法分离二者,而是先加入CaO,与水反应生成Ca(OH)2,然后再加热蒸出乙醇.
答案:常加入无水硫酸铜固体,若发现白色固体变蓝,则证明酒精中有水;若酒精中有水,向其中加入CaO后再蒸馏,可得到无水乙醇.
3.上网查询:交警用“吹气法”检查司机是否酒后驾车的原理
是什么?
分析:若司机酒后驾车,则司机对着仪器吹气后,乙醇能与装置中的重铬酸钾发生反应:
3C2H5OH+2K2Cr2O7+8H2SO4―→
(橙红色)
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O.
(绿色)
重铬酸钾由橙红色变成绿色时,说明司机酒后驾车.
答案:3C2H5OH+2K2Cr2O7+8H2SO4―→
3CH3COOH+2Cr2(SO4)3+2K2SO4+11H2O.
要点一 乙醇消去反应的实验探究———————————
1.实验装置
2.实验步骤
在长颈圆底烧瓶中加入乙醇和浓硫酸(体积比约为1∶3)的混合液20 mL,放入几片碎瓷片,以避免混合液在受热时暴沸.加热混合液,使液体温度迅速升到170℃,将生成的气体分别通入高锰酸钾酸性溶液和溴的四氯化碳溶液中,观察并记录实验现象.
3.注意事项
(1)配制体积比为1∶3的乙醇与浓硫酸混合液时,要注
意在烧杯中先加入95%乙醇,然后滴加浓硫酸,边滴加边搅拌,冷却备用(相当于浓硫酸的稀释),浓硫酸起催化剂和脱水剂的作用.
(2)加热混合液时,温度要迅速上升到并稳定于170℃左右,
因为在140℃时主要产物是乙醚.
(3)由于反应物都是液体而无固体,所以要向烧瓶中加入
碎瓷片,以防液体受热时发生暴沸.
(4)温度计的玻璃泡要置于反应液的中央位置,因为需要
测量的是反应液的温度.
由于浓H2SO4具有强氧化性,它可将乙醇氧化为C或CO2,而本身被还原为SO2.实验时可用氢氧化钠溶液除去混在乙烯中的CO2、SO2等杂质,防止SO2干扰乙烯与溴的四氯化碳溶液和高锰酸钾酸性溶液的反应.
[例1] (2011·天津汇文中学期中)如图是一套实验室制取乙烯并验证乙烯具有还原性的实验装置.
请回答:
(1)实验步骤
①_____________________________________________;
②在各装置中注入相应的试剂(如图所示);
③______________________;实验时,烧瓶中液体混合物
逐渐变黑.
(2)能够说明乙烯具有还原性的现象是________;装置甲的作
用是__________________________________.
若无甲装置,是否也能检验乙烯具有还原性,简述其理
由:___________________________________________.
[解析] (1)①制取气体的装置气密性必须良好,实验前需要检验装置的气密性.
②实验室制乙烯时应使反应混合物的温度迅速升至170℃,而减少乙醚的生成.
(2)乙烯具有还原性是根据氧化剂KMnO4酸性溶液退色来判断的.由于烧瓶中混合物变黑,则说明生成了碳,联想浓H2SO4具有强氧化性,可知在乙烯中含有还原性气体SO2,由于SO2也会使KMnO4酸性溶液退色,会干扰验证乙烯的还原性,所以检验乙烯的还原性前必须除净SO2,则装置甲的作用是除去SO2.
[答案] (1)组装仪器,检验装置的气密性 加热,使温度迅速升到170℃
(2)乙中KMnO4酸性溶液紫色褪去 除去乙烯中混有的SO2、CO2等酸性气体 不能,SO2具有还原性,也可以使KMnO4酸性溶液退色
1.(2011·朝阳期末)某化学兴趣小组用如图Ⅰ所示的装置
进行探究实验.当温度迅速上升后,可观察到试管中的溴水褪色,烧瓶中浓硫酸与乙醇的混合液体变为棕黑色.
(1)该实验中生成乙烯的化学方程式为________________________________________________.
(2)一些同学认为,溴水褪色的现象不能证明反应中有乙烯生成及乙烯具有不饱和性,因为棕黑色物质与浓硫酸反应可能生成某种气体.该气体使溴水褪色的化学反应方程式为:_____________________________________________.
另一些同学经过细致观察后认为,试管中另一个现象可证明反应中有乙烯生成且乙烯具有不饱和性.这个现象是________________________________________________.
解析:(1)乙醇在浓H2SO4的催化作用下加热至170℃,发生消去反应生成乙烯.
(2)由于浓H2SO4有强氧化性,会与乙醇反应而产生SO2,而SO2也能使溴水褪色,发生的反应为:
SO2+Br2+2H2O===2HBr+H2SO4,
但乙烯与Br2发生加成时会生成密度比水大且不溶于水的油状液体 .
要点二 醇的消去反应和催化氧化反应规律———
1.醇的消去反应规律
(1)醇分子中,连有羟基的碳原子的相邻碳原子上必须连
有氢原子时,才能发生消去反应.
(2)若醇分子中与羟基相连的碳原子无相邻碳原子或其相邻
碳原子上无氢原子,则不能发生消去反应.如CH3OH、(CH3)3CCH2OH不能发生消去反应.
2.醇的催化氧化规律
醇分子中,羟基上的氢原子和与羟基相连的碳原子上的氢原子结合外来的氧原子生成水,而形成了 .
(2)形如 的醇,被催化氧化生成酮.
(3)形如 的醇,一般不能发生催化氧化.
[例2] 分子式为C4H10O的下列四种有机物中:
能被催化氧化为含相同碳原子数的醛的是 ( )
A.①和② B.②和③
C.①和③ D.③和④
[解析] 醇催化氧化生成醛时,醇应具有RCH2OH结构,催化氧化生成酮时具有 结构.
[答案] C
2.下列醇类不能发生催化氧化的是 ( )
.
解析: 分子结构中与羟基相连
的碳原子上没有氢原子,不能发生催化氧化.
答案:D
乙醇分子结构的断键部位与相应的化学性质是容易混淆内容,学生误认为乙醇的脱水反应都是消去反应,误认为凡是醇都能发生消去反应或都能被氧化为醛.
[例] 溴乙烷和乙醇都能发生消去反应,它们有什么异同?请填写下表:
CH3CH2Br CH3CH2OH
反应条件
化学键的断裂
化学键的生成
反应产物
[答案]
CH3CH2Br CH3CH2OH
反应条件 NaOH乙醇溶液,
加热 浓硫酸,加热到
化学键的断裂 C—Br、C—H C—O、C—H
化学键的生成
反应产物 CH2===CH2、HBr CH2===CH2、H2O
