浙江省衢州市仲尼中学高一化学《 金属的电化学腐蚀》教案
文档属性
| 名称 | 浙江省衢州市仲尼中学高一化学《 金属的电化学腐蚀》教案 |

|
|
| 格式 | zip | ||
| 文件大小 | 117.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-15 00:00:00 | ||
图片预览

文档简介
金属的电化学腐蚀
--------------------颜琴
一、教材分析
在高中课程标准必修教科书化学2中,已经介绍了化学能与电能的转换,即原电池的相关知识。本节是在此基础上,引导学生了解金属的腐蚀原理和防护方法等。教材首先以彩色图片介绍锈迹斑斑的钢铁,来引入金属的腐蚀。金属的腐蚀包括化学腐蚀和电化学腐蚀两部分内容。为了降低难度,教科书中没有出现“吸氧腐蚀”和“析氢腐蚀”这两个名词,只是介绍了钢铁发生电化学腐蚀时在正极上发生的这两类原电池反应。最后强调指出化学腐蚀和电化学腐蚀的本质是金属原子失去电子变成阳离子的过程。
二、学情分析
通过上一节课的学习,学生已经掌握了原电池和电解池的化学原理,本节课就是要应用原电池和电解池的化学原理,研究金属腐蚀的原因和金属的防护问题。为了培养同学们的自学能力,理论联系实际的能力和对知识归纳总结的能力。
三、教学目标
1、能通过多种方式了解金属腐蚀带来的危害,认识防止金属腐蚀的重要意义。
2、了解化学腐蚀和电化学腐蚀的含义,理解电化学腐蚀发生的条件。
3、通过实验探究铁的吸氧腐蚀和析氢腐蚀的区别,并认识不同腐蚀发生的条件。
4、了解常见的防止金属腐蚀的方法,并能解释其中的原因。
5、培养学生的自学能力,理论联系实际的能力和归纳总结知识的能力。
6、使学生树立环境保护意识和珍惜资源,可持续发展的意识。
四、教学重点:电化学腐蚀的原因、防止金属腐蚀的方法
教学难点:析氢腐蚀和吸氧腐蚀的电极反应方程式。
五、教学过程
第一课时:
[引入] 据报道:全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失的总和的6倍。这还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。金属腐蚀的主要害处,不仅在于金属本身的损失,更严重的是金属制品结构损坏所造成的损失比金属本身要大到无法估量。钢铁因腐蚀而报废的数量约占钢铁当年产量的25%—30%。面对这样惊人的数据,大家有没有想过,铁怎么会被腐蚀?
[学生回答] 铁会与空气中的氧气及水蒸汽等作用生成铁锈。
[讲述]铁的腐蚀可分为多种情况:在高温下铁可能与空气总的氧气发生反应;在酸性环境下,铁会与酸发生反应;在中性或碱性条件下,铁会与空气中的氧气及水蒸气发生反应。
自主探究: [阅读教材P23,回答]
1、什么是金属的腐蚀?
2、金属的腐蚀可分为哪几类?
3、金属的电化学腐蚀和化学腐蚀的本质是什么?
4、上面所讲述的铁的腐蚀情况中,哪些是化学腐蚀哪些是电化学腐蚀?
[板书]金属的电化学腐蚀
金属的腐蚀
金属的化学腐蚀
金属的电化学腐蚀
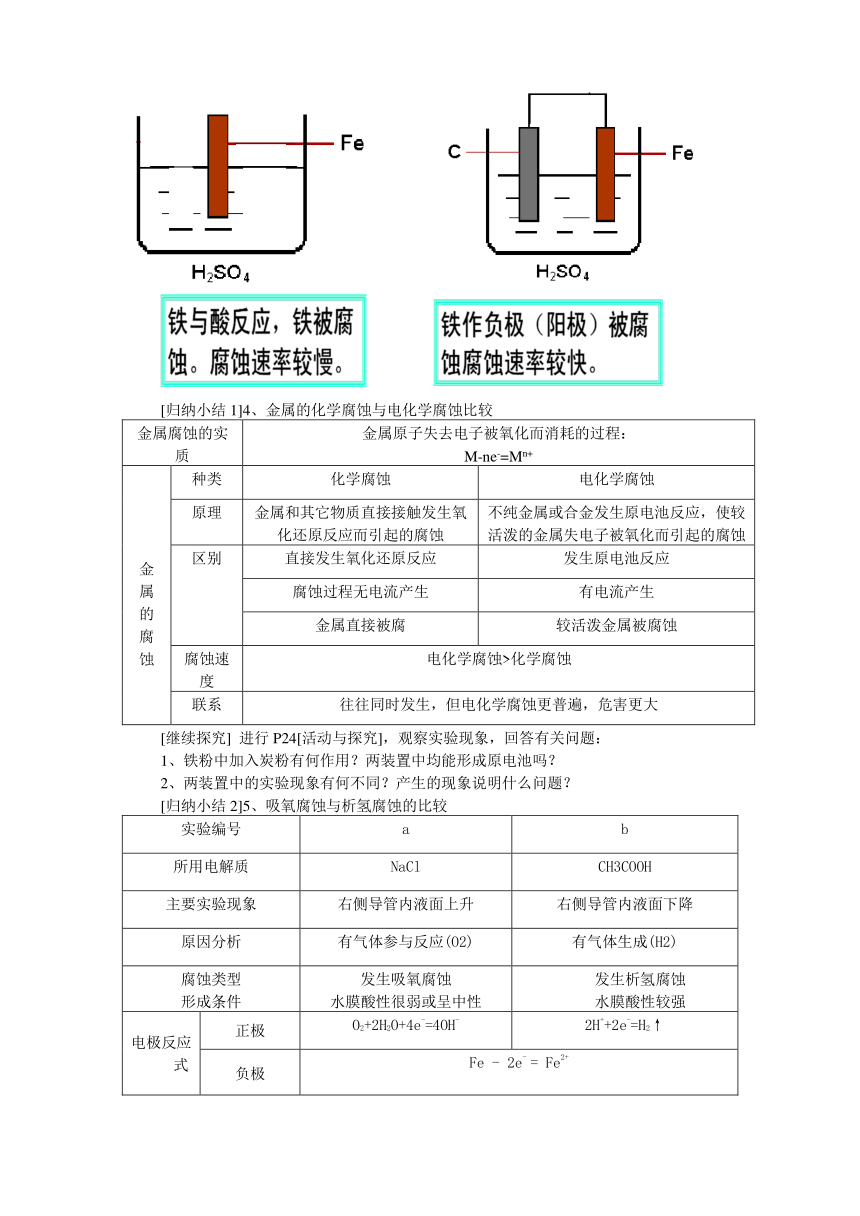
[联系旧知] 按下图进行实验)请比较下列现象的差异?
[归纳小结1]4、金属的化学腐蚀与电化学腐蚀比较
金属腐蚀的实质 金属原子失去电子被氧化而消耗的过程:M-ne-=Mn+
金属的腐蚀 种类 化学腐蚀 电化学腐蚀
原理 金属和其它物质直接接触发生氧化还原反应而引起的腐蚀 不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
区别 直接发生氧化还原反应 发生原电池反应
腐蚀过程无电流产生 有电流产生
金属直接被腐 较活泼金属被腐蚀
腐蚀速度 电化学腐蚀>化学腐蚀
联系 往往同时发生,但电化学腐蚀更普遍,危害更大
[继续探究] 进行P24[活动与探究],观察实验现象,回答有关问题:
1、铁粉中加入炭粉有何作用?两装置中均能形成原电池吗?
2、两装置中的实验现象有何不同?产生的现象说明什么问题?
[归纳小结2]5、吸氧腐蚀与析氢腐蚀的比较
实验编号 a b
所用电解质 NaCl CH3COOH
主要实验现象 右侧导管内液面上升 右侧导管内液面下降
原因分析 有气体参与反应(O2) 有气体生成(H2)
腐蚀类型形成条件 发生吸氧腐蚀水膜酸性很弱或呈中性 发生析氢腐蚀水膜酸性较强
电极反应式 正极 O2+2H2O+4e-=4OH- 2H++2e-=H2↑
负极 Fe - 2e- = Fe2+
电池总反应 2Fe+O2+2H2O=2Fe(OH)2 Fe+2H+=Fe2++H2 ↑
溶液中反应(铁锈的生成) Fe2++2OH-= Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O
出现的频率 较高 较低
[交流与讨论]P25哪些因素影响了金属腐蚀的快慢呢
1、相对于在内河行驶的轮船来说,海轮更容易被腐蚀。
2、1910年遗留在南极的食品罐头盒,其表面至今很少有铁锈出现。
3、用于连接铜板的铁螺丝容易生锈。
4、当化工厂排出的废气为酸性时,工厂附近的铁制品容易生锈。
6、金属腐蚀快慢的判断
(一)对于不同的金属而言:与金属的活泼性有关,一般地,活泼性越强的金属,越__容易_______被腐蚀。
(二)对于同种金属而言:
与引起腐蚀的原因有关:一般说来,电解原理引起的腐蚀 _>___原电池原理引起的腐蚀__>___化学腐蚀 __>__有防腐措施的腐蚀
(2) 与介质条件有关:一般说来
同种金属的腐蚀在强电解质中__>___弱电解质中 __>__非电解质中
(3)与构成微电池两极的材料有关:
两极材料的活动性差别越大,较活泼金属被腐蚀的速度越 快 。
(4)与环境温度有关,温度越高,金属腐蚀速度越 快 。
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
六、板书设计
金属的电化学腐蚀
1金属的腐蚀
2金属的化学腐蚀
3金属的电化学腐蚀
4、金属的化学腐蚀与电化学腐蚀比较
金属腐蚀的实质 金属原子失去电子被氧化而消耗的过程:M-ne-=Mn+
金属的腐蚀 种类 化学腐蚀 电化学腐蚀
原理 金属和其它物质直接接触发生氧化还原反应而引起的腐蚀 不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
区别 直接发生氧化还原反应 发生原电池反应
腐蚀过程无电流产生 有电流产生
金属直接被腐 较活泼金属被腐蚀
腐蚀速度 电化学腐蚀>化学腐蚀
联系 往往同时发生,但电化学腐蚀更普遍,危害更大
5、吸氧腐蚀与析氢腐蚀的比较
实验编号 a b
所用电解质 NaCl CH3COOH
主要实验现象 右侧导管内液面上升 右侧导管内液面下降
原因分析 有气体参与反应(O2) 有气体生成(H2)
腐蚀类型形成条件 发生吸氧腐蚀水膜酸性很弱或呈中性 发生析氢腐蚀水膜酸性较强
电极反应式 正极 O2+2H2O+4e-=4OH- 2H++2e-=H2↑
负极 Fe - 2e- = Fe2+
电池总反应 2Fe+O2+2H2O=2Fe(OH)2 Fe+2H+=Fe2++H2 ↑
溶液中反应(铁锈的生成) Fe2++2OH-= Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O
出现的频率 较高 较低
6、金属腐蚀快慢的判断
七、课后练习
A类:X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z极上有H2放出,若电解Y2+和Z2+共存的溶液时,Y先析出,又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( A )
A.X>Z>Y>M B.X>Y>Z>M
C.M>Z>X>Y D.X>Z>M>Y
B类:4.钢铁发生电化学腐蚀时,负极上发生的反应是( C )
A.2H2O+2e-====H2↑+2OH- B.O2+2H2O+4e-====4OH-
C.Fe-2e-====Fe2+ D.4OH--4e-====2H2O+O2↑
C类:下列叙述不正确的是( C )
A.金属的电化学腐蚀比化学腐蚀更普通 B.钢铁在干燥空气里不易被腐蚀
C.用铝质铆钉铆接铁板,铝铆钉易被腐蚀 D.原电池中电子由正极流入负极
--------------------颜琴
一、教材分析
在高中课程标准必修教科书化学2中,已经介绍了化学能与电能的转换,即原电池的相关知识。本节是在此基础上,引导学生了解金属的腐蚀原理和防护方法等。教材首先以彩色图片介绍锈迹斑斑的钢铁,来引入金属的腐蚀。金属的腐蚀包括化学腐蚀和电化学腐蚀两部分内容。为了降低难度,教科书中没有出现“吸氧腐蚀”和“析氢腐蚀”这两个名词,只是介绍了钢铁发生电化学腐蚀时在正极上发生的这两类原电池反应。最后强调指出化学腐蚀和电化学腐蚀的本质是金属原子失去电子变成阳离子的过程。
二、学情分析
通过上一节课的学习,学生已经掌握了原电池和电解池的化学原理,本节课就是要应用原电池和电解池的化学原理,研究金属腐蚀的原因和金属的防护问题。为了培养同学们的自学能力,理论联系实际的能力和对知识归纳总结的能力。
三、教学目标
1、能通过多种方式了解金属腐蚀带来的危害,认识防止金属腐蚀的重要意义。
2、了解化学腐蚀和电化学腐蚀的含义,理解电化学腐蚀发生的条件。
3、通过实验探究铁的吸氧腐蚀和析氢腐蚀的区别,并认识不同腐蚀发生的条件。
4、了解常见的防止金属腐蚀的方法,并能解释其中的原因。
5、培养学生的自学能力,理论联系实际的能力和归纳总结知识的能力。
6、使学生树立环境保护意识和珍惜资源,可持续发展的意识。
四、教学重点:电化学腐蚀的原因、防止金属腐蚀的方法
教学难点:析氢腐蚀和吸氧腐蚀的电极反应方程式。
五、教学过程
第一课时:
[引入] 据报道:全世界每年因金属腐蚀造成的直接经济损失约达7000亿美元,是地震、水灾、台风等自然灾害造成损失的总和的6倍。这还不包括由于腐蚀导致的停工、减产和爆炸等造成的间接损失。金属腐蚀的主要害处,不仅在于金属本身的损失,更严重的是金属制品结构损坏所造成的损失比金属本身要大到无法估量。钢铁因腐蚀而报废的数量约占钢铁当年产量的25%—30%。面对这样惊人的数据,大家有没有想过,铁怎么会被腐蚀?
[学生回答] 铁会与空气中的氧气及水蒸汽等作用生成铁锈。
[讲述]铁的腐蚀可分为多种情况:在高温下铁可能与空气总的氧气发生反应;在酸性环境下,铁会与酸发生反应;在中性或碱性条件下,铁会与空气中的氧气及水蒸气发生反应。
自主探究: [阅读教材P23,回答]
1、什么是金属的腐蚀?
2、金属的腐蚀可分为哪几类?
3、金属的电化学腐蚀和化学腐蚀的本质是什么?
4、上面所讲述的铁的腐蚀情况中,哪些是化学腐蚀哪些是电化学腐蚀?
[板书]金属的电化学腐蚀
金属的腐蚀
金属的化学腐蚀
金属的电化学腐蚀
[联系旧知] 按下图进行实验)请比较下列现象的差异?
[归纳小结1]4、金属的化学腐蚀与电化学腐蚀比较
金属腐蚀的实质 金属原子失去电子被氧化而消耗的过程:M-ne-=Mn+
金属的腐蚀 种类 化学腐蚀 电化学腐蚀
原理 金属和其它物质直接接触发生氧化还原反应而引起的腐蚀 不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
区别 直接发生氧化还原反应 发生原电池反应
腐蚀过程无电流产生 有电流产生
金属直接被腐 较活泼金属被腐蚀
腐蚀速度 电化学腐蚀>化学腐蚀
联系 往往同时发生,但电化学腐蚀更普遍,危害更大
[继续探究] 进行P24[活动与探究],观察实验现象,回答有关问题:
1、铁粉中加入炭粉有何作用?两装置中均能形成原电池吗?
2、两装置中的实验现象有何不同?产生的现象说明什么问题?
[归纳小结2]5、吸氧腐蚀与析氢腐蚀的比较
实验编号 a b
所用电解质 NaCl CH3COOH
主要实验现象 右侧导管内液面上升 右侧导管内液面下降
原因分析 有气体参与反应(O2) 有气体生成(H2)
腐蚀类型形成条件 发生吸氧腐蚀水膜酸性很弱或呈中性 发生析氢腐蚀水膜酸性较强
电极反应式 正极 O2+2H2O+4e-=4OH- 2H++2e-=H2↑
负极 Fe - 2e- = Fe2+
电池总反应 2Fe+O2+2H2O=2Fe(OH)2 Fe+2H+=Fe2++H2 ↑
溶液中反应(铁锈的生成) Fe2++2OH-= Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O
出现的频率 较高 较低
[交流与讨论]P25哪些因素影响了金属腐蚀的快慢呢
1、相对于在内河行驶的轮船来说,海轮更容易被腐蚀。
2、1910年遗留在南极的食品罐头盒,其表面至今很少有铁锈出现。
3、用于连接铜板的铁螺丝容易生锈。
4、当化工厂排出的废气为酸性时,工厂附近的铁制品容易生锈。
6、金属腐蚀快慢的判断
(一)对于不同的金属而言:与金属的活泼性有关,一般地,活泼性越强的金属,越__容易_______被腐蚀。
(二)对于同种金属而言:
与引起腐蚀的原因有关:一般说来,电解原理引起的腐蚀 _>___原电池原理引起的腐蚀__>___化学腐蚀 __>__有防腐措施的腐蚀
(2) 与介质条件有关:一般说来
同种金属的腐蚀在强电解质中__>___弱电解质中 __>__非电解质中
(3)与构成微电池两极的材料有关:
两极材料的活动性差别越大,较活泼金属被腐蚀的速度越 快 。
(4)与环境温度有关,温度越高,金属腐蚀速度越 快 。
注意:在钢铁的腐蚀过程中,其电化学腐蚀更严重,在电化学腐蚀中,吸氧腐蚀更普遍。
六、板书设计
金属的电化学腐蚀
1金属的腐蚀
2金属的化学腐蚀
3金属的电化学腐蚀
4、金属的化学腐蚀与电化学腐蚀比较
金属腐蚀的实质 金属原子失去电子被氧化而消耗的过程:M-ne-=Mn+
金属的腐蚀 种类 化学腐蚀 电化学腐蚀
原理 金属和其它物质直接接触发生氧化还原反应而引起的腐蚀 不纯金属或合金发生原电池反应,使较活泼的金属失电子被氧化而引起的腐蚀
区别 直接发生氧化还原反应 发生原电池反应
腐蚀过程无电流产生 有电流产生
金属直接被腐 较活泼金属被腐蚀
腐蚀速度 电化学腐蚀>化学腐蚀
联系 往往同时发生,但电化学腐蚀更普遍,危害更大
5、吸氧腐蚀与析氢腐蚀的比较
实验编号 a b
所用电解质 NaCl CH3COOH
主要实验现象 右侧导管内液面上升 右侧导管内液面下降
原因分析 有气体参与反应(O2) 有气体生成(H2)
腐蚀类型形成条件 发生吸氧腐蚀水膜酸性很弱或呈中性 发生析氢腐蚀水膜酸性较强
电极反应式 正极 O2+2H2O+4e-=4OH- 2H++2e-=H2↑
负极 Fe - 2e- = Fe2+
电池总反应 2Fe+O2+2H2O=2Fe(OH)2 Fe+2H+=Fe2++H2 ↑
溶液中反应(铁锈的生成) Fe2++2OH-= Fe(OH)2 4Fe(OH)2+O2+2H2O=4Fe(OH)32Fe(OH)3==Fe2O3·nH2O+(3-n)H2O
出现的频率 较高 较低
6、金属腐蚀快慢的判断
七、课后练习
A类:X、Y、Z、M代表四种金属元素,金属X和Z用导线连接放入稀H2SO4中时,X溶解,Z极上有H2放出,若电解Y2+和Z2+共存的溶液时,Y先析出,又知M2+的氧化性强于Y2+。则这四种金属的活动性由强到弱的顺序为( A )
A.X>Z>Y>M B.X>Y>Z>M
C.M>Z>X>Y D.X>Z>M>Y
B类:4.钢铁发生电化学腐蚀时,负极上发生的反应是( C )
A.2H2O+2e-====H2↑+2OH- B.O2+2H2O+4e-====4OH-
C.Fe-2e-====Fe2+ D.4OH--4e-====2H2O+O2↑
C类:下列叙述不正确的是( C )
A.金属的电化学腐蚀比化学腐蚀更普通 B.钢铁在干燥空气里不易被腐蚀
C.用铝质铆钉铆接铁板,铝铆钉易被腐蚀 D.原电池中电子由正极流入负极
同课章节目录
