课题2 溶解度 质量守恒定律 同步练习卷(含解析)
文档属性
| 名称 | 课题2 溶解度 质量守恒定律 同步练习卷(含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 109.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-27 00:00:00 | ||
图片预览


文档简介
人教版九年级下册《9.2 溶解度》同步练习卷
一.选择题(共15小题,满分45分,每小题3分)
1.(3分)下列有关溶液的说法正确的是( )
A.溶液的上层浓度小,下层浓度大
B.溶液一定是均一、稳定、无色、透明的液体
C.某物质的饱和溶液就是不能再溶解任何物质的溶液
D.物质在溶解时,通常有放热或吸热的现象出现
2.(3分)下列说法正确的是( )
A.向一定温度下的饱和溶液中添加溶质后其溶质质量分数增大
B.饱和溶液降温析出晶体后的溶液仍为饱和溶液
C.从50g10%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数为1%
D.在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和溶液中含X、Y两种物质的质量相等
3.(3分)能证实A物质的溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃有A晶体析出
B.蒸发掉10克水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20℃时,向上述溶液中加入少量A晶体,溶液质量不变
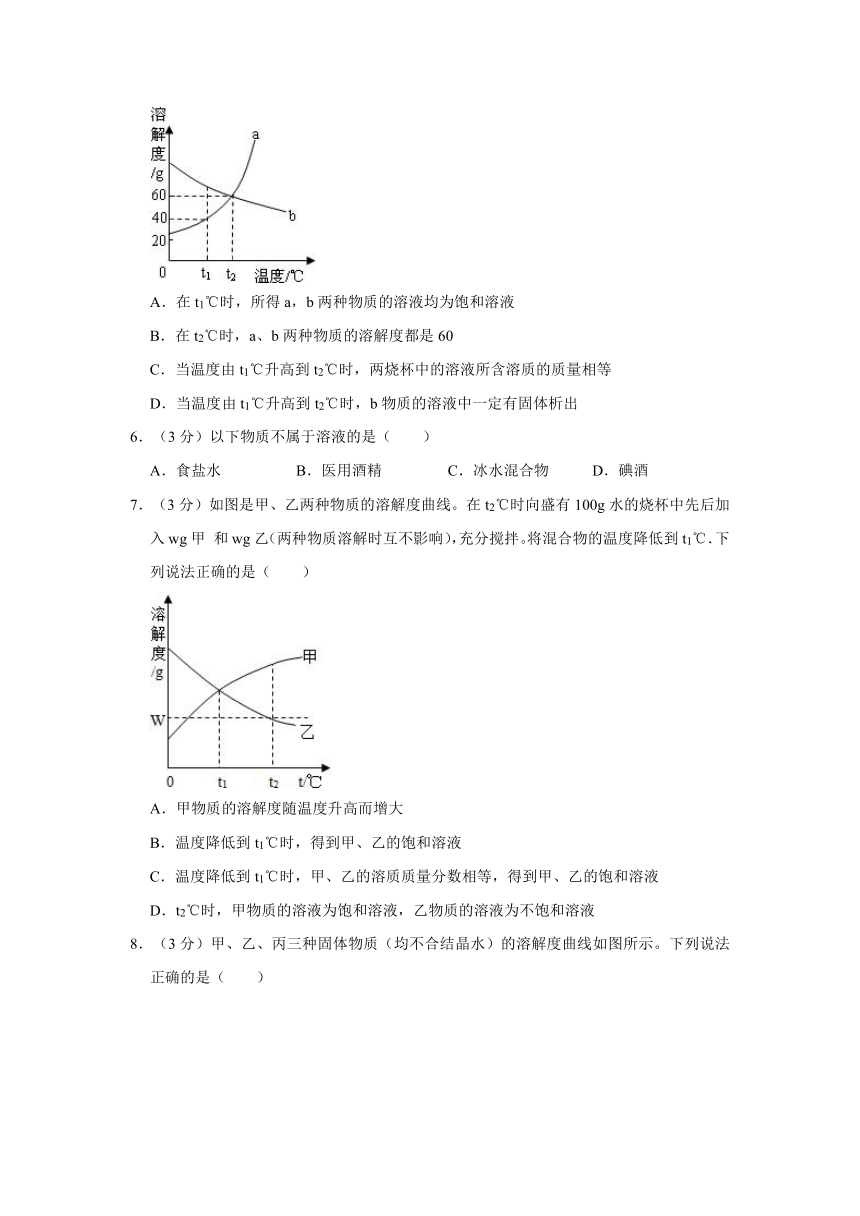
4.(3分)若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
5.(3分)如图是a、b两种固体物质的溶解度曲线.T1℃时,在两个烧杯中分别加入a、b两种物质各60 g后,再分别加入100 g水,充分搅拌.下列叙述正确的是( )
A.在t1℃时,所得a,b两种物质的溶液均为饱和溶液
B.在t2℃时,a、b两种物质的溶解度都是60
C.当温度由t1℃升高到t2℃时,两烧杯中的溶液所含溶质的质量相等
D.当温度由t1℃升高到t2℃时,b物质的溶液中一定有固体析出
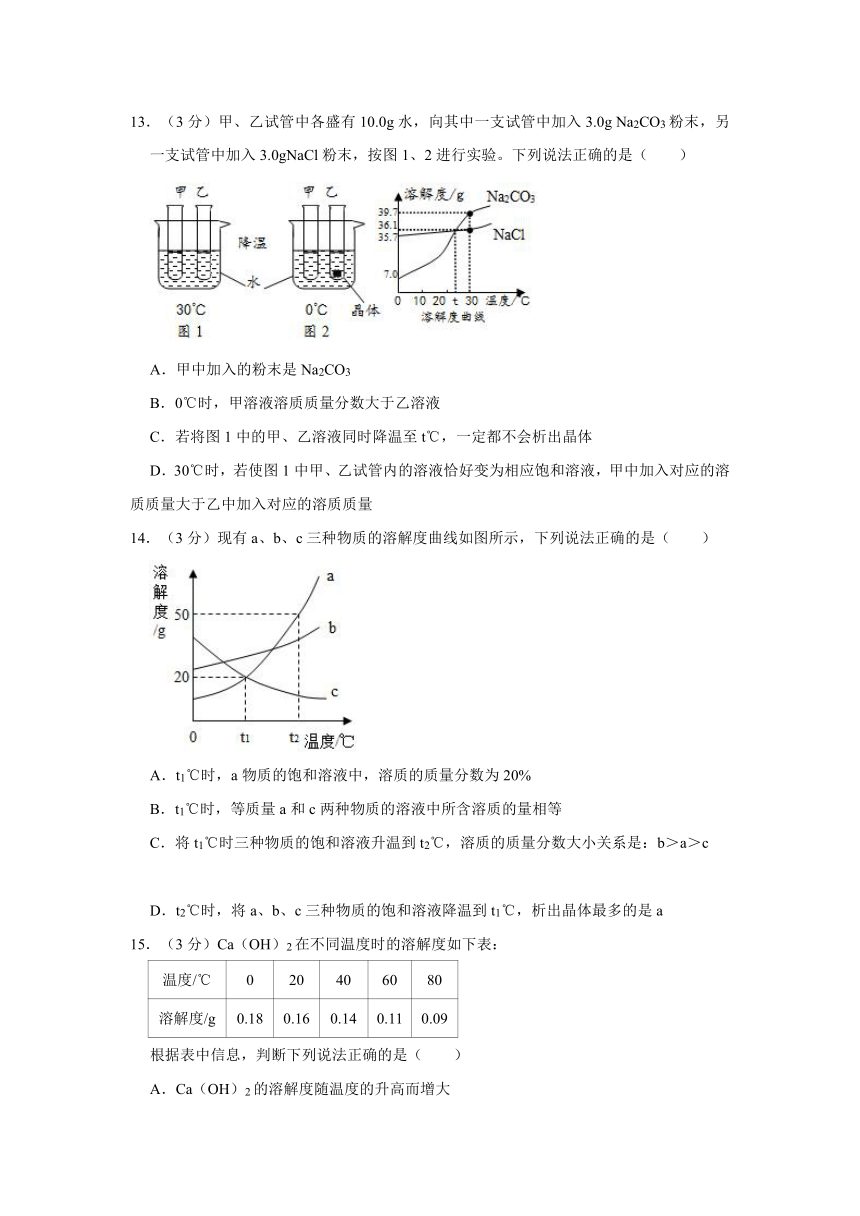
6.(3分)以下物质不属于溶液的是( )
A.食盐水 B.医用酒精 C.冰水混合物 D.碘酒
7.(3分)如图是甲、乙两种物质的溶解度曲线。在t2℃时向盛有100g水的烧杯中先后加入wg甲 和wg乙(两种物质溶解时互不影响),充分搅拌。将混合物的温度降低到t1℃.下列说法正确的是( )
A.甲物质的溶解度随温度升高而增大
B.温度降低到t1℃时,得到甲、乙的饱和溶液
C.温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的饱和溶液
D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
8.(3分)甲、乙、丙三种固体物质(均不合结晶水)的溶解度曲线如图所示。下列说法正确的是( )
A.甲和丙的溶解度都随温度的升高而增大
B.三种物质的溶解度大小关系为:甲>乙>丙
C.甲、乙两种物质的饱和溶液降温时,析出晶体最多的一定是甲
D.三种物质的饱和溶液从t2℃降到t1℃,所得溶液溶质质量分数的大小关系为:乙>甲>丙
9.(3分)有关溶液的说法正确的是( )
A.溶液都是无色的
B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量
D.溶液都是均一、稳定的混合物
10.(3分)生活中处处有化学.下列说法正确的是( )
A.喝了汽水会打嗝,说明压强减小气体的溶解度减小
B.住房失火,消防队员用水扑灭,是为了降低可燃性的着火点
C.常见的铁合金有生铁和钢,其中钢的含碳量较高
D.发现家中的燃气泄漏时,要立即关闭燃气阀门并打开门窗通风
11.(3分)下列方法中一定能将饱和溶液转变成不饱和溶液的是( )
A.降低温度 B.增加溶剂 C.充分搅拌 D.增加溶质
12.(3分)啤酒内溶有一定量的CO2气体,打开瓶盖时,你会发现啤酒会自动喷出来.喝了啤酒后又常常会打嗝,这说明气体在水中的溶解度与温度和压强有关.下列关于气体溶解度的说法正确的是( )
A.压强减小,气体的溶解度增大
B.压强减小,气体的溶解度减小
C.温度升高,气体的溶解度减小
D.温度降低,气体的溶解度减小
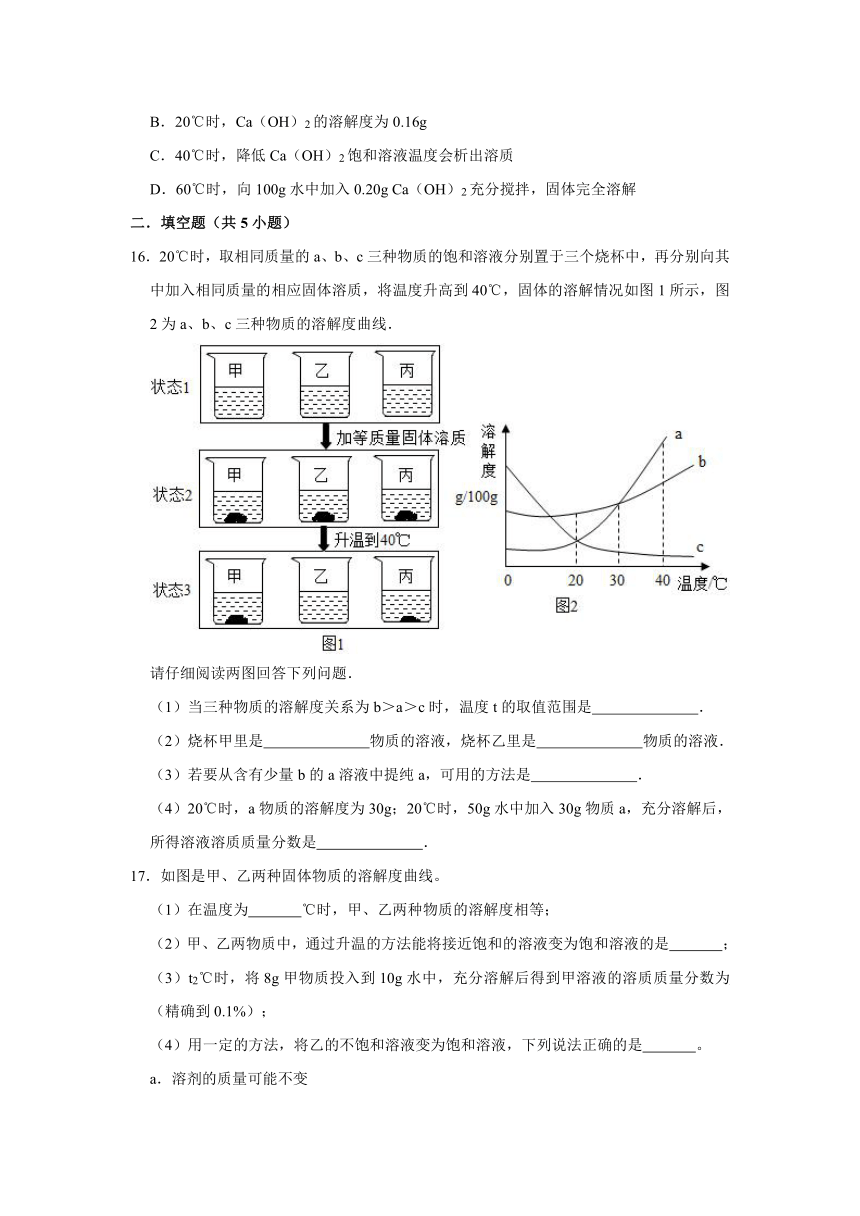
13.(3分)甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0gNaCl粉末,按图1、2进行实验。下列说法正确的是( )
A.甲中加入的粉末是Na2CO3
B.0℃时,甲溶液溶质质量分数大于乙溶液
C.若将图1中的甲、乙溶液同时降温至t℃,一定都不会析出晶体
D.30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
14.(3分)现有a、b、c三种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,a物质的饱和溶液中,溶质的质量分数为20%
B.t1℃时,等质量a和c两种物质的溶液中所含溶质的量相等
C.将t1℃时三种物质的饱和溶液升温到t2℃,溶质的质量分数大小关系是:b>a>c
D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是a
15.(3分)Ca(OH)2在不同温度时的溶解度如下表:
温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法正确的是( )
A.Ca(OH)2的溶解度随温度的升高而增大
B.20℃时,Ca(OH)2的溶解度为0.16g
C.40℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D.60℃时,向100g水中加入0.20g Ca(OH)2充分搅拌,固体完全溶解
二.填空题(共5小题)
16.20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示,图2为a、b、c三种物质的溶解度曲线.
请仔细阅读两图回答下列问题.
(1)当三种物质的溶解度关系为b>a>c时,温度t的取值范围是 .
(2)烧杯甲里是 物质的溶液,烧杯乙里是 物质的溶液.
(3)若要从含有少量b的a溶液中提纯a,可用的方法是 .
(4)20℃时,a物质的溶解度为30g;20℃时,50g水中加入30g物质a,充分溶解后,所得溶液溶质质量分数是 .
17.如图是甲、乙两种固体物质的溶解度曲线。
(1)在温度为 ℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,通过升温的方法能将接近饱和的溶液变为饱和溶液的是 ;
(3)t2℃时,将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数为 (精确到0.1%);
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,下列说法正确的是 。
a.溶剂的质量可能不变
b.溶质质量分数一定变大
c.溶液的质量可能不变
d.溶质的质量一定变大。
18.如图是A、B、C三种固体物质的溶解度随温度变化的曲线图。根据图回答:
(1)t3℃时,50g水中加50g A物质形成溶液的质量为 。
(2)要将t3℃时A、B、C三种物质的饱和溶液降温到t1℃时三种溶液中溶质的质量分数由大到小的顺序是 。
19.A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答下列问题。
(1)T1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)当温度在t1℃~t3℃之间时,A物质与B物质 (填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
(3)将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是 .
(4)t3℃时,A物质饱和溶液中溶质与溶剂的质量比为 (填最简整数比)。
(5)t3℃时,用等质量的A、B、C三种固体物质配成饱和溶液,需要水的质量最多的是 。
20.根据如图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的 (选填“饱和”或“不饱和”)溶液;
(2)这两种物质中,溶解度受温度变化影响较小的是 ;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是 (写一种即可);
(4)提纯混有少量硝酸钾的氯化钠,采用的方法是 (选填“蒸发结晶”或“降温结晶”)。
人教版九年级下册《9.2 溶解度》同步练习卷
参考答案与试题解析
一.选择题(共15小题,满分45分,每小题3分)
1.(3分)下列有关溶液的说法正确的是( )
A.溶液的上层浓度小,下层浓度大
B.溶液一定是均一、稳定、无色、透明的液体
C.某物质的饱和溶液就是不能再溶解任何物质的溶液
D.物质在溶解时,通常有放热或吸热的现象出现
【解答】解:A、溶液具有均一性,溶液的上层浓度和下层浓度一样大,故A错;
B、溶液可以有颜色,硫酸铜溶液是蓝色,故B错;
C、某物质的饱和溶液就是不能再溶解该物质的溶液,故C错;
D、根据物质溶于水,有的放出热量,有的吸收热量,故D正确。
故选:D。
2.(3分)下列说法正确的是( )
A.向一定温度下的饱和溶液中添加溶质后其溶质质量分数增大
B.饱和溶液降温析出晶体后的溶液仍为饱和溶液
C.从50g10%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数为1%
D.在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和溶液中含X、Y两种物质的质量相等
【解答】解:A、饱和溶液中添加该种溶质不会再溶解,故A错误;
B、析出晶体后的溶液一定是饱和溶液,故B正确;
C、由于溶液是均一的,从50g10%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数仍为10%,故C错误;
D、则在该温度下X、Y的饱和溶液中溶质质量分数相等,但溶质不一定相等,因为溶液质量不知道,故D错误。
故选:B。
3.(3分)能证实A物质的溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃有A晶体析出
B.蒸发掉10克水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20℃时,向上述溶液中加入少量A晶体,溶液质量不变
【解答】解:饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液。
A、接近饱和的A溶液,降温至10℃时也可能是有晶体析出,故不能说明20℃的A溶液是饱和溶液;
B、蒸发10g水有晶体析出,原溶液可能是饱和溶液,也可能是接近饱和的溶液;故不能说明20℃的A溶液是饱和溶液;
C、由于物质的溶解度一般随着温度的升高而增大,加热到30℃时,一定能溶解A物质,故不能说明20℃的A溶液是饱和溶液;
D、饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液;20℃时,向上述溶液中加入少量A晶体,溶液质量不变,能说明20℃的A溶液是饱和溶液。
故选:D。
4.(3分)若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
【解答】解:研究温度对食盐溶解快慢的影响,可选用甲与丙两个装置进行对照实验,
故选:C。
5.(3分)如图是a、b两种固体物质的溶解度曲线.T1℃时,在两个烧杯中分别加入a、b两种物质各60 g后,再分别加入100 g水,充分搅拌.下列叙述正确的是( )
A.在t1℃时,所得a,b两种物质的溶液均为饱和溶液
B.在t2℃时,a、b两种物质的溶解度都是60
C.当温度由t1℃升高到t2℃时,两烧杯中的溶液所含溶质的质量相等
D.当温度由t1℃升高到t2℃时,b物质的溶液中一定有固体析出
【解答】解:A、根据曲线可知,在t1℃时物质a的溶解度为40g,物质b的溶解度大于60g,因此,在t1℃时“两个烧杯中分别加入a、b两种物质各60 g后,再分别加入100 g水,充分搅拌”,盛放物质a的烧杯内固体有20g剩余溶液为饱和溶液,而盛放物质b的烧杯内固体全部溶解且溶液为不饱和溶液。所以均为饱和溶液的说法是错误的;
B、在t2℃时,两条曲线将于溶解度为60g的点,表明此时a、b两种物质的溶解度都是60g.物质的溶解度的单位为g,该选项中的溶解度数值没有单位,说法是错误的;
C、当温度由t1℃升高到t2℃时,a、b两种物质的溶解度都是60g,此时两溶液都恰好成为饱和溶液,因此两溶液的溶质质量分数相等的说法是正确的;
D、当温度由t1℃升高到t2℃时,随温度升高b物质的溶解度减小,至t2℃时100g水溶解60gb恰好成为饱和溶液,所以溶液中一定有固体析出的说法是错误的。
故选:C。
6.(3分)以下物质不属于溶液的是( )
A.食盐水 B.医用酒精 C.冰水混合物 D.碘酒
【解答】解:冰水混合物是水的两种状态混合,事实上只含有水着一种物质,属于纯净物,故不是溶液。
故选:C。
7.(3分)如图是甲、乙两种物质的溶解度曲线。在t2℃时向盛有100g水的烧杯中先后加入wg甲 和wg乙(两种物质溶解时互不影响),充分搅拌。将混合物的温度降低到t1℃.下列说法正确的是( )
A.甲物质的溶解度随温度升高而增大
B.温度降低到t1℃时,得到甲、乙的饱和溶液
C.温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的饱和溶液
D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
【解答】解:A、由溶解度曲线不难看出,甲物质的溶解度随温度的升高而增大,故A说法正确;
B、在t1℃时,甲和乙的溶解度都大于w克,当把溶液降低到t1℃时,甲和乙仍为不饱和溶液,故B错;
C、在t2℃时,乙的溶解度是w克,而甲的溶解度大于w克,因此在t2℃时往盛有100g水的烧杯中先后加入wg甲和wg乙,甲形成的是不饱和溶液,而乙恰好形成饱和溶液,温度降低到t1℃时,在t1℃时,甲和乙的溶解度都大于w克,当把溶液降低到t1℃时,甲和乙都为不饱和溶液,溶解的溶质和溶剂质量都相等,所以溶质质量分数也相等,但所得溶液都是不饱和溶液,故C错;
D、t2℃时,甲物质的溶液为不饱和溶液,乙物质的溶液为饱和溶液,故D错。
故选:A。
8.(3分)甲、乙、丙三种固体物质(均不合结晶水)的溶解度曲线如图所示。下列说法正确的是( )
A.甲和丙的溶解度都随温度的升高而增大
B.三种物质的溶解度大小关系为:甲>乙>丙
C.甲、乙两种物质的饱和溶液降温时,析出晶体最多的一定是甲
D.三种物质的饱和溶液从t2℃降到t1℃,所得溶液溶质质量分数的大小关系为:乙>甲>丙
【解答】解:A、丙的溶解度随着温度升高而减小,该选项说法不正确;
B、不知道温度范围,不能比较溶解度大小,该选项说法不正确;
C、不知道饱和溶液质量,不能比较析出晶体质量大小,该选项说法不正确;
D、三种物质的饱和溶液从t2℃降到t1℃,甲、乙仍然是饱和溶液,丙不能不饱和溶液,由于t1℃时乙的溶解度大于甲,因此乙的质量分数比甲大,由于甲在t1℃时的溶解度大于丙在t2℃时的溶解度,因此甲的质量分数大于丙,所得溶液溶质质量分数的大小关系为:乙>甲>丙,该选项说法正确。
故选:D。
9.(3分)有关溶液的说法正确的是( )
A.溶液都是无色的
B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量
D.溶液都是均一、稳定的混合物
【解答】解:A、溶液不一定都是无色的,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的;故选项说法错误。
B、稀溶液不一定是不饱和溶液,也可能是饱和溶液,如氢氧化钙的饱和溶液为稀溶液,故选项说法错误。
C、固体溶解时不一定都放出热量,也可能吸热,故选项说法错误。
D、溶液的本质特征是均一性、稳定性,属于混合溶液都是均一、稳定的混合物,故选项说法正确。
故选:D。
10.(3分)生活中处处有化学.下列说法正确的是( )
A.喝了汽水会打嗝,说明压强减小气体的溶解度减小
B.住房失火,消防队员用水扑灭,是为了降低可燃性的着火点
C.常见的铁合金有生铁和钢,其中钢的含碳量较高
D.发现家中的燃气泄漏时,要立即关闭燃气阀门并打开门窗通风
【解答】解:A、喝了汽水会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,故选项说法错误。
B、住房失火,消防队员用水扑灭,是利用了使温度解降到着火点以下的灭火原理,故选项说法错误。
C、常见的铁合金有生铁和钢,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,其中生铁的含碳量较高,故选项说法错误。
D、燃气与空气混合遇明火、静电、电火花或加热易发生爆炸,关闭阀门、开窗通风,可以稀释燃气,防止发生燃烧或爆炸,故选项说法正确。
故选:D。
11.(3分)下列方法中一定能将饱和溶液转变成不饱和溶液的是( )
A.降低温度 B.增加溶剂 C.充分搅拌 D.增加溶质
【解答】解:A、对于溶解度随温度升高而增大的物质升温可使饱和溶液变成不饱和溶液;对于溶解度随温度升高而减小的物质,降温可使饱和溶液变成不饱和溶液,所以降低温度不一定能成功,故A错误;
B、增加溶剂可使物质的饱和溶液变为不饱和溶液,故B正确;
C、充分搅拌不影响饱和溶液的状态,故C错误;
D、增加溶质依然是饱和溶液,故D错误。
故选:B。
12.(3分)啤酒内溶有一定量的CO2气体,打开瓶盖时,你会发现啤酒会自动喷出来.喝了啤酒后又常常会打嗝,这说明气体在水中的溶解度与温度和压强有关.下列关于气体溶解度的说法正确的是( )
A.压强减小,气体的溶解度增大
B.压强减小,气体的溶解度减小
C.温度升高,气体的溶解度减小
D.温度降低,气体的溶解度减小
【解答】解:气体的溶解度随温度升高而降低,随压强升高而升高。
A、压强减小,气体溶解度变小,故此选项错误。
B、压强减小,气体溶解度变小,故此选项正确。
C、温度升高,气体溶解度减小,故此选项正确。
D、温度降低,气体溶解度增大,故此选项错误。
故选:BC。
13.(3分)甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0gNaCl粉末,按图1、2进行实验。下列说法正确的是( )
A.甲中加入的粉末是Na2CO3
B.0℃时,甲溶液溶质质量分数大于乙溶液
C.若将图1中的甲、乙溶液同时降温至t℃,一定都不会析出晶体
D.30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
【解答】解:A、0℃时,氯化钠的溶解度大于碳酸钠的溶解度,乙烧杯底部有固体剩余,所以甲中加入的粉末是氯化钠,故A错误;
B、0℃时,氯化钠的溶解度大于碳酸钠的溶解度,乙烧杯底部有固体剩余,所以甲中加入的粉末是氯化钠,氯化钠全部溶解,碳酸钠有固体剩余,所以甲溶液溶质质量分数大于乙溶液,故B正确;
C、若将图1中的甲、乙溶液同时降温至t℃,溶解度相等,0℃时,氯化钠就全部溶解了,所以t℃时,一定都不会析出晶体,故C正确;
D、30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,但是饱和溶液的质量不能确定,所以甲中加入对应的溶质质量、乙中加入对应的溶质质量,是不能确定的,故D错误。
故选:BC。
14.(3分)现有a、b、c三种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,a物质的饱和溶液中,溶质的质量分数为20%
B.t1℃时,等质量a和c两种物质的溶液中所含溶质的量相等
C.将t1℃时三种物质的饱和溶液升温到t2℃,溶质的质量分数大小关系是:b>a>c
D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是a
【解答】解:A、t1℃时a的溶解度是20g,a物质的饱和溶液中,溶质的质量分数为:20g100g+20g×100%=16.7%,该选项说法不正确;
B、不知道溶液是否饱和,不能比较溶质质量大小,该选项说法不正确;
C、将t1℃时三种物质的饱和溶液升温到t2℃,ab变成不饱和溶液,由于b在t1℃时的溶解度大于a,因此b的质量分数大于a,由于c的溶解度减小,析出固体,因此a的质量分数大于c,溶质的质量分数大小关系是:b>a>c,该选项说法正确;
D、不知道饱和溶液的质量,不能比较析出晶体质量的大小,该选项说法不正确。
故选:C。
15.(3分)Ca(OH)2在不同温度时的溶解度如下表:
温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法正确的是( )
A.Ca(OH)2的溶解度随温度的升高而增大
B.20℃时,Ca(OH)2的溶解度为0.16g
C.40℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D.60℃时,向100g水中加入0.20g Ca(OH)2充分搅拌,固体完全溶解
【解答】解:
A、根据表中信息可知,氢氧化钙的溶解度随温度的升高而减小,故错;
B、20℃时,Ca(OH)2的溶解度0.16g,故对;
C、40℃时,降低Ca(OH)2饱和溶液温度,氢氧化钙的溶解度随温度的降低而增大,不会析出溶质,故错;
D、60℃时,Ca(OH)2的溶解度是0.11g,100g水中最多溶解0.11g,向100g水中加入0.20g Ca(OH)2充分搅拌,固体不能完全溶解,故错。
故选:B。
二.填空题(共5小题)
16.20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示,图2为a、b、c三种物质的溶解度曲线.
请仔细阅读两图回答下列问题.
(1)当三种物质的溶解度关系为b>a>c时,温度t的取值范围是 20℃<t<30℃ .
(2)烧杯甲里是 c 物质的溶液,烧杯乙里是 a 物质的溶液.
(3)若要从含有少量b的a溶液中提纯a,可用的方法是 降温结晶(或冷却热饱和溶液) .
(4)20℃时,a物质的溶解度为30g;20℃时,50g水中加入30g物质a,充分溶解后,所得溶液溶质质量分数是 23.1% .
【解答】解:(1)由溶解度曲线可知,三种物质的溶解度关系为b>a>c时的温度为t℃时,则t的取值范围是:20℃<t<30℃;
(2)由图1和图2可知:烧杯甲里是c物质的溶液,因为升温后c变多了;烧杯乙里是a物质的溶液,因为升温后,a全部溶解;
(3)a的溶解度受温度影响较大,b的溶解度受温度影响较小,所以若要从含有少量b的a溶液中提纯a,可用降温结晶或冷却热饱和溶液的方法;
(4)20℃时,a物质的溶解度为30g,即100g水中最多溶解30g的a;所以20℃时,50g水中加入30g物质a,充分溶解后,最多溶解15g,所得溶液溶质质量分数是
15g65g×100%≈23.1%;
故答案为:(1)20℃<t<30℃;(2)c;a;(3)降温结晶(或冷却热饱和溶液);(4)23.1%.
17.如图是甲、乙两种固体物质的溶解度曲线。
(1)在温度为 t1 ℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,通过升温的方法能将接近饱和的溶液变为饱和溶液的是 乙 ;
(3)t2℃时,将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数为 37.5% (精确到0.1%);
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,下列说法正确的是 ac 。
a.溶剂的质量可能不变
b.溶质质量分数一定变大
c.溶液的质量可能不变
d.溶质的质量一定变大。
【解答】解:(1)通过分析溶解度曲线可知,在温度为t1℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,乙物质的溶解度随温度的升高而减小,所以通过升温的方法能将接近饱和的溶液变为饱和溶液的是乙;
(3)t2℃时,甲物质的溶解度是60g,所以将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数是:6g10g+6g×100%=37.5%;
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,
a、升高温度,溶剂的质量可能不变,故a正确;
b、升高温度,溶质质量分数不变,故b错误;
c、升高温度,溶液的质量不变,故c正确;
d、升高温度,溶质的质量不变,故d错误。
故选:ac。
故答案为:(1)t1;
(2)乙;
(3)37.5%;
(4)ac。
18.如图是A、B、C三种固体物质的溶解度随温度变化的曲线图。根据图回答:
(1)t3℃时,50g水中加50g A物质形成溶液的质量为 90g 。
(2)要将t3℃时A、B、C三种物质的饱和溶液降温到t1℃时三种溶液中溶质的质量分数由大到小的顺序是 B>A>C 。
【解答】解:(1)通过分析溶解度曲线可知,t3℃时,A物质的溶解度是80g,所以50g水中加50g物质形成溶液的质量为90g;
(2)t1℃时,B物质的溶解度最大,A物质次之,C物质的溶解度随温度的降低而增大,不会析出晶体,应该按照t3℃时的溶解度计算,所以将t3℃时ABC三种物质的饱和溶液降温到t1℃时三种溶液中溶质的质量分数由大到小的顺序是:B>A>C。
故答案为:(1)90g;
(2)B>A>C。
19.A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答下列问题。
(1)T1℃时,A、B、C三种物质的溶解度由大到小的顺序是 C>B>A 。
(2)当温度在t1℃~t3℃之间时,A物质与B物质 能 (填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
(3)将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是 .
(4)t3℃时,A物质饱和溶液中溶质与溶剂的质量比为 1:2 (填最简整数比)。
(5)t3℃时,用等质量的A、B、C三种固体物质配成饱和溶液,需要水的质量最多的是 C 。
【解答】解:(1)从T1℃向上作垂线,与曲线的交点在上方的,溶解度就大,所以T1℃时,A、B、C三种物质的溶解度由大到小的顺序是:C>B>A;
(2)在t1℃~t3℃之间,A和B的溶解度有相等的时候,所以在t1℃~t3℃之间时,A物质与B物质能配制溶质质量分数相同的饱和溶液;
(3)A和B两种物质的饱和溶液分别由t2℃升温到t3℃,溶解度变大,由饱和变为不饱和,溶质质量分数不变,所以升温后还是B的溶质质量分数大于A的溶质质量分数,C物质升温后溶解度变小,溶质质量分数变小,所以C物质溶质质量分数最小;
(4)t3℃时,A物质的溶解度是50g,所以t3℃时,A物质饱和溶液中溶质与溶剂的质量比为:50g:100g=1:2;
(5)溶解度大的物质需要的水少,所以t3℃时,用等质量的A、B、C三种固体物质配成饱和溶液,需要水的质量最多的是C。
故答案为:(1)C>B>A;
(2)能;
(3)B;
(4)1:2;
(5)C。
20.根据如图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的 不饱和 (选填“饱和”或“不饱和”)溶液;
(2)这两种物质中,溶解度受温度变化影响较小的是 氯化钠 ;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是 加溶质或恒温蒸发溶剂 (写一种即可);
(4)提纯混有少量硝酸钾的氯化钠,采用的方法是 蒸发结晶 (选填“蒸发结晶”或“降温结晶”)。
【解答】解:(1)10℃时,硝酸钾的溶解度是20g,所以将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的不饱和溶液;
(2)这两种物质中,氯化钠的溶解度曲线较平缓,所以溶解度受温度变化影响较小的是氯化钠;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是:加溶质或恒温蒸发溶剂;
(4)硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以提纯混有少量硝酸钾的氯化钠,采用的方法是蒸发结晶。
故答案为:(1)不饱和;
(2)氯化钠;
(3)加溶质或恒温蒸发溶剂;
(4)蒸发结晶。
一.选择题(共15小题,满分45分,每小题3分)
1.(3分)下列有关溶液的说法正确的是( )
A.溶液的上层浓度小,下层浓度大
B.溶液一定是均一、稳定、无色、透明的液体
C.某物质的饱和溶液就是不能再溶解任何物质的溶液
D.物质在溶解时,通常有放热或吸热的现象出现
2.(3分)下列说法正确的是( )
A.向一定温度下的饱和溶液中添加溶质后其溶质质量分数增大
B.饱和溶液降温析出晶体后的溶液仍为饱和溶液
C.从50g10%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数为1%
D.在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和溶液中含X、Y两种物质的质量相等
3.(3分)能证实A物质的溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃有A晶体析出
B.蒸发掉10克水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20℃时,向上述溶液中加入少量A晶体,溶液质量不变
4.(3分)若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
5.(3分)如图是a、b两种固体物质的溶解度曲线.T1℃时,在两个烧杯中分别加入a、b两种物质各60 g后,再分别加入100 g水,充分搅拌.下列叙述正确的是( )
A.在t1℃时,所得a,b两种物质的溶液均为饱和溶液
B.在t2℃时,a、b两种物质的溶解度都是60
C.当温度由t1℃升高到t2℃时,两烧杯中的溶液所含溶质的质量相等
D.当温度由t1℃升高到t2℃时,b物质的溶液中一定有固体析出
6.(3分)以下物质不属于溶液的是( )
A.食盐水 B.医用酒精 C.冰水混合物 D.碘酒
7.(3分)如图是甲、乙两种物质的溶解度曲线。在t2℃时向盛有100g水的烧杯中先后加入wg甲 和wg乙(两种物质溶解时互不影响),充分搅拌。将混合物的温度降低到t1℃.下列说法正确的是( )
A.甲物质的溶解度随温度升高而增大
B.温度降低到t1℃时,得到甲、乙的饱和溶液
C.温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的饱和溶液
D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
8.(3分)甲、乙、丙三种固体物质(均不合结晶水)的溶解度曲线如图所示。下列说法正确的是( )
A.甲和丙的溶解度都随温度的升高而增大
B.三种物质的溶解度大小关系为:甲>乙>丙
C.甲、乙两种物质的饱和溶液降温时,析出晶体最多的一定是甲
D.三种物质的饱和溶液从t2℃降到t1℃,所得溶液溶质质量分数的大小关系为:乙>甲>丙
9.(3分)有关溶液的说法正确的是( )
A.溶液都是无色的
B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量
D.溶液都是均一、稳定的混合物
10.(3分)生活中处处有化学.下列说法正确的是( )
A.喝了汽水会打嗝,说明压强减小气体的溶解度减小
B.住房失火,消防队员用水扑灭,是为了降低可燃性的着火点
C.常见的铁合金有生铁和钢,其中钢的含碳量较高
D.发现家中的燃气泄漏时,要立即关闭燃气阀门并打开门窗通风
11.(3分)下列方法中一定能将饱和溶液转变成不饱和溶液的是( )
A.降低温度 B.增加溶剂 C.充分搅拌 D.增加溶质
12.(3分)啤酒内溶有一定量的CO2气体,打开瓶盖时,你会发现啤酒会自动喷出来.喝了啤酒后又常常会打嗝,这说明气体在水中的溶解度与温度和压强有关.下列关于气体溶解度的说法正确的是( )
A.压强减小,气体的溶解度增大
B.压强减小,气体的溶解度减小
C.温度升高,气体的溶解度减小
D.温度降低,气体的溶解度减小
13.(3分)甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0gNaCl粉末,按图1、2进行实验。下列说法正确的是( )
A.甲中加入的粉末是Na2CO3
B.0℃时,甲溶液溶质质量分数大于乙溶液
C.若将图1中的甲、乙溶液同时降温至t℃,一定都不会析出晶体
D.30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
14.(3分)现有a、b、c三种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,a物质的饱和溶液中,溶质的质量分数为20%
B.t1℃时,等质量a和c两种物质的溶液中所含溶质的量相等
C.将t1℃时三种物质的饱和溶液升温到t2℃,溶质的质量分数大小关系是:b>a>c
D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是a
15.(3分)Ca(OH)2在不同温度时的溶解度如下表:
温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法正确的是( )
A.Ca(OH)2的溶解度随温度的升高而增大
B.20℃时,Ca(OH)2的溶解度为0.16g
C.40℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D.60℃时,向100g水中加入0.20g Ca(OH)2充分搅拌,固体完全溶解
二.填空题(共5小题)
16.20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示,图2为a、b、c三种物质的溶解度曲线.
请仔细阅读两图回答下列问题.
(1)当三种物质的溶解度关系为b>a>c时,温度t的取值范围是 .
(2)烧杯甲里是 物质的溶液,烧杯乙里是 物质的溶液.
(3)若要从含有少量b的a溶液中提纯a,可用的方法是 .
(4)20℃时,a物质的溶解度为30g;20℃时,50g水中加入30g物质a,充分溶解后,所得溶液溶质质量分数是 .
17.如图是甲、乙两种固体物质的溶解度曲线。
(1)在温度为 ℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,通过升温的方法能将接近饱和的溶液变为饱和溶液的是 ;
(3)t2℃时,将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数为 (精确到0.1%);
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,下列说法正确的是 。
a.溶剂的质量可能不变
b.溶质质量分数一定变大
c.溶液的质量可能不变
d.溶质的质量一定变大。
18.如图是A、B、C三种固体物质的溶解度随温度变化的曲线图。根据图回答:
(1)t3℃时,50g水中加50g A物质形成溶液的质量为 。
(2)要将t3℃时A、B、C三种物质的饱和溶液降温到t1℃时三种溶液中溶质的质量分数由大到小的顺序是 。
19.A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答下列问题。
(1)T1℃时,A、B、C三种物质的溶解度由大到小的顺序是 。
(2)当温度在t1℃~t3℃之间时,A物质与B物质 (填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
(3)将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是 .
(4)t3℃时,A物质饱和溶液中溶质与溶剂的质量比为 (填最简整数比)。
(5)t3℃时,用等质量的A、B、C三种固体物质配成饱和溶液,需要水的质量最多的是 。
20.根据如图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的 (选填“饱和”或“不饱和”)溶液;
(2)这两种物质中,溶解度受温度变化影响较小的是 ;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是 (写一种即可);
(4)提纯混有少量硝酸钾的氯化钠,采用的方法是 (选填“蒸发结晶”或“降温结晶”)。
人教版九年级下册《9.2 溶解度》同步练习卷
参考答案与试题解析
一.选择题(共15小题,满分45分,每小题3分)
1.(3分)下列有关溶液的说法正确的是( )
A.溶液的上层浓度小,下层浓度大
B.溶液一定是均一、稳定、无色、透明的液体
C.某物质的饱和溶液就是不能再溶解任何物质的溶液
D.物质在溶解时,通常有放热或吸热的现象出现
【解答】解:A、溶液具有均一性,溶液的上层浓度和下层浓度一样大,故A错;
B、溶液可以有颜色,硫酸铜溶液是蓝色,故B错;
C、某物质的饱和溶液就是不能再溶解该物质的溶液,故C错;
D、根据物质溶于水,有的放出热量,有的吸收热量,故D正确。
故选:D。
2.(3分)下列说法正确的是( )
A.向一定温度下的饱和溶液中添加溶质后其溶质质量分数增大
B.饱和溶液降温析出晶体后的溶液仍为饱和溶液
C.从50g10%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数为1%
D.在一定温度下,物质X和Y具有相同溶解度,则在该温度下X、Y的饱和溶液中含X、Y两种物质的质量相等
【解答】解:A、饱和溶液中添加该种溶质不会再溶解,故A错误;
B、析出晶体后的溶液一定是饱和溶液,故B正确;
C、由于溶液是均一的,从50g10%的硫酸钠溶液中取出5g,这5g溶液中硫酸钠的质量分数仍为10%,故C错误;
D、则在该温度下X、Y的饱和溶液中溶质质量分数相等,但溶质不一定相等,因为溶液质量不知道,故D错误。
故选:B。
3.(3分)能证实A物质的溶液是20℃时的饱和溶液的事实是( )
A.降温到10℃有A晶体析出
B.蒸发掉10克水,有A晶体析出
C.加热到30℃时,再加A物质能继续溶解
D.20℃时,向上述溶液中加入少量A晶体,溶液质量不变
【解答】解:饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液。
A、接近饱和的A溶液,降温至10℃时也可能是有晶体析出,故不能说明20℃的A溶液是饱和溶液;
B、蒸发10g水有晶体析出,原溶液可能是饱和溶液,也可能是接近饱和的溶液;故不能说明20℃的A溶液是饱和溶液;
C、由于物质的溶解度一般随着温度的升高而增大,加热到30℃时,一定能溶解A物质,故不能说明20℃的A溶液是饱和溶液;
D、饱和溶液是指在一定温度下、一定量的溶剂里,不能再继续溶解这种溶质的溶液;20℃时,向上述溶液中加入少量A晶体,溶液质量不变,能说明20℃的A溶液是饱和溶液。
故选:D。
4.(3分)若研究温度对食盐溶解快慢的影响,在图中应选用哪两个装置进行对照实验( )
A.甲和乙 B.乙和丙 C.甲和丙 D.丙和丁
【解答】解:研究温度对食盐溶解快慢的影响,可选用甲与丙两个装置进行对照实验,
故选:C。
5.(3分)如图是a、b两种固体物质的溶解度曲线.T1℃时,在两个烧杯中分别加入a、b两种物质各60 g后,再分别加入100 g水,充分搅拌.下列叙述正确的是( )
A.在t1℃时,所得a,b两种物质的溶液均为饱和溶液
B.在t2℃时,a、b两种物质的溶解度都是60
C.当温度由t1℃升高到t2℃时,两烧杯中的溶液所含溶质的质量相等
D.当温度由t1℃升高到t2℃时,b物质的溶液中一定有固体析出
【解答】解:A、根据曲线可知,在t1℃时物质a的溶解度为40g,物质b的溶解度大于60g,因此,在t1℃时“两个烧杯中分别加入a、b两种物质各60 g后,再分别加入100 g水,充分搅拌”,盛放物质a的烧杯内固体有20g剩余溶液为饱和溶液,而盛放物质b的烧杯内固体全部溶解且溶液为不饱和溶液。所以均为饱和溶液的说法是错误的;
B、在t2℃时,两条曲线将于溶解度为60g的点,表明此时a、b两种物质的溶解度都是60g.物质的溶解度的单位为g,该选项中的溶解度数值没有单位,说法是错误的;
C、当温度由t1℃升高到t2℃时,a、b两种物质的溶解度都是60g,此时两溶液都恰好成为饱和溶液,因此两溶液的溶质质量分数相等的说法是正确的;
D、当温度由t1℃升高到t2℃时,随温度升高b物质的溶解度减小,至t2℃时100g水溶解60gb恰好成为饱和溶液,所以溶液中一定有固体析出的说法是错误的。
故选:C。
6.(3分)以下物质不属于溶液的是( )
A.食盐水 B.医用酒精 C.冰水混合物 D.碘酒
【解答】解:冰水混合物是水的两种状态混合,事实上只含有水着一种物质,属于纯净物,故不是溶液。
故选:C。
7.(3分)如图是甲、乙两种物质的溶解度曲线。在t2℃时向盛有100g水的烧杯中先后加入wg甲 和wg乙(两种物质溶解时互不影响),充分搅拌。将混合物的温度降低到t1℃.下列说法正确的是( )
A.甲物质的溶解度随温度升高而增大
B.温度降低到t1℃时,得到甲、乙的饱和溶液
C.温度降低到t1℃时,甲、乙的溶质质量分数相等,得到甲、乙的饱和溶液
D.t2℃时,甲物质的溶液为饱和溶液,乙物质的溶液为不饱和溶液
【解答】解:A、由溶解度曲线不难看出,甲物质的溶解度随温度的升高而增大,故A说法正确;
B、在t1℃时,甲和乙的溶解度都大于w克,当把溶液降低到t1℃时,甲和乙仍为不饱和溶液,故B错;
C、在t2℃时,乙的溶解度是w克,而甲的溶解度大于w克,因此在t2℃时往盛有100g水的烧杯中先后加入wg甲和wg乙,甲形成的是不饱和溶液,而乙恰好形成饱和溶液,温度降低到t1℃时,在t1℃时,甲和乙的溶解度都大于w克,当把溶液降低到t1℃时,甲和乙都为不饱和溶液,溶解的溶质和溶剂质量都相等,所以溶质质量分数也相等,但所得溶液都是不饱和溶液,故C错;
D、t2℃时,甲物质的溶液为不饱和溶液,乙物质的溶液为饱和溶液,故D错。
故选:A。
8.(3分)甲、乙、丙三种固体物质(均不合结晶水)的溶解度曲线如图所示。下列说法正确的是( )
A.甲和丙的溶解度都随温度的升高而增大
B.三种物质的溶解度大小关系为:甲>乙>丙
C.甲、乙两种物质的饱和溶液降温时,析出晶体最多的一定是甲
D.三种物质的饱和溶液从t2℃降到t1℃,所得溶液溶质质量分数的大小关系为:乙>甲>丙
【解答】解:A、丙的溶解度随着温度升高而减小,该选项说法不正确;
B、不知道温度范围,不能比较溶解度大小,该选项说法不正确;
C、不知道饱和溶液质量,不能比较析出晶体质量大小,该选项说法不正确;
D、三种物质的饱和溶液从t2℃降到t1℃,甲、乙仍然是饱和溶液,丙不能不饱和溶液,由于t1℃时乙的溶解度大于甲,因此乙的质量分数比甲大,由于甲在t1℃时的溶解度大于丙在t2℃时的溶解度,因此甲的质量分数大于丙,所得溶液溶质质量分数的大小关系为:乙>甲>丙,该选项说法正确。
故选:D。
9.(3分)有关溶液的说法正确的是( )
A.溶液都是无色的
B.稀溶液一定是不饱和溶液
C.固体溶解时都放出热量
D.溶液都是均一、稳定的混合物
【解答】解:A、溶液不一定都是无色的,有些溶液是带有颜色的,如硫酸铜溶液是蓝色的;故选项说法错误。
B、稀溶液不一定是不饱和溶液,也可能是饱和溶液,如氢氧化钙的饱和溶液为稀溶液,故选项说法错误。
C、固体溶解时不一定都放出热量,也可能吸热,故选项说法错误。
D、溶液的本质特征是均一性、稳定性,属于混合溶液都是均一、稳定的混合物,故选项说法正确。
故选:D。
10.(3分)生活中处处有化学.下列说法正确的是( )
A.喝了汽水会打嗝,说明压强减小气体的溶解度减小
B.住房失火,消防队员用水扑灭,是为了降低可燃性的着火点
C.常见的铁合金有生铁和钢,其中钢的含碳量较高
D.发现家中的燃气泄漏时,要立即关闭燃气阀门并打开门窗通风
【解答】解:A、喝了汽水会打嗝,是由于胃内的温度高二氧化碳的溶解度变小而导致的,故选项说法错误。
B、住房失火,消防队员用水扑灭,是利用了使温度解降到着火点以下的灭火原理,故选项说法错误。
C、常见的铁合金有生铁和钢,生铁是含碳量为2%~4.3%的铁合金,钢是含碳量为0.03%~2%的铁合金,其中生铁的含碳量较高,故选项说法错误。
D、燃气与空气混合遇明火、静电、电火花或加热易发生爆炸,关闭阀门、开窗通风,可以稀释燃气,防止发生燃烧或爆炸,故选项说法正确。
故选:D。
11.(3分)下列方法中一定能将饱和溶液转变成不饱和溶液的是( )
A.降低温度 B.增加溶剂 C.充分搅拌 D.增加溶质
【解答】解:A、对于溶解度随温度升高而增大的物质升温可使饱和溶液变成不饱和溶液;对于溶解度随温度升高而减小的物质,降温可使饱和溶液变成不饱和溶液,所以降低温度不一定能成功,故A错误;
B、增加溶剂可使物质的饱和溶液变为不饱和溶液,故B正确;
C、充分搅拌不影响饱和溶液的状态,故C错误;
D、增加溶质依然是饱和溶液,故D错误。
故选:B。
12.(3分)啤酒内溶有一定量的CO2气体,打开瓶盖时,你会发现啤酒会自动喷出来.喝了啤酒后又常常会打嗝,这说明气体在水中的溶解度与温度和压强有关.下列关于气体溶解度的说法正确的是( )
A.压强减小,气体的溶解度增大
B.压强减小,气体的溶解度减小
C.温度升高,气体的溶解度减小
D.温度降低,气体的溶解度减小
【解答】解:气体的溶解度随温度升高而降低,随压强升高而升高。
A、压强减小,气体溶解度变小,故此选项错误。
B、压强减小,气体溶解度变小,故此选项正确。
C、温度升高,气体溶解度减小,故此选项正确。
D、温度降低,气体溶解度增大,故此选项错误。
故选:BC。
13.(3分)甲、乙试管中各盛有10.0g水,向其中一支试管中加入3.0g Na2CO3粉末,另一支试管中加入3.0gNaCl粉末,按图1、2进行实验。下列说法正确的是( )
A.甲中加入的粉末是Na2CO3
B.0℃时,甲溶液溶质质量分数大于乙溶液
C.若将图1中的甲、乙溶液同时降温至t℃,一定都不会析出晶体
D.30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,甲中加入对应的溶质质量大于乙中加入对应的溶质质量
【解答】解:A、0℃时,氯化钠的溶解度大于碳酸钠的溶解度,乙烧杯底部有固体剩余,所以甲中加入的粉末是氯化钠,故A错误;
B、0℃时,氯化钠的溶解度大于碳酸钠的溶解度,乙烧杯底部有固体剩余,所以甲中加入的粉末是氯化钠,氯化钠全部溶解,碳酸钠有固体剩余,所以甲溶液溶质质量分数大于乙溶液,故B正确;
C、若将图1中的甲、乙溶液同时降温至t℃,溶解度相等,0℃时,氯化钠就全部溶解了,所以t℃时,一定都不会析出晶体,故C正确;
D、30℃时,若使图1中甲、乙试管内的溶液恰好变为相应饱和溶液,但是饱和溶液的质量不能确定,所以甲中加入对应的溶质质量、乙中加入对应的溶质质量,是不能确定的,故D错误。
故选:BC。
14.(3分)现有a、b、c三种物质的溶解度曲线如图所示,下列说法正确的是( )
A.t1℃时,a物质的饱和溶液中,溶质的质量分数为20%
B.t1℃时,等质量a和c两种物质的溶液中所含溶质的量相等
C.将t1℃时三种物质的饱和溶液升温到t2℃,溶质的质量分数大小关系是:b>a>c
D.t2℃时,将a、b、c三种物质的饱和溶液降温到t1℃,析出晶体最多的是a
【解答】解:A、t1℃时a的溶解度是20g,a物质的饱和溶液中,溶质的质量分数为:20g100g+20g×100%=16.7%,该选项说法不正确;
B、不知道溶液是否饱和,不能比较溶质质量大小,该选项说法不正确;
C、将t1℃时三种物质的饱和溶液升温到t2℃,ab变成不饱和溶液,由于b在t1℃时的溶解度大于a,因此b的质量分数大于a,由于c的溶解度减小,析出固体,因此a的质量分数大于c,溶质的质量分数大小关系是:b>a>c,该选项说法正确;
D、不知道饱和溶液的质量,不能比较析出晶体质量的大小,该选项说法不正确。
故选:C。
15.(3分)Ca(OH)2在不同温度时的溶解度如下表:
温度/℃
0
20
40
60
80
溶解度/g
0.18
0.16
0.14
0.11
0.09
根据表中信息,判断下列说法正确的是( )
A.Ca(OH)2的溶解度随温度的升高而增大
B.20℃时,Ca(OH)2的溶解度为0.16g
C.40℃时,降低Ca(OH)2饱和溶液温度会析出溶质
D.60℃时,向100g水中加入0.20g Ca(OH)2充分搅拌,固体完全溶解
【解答】解:
A、根据表中信息可知,氢氧化钙的溶解度随温度的升高而减小,故错;
B、20℃时,Ca(OH)2的溶解度0.16g,故对;
C、40℃时,降低Ca(OH)2饱和溶液温度,氢氧化钙的溶解度随温度的降低而增大,不会析出溶质,故错;
D、60℃时,Ca(OH)2的溶解度是0.11g,100g水中最多溶解0.11g,向100g水中加入0.20g Ca(OH)2充分搅拌,固体不能完全溶解,故错。
故选:B。
二.填空题(共5小题)
16.20℃时,取相同质量的a、b、c三种物质的饱和溶液分别置于三个烧杯中,再分别向其中加入相同质量的相应固体溶质,将温度升高到40℃,固体的溶解情况如图1所示,图2为a、b、c三种物质的溶解度曲线.
请仔细阅读两图回答下列问题.
(1)当三种物质的溶解度关系为b>a>c时,温度t的取值范围是 20℃<t<30℃ .
(2)烧杯甲里是 c 物质的溶液,烧杯乙里是 a 物质的溶液.
(3)若要从含有少量b的a溶液中提纯a,可用的方法是 降温结晶(或冷却热饱和溶液) .
(4)20℃时,a物质的溶解度为30g;20℃时,50g水中加入30g物质a,充分溶解后,所得溶液溶质质量分数是 23.1% .
【解答】解:(1)由溶解度曲线可知,三种物质的溶解度关系为b>a>c时的温度为t℃时,则t的取值范围是:20℃<t<30℃;
(2)由图1和图2可知:烧杯甲里是c物质的溶液,因为升温后c变多了;烧杯乙里是a物质的溶液,因为升温后,a全部溶解;
(3)a的溶解度受温度影响较大,b的溶解度受温度影响较小,所以若要从含有少量b的a溶液中提纯a,可用降温结晶或冷却热饱和溶液的方法;
(4)20℃时,a物质的溶解度为30g,即100g水中最多溶解30g的a;所以20℃时,50g水中加入30g物质a,充分溶解后,最多溶解15g,所得溶液溶质质量分数是
15g65g×100%≈23.1%;
故答案为:(1)20℃<t<30℃;(2)c;a;(3)降温结晶(或冷却热饱和溶液);(4)23.1%.
17.如图是甲、乙两种固体物质的溶解度曲线。
(1)在温度为 t1 ℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,通过升温的方法能将接近饱和的溶液变为饱和溶液的是 乙 ;
(3)t2℃时,将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数为 37.5% (精确到0.1%);
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,下列说法正确的是 ac 。
a.溶剂的质量可能不变
b.溶质质量分数一定变大
c.溶液的质量可能不变
d.溶质的质量一定变大。
【解答】解:(1)通过分析溶解度曲线可知,在温度为t1℃时,甲、乙两种物质的溶解度相等;
(2)甲、乙两物质中,乙物质的溶解度随温度的升高而减小,所以通过升温的方法能将接近饱和的溶液变为饱和溶液的是乙;
(3)t2℃时,甲物质的溶解度是60g,所以将8g甲物质投入到10g水中,充分溶解后得到甲溶液的溶质质量分数是:6g10g+6g×100%=37.5%;
(4)用一定的方法,将乙的不饱和溶液变为饱和溶液,
a、升高温度,溶剂的质量可能不变,故a正确;
b、升高温度,溶质质量分数不变,故b错误;
c、升高温度,溶液的质量不变,故c正确;
d、升高温度,溶质的质量不变,故d错误。
故选:ac。
故答案为:(1)t1;
(2)乙;
(3)37.5%;
(4)ac。
18.如图是A、B、C三种固体物质的溶解度随温度变化的曲线图。根据图回答:
(1)t3℃时,50g水中加50g A物质形成溶液的质量为 90g 。
(2)要将t3℃时A、B、C三种物质的饱和溶液降温到t1℃时三种溶液中溶质的质量分数由大到小的顺序是 B>A>C 。
【解答】解:(1)通过分析溶解度曲线可知,t3℃时,A物质的溶解度是80g,所以50g水中加50g物质形成溶液的质量为90g;
(2)t1℃时,B物质的溶解度最大,A物质次之,C物质的溶解度随温度的降低而增大,不会析出晶体,应该按照t3℃时的溶解度计算,所以将t3℃时ABC三种物质的饱和溶液降温到t1℃时三种溶液中溶质的质量分数由大到小的顺序是:B>A>C。
故答案为:(1)90g;
(2)B>A>C。
19.A、B、C三种固体物质(均不含结晶水)的溶解度曲线如图所示,请回答下列问题。
(1)T1℃时,A、B、C三种物质的溶解度由大到小的顺序是 C>B>A 。
(2)当温度在t1℃~t3℃之间时,A物质与B物质 能 (填“能”或“不能”)配制溶质质量分数相同的饱和溶液。
(3)将A、B、C三种物质的饱和溶液分别由t2℃升温到t3℃,所得溶液中溶质的质量分数最大的物质是 .
(4)t3℃时,A物质饱和溶液中溶质与溶剂的质量比为 1:2 (填最简整数比)。
(5)t3℃时,用等质量的A、B、C三种固体物质配成饱和溶液,需要水的质量最多的是 C 。
【解答】解:(1)从T1℃向上作垂线,与曲线的交点在上方的,溶解度就大,所以T1℃时,A、B、C三种物质的溶解度由大到小的顺序是:C>B>A;
(2)在t1℃~t3℃之间,A和B的溶解度有相等的时候,所以在t1℃~t3℃之间时,A物质与B物质能配制溶质质量分数相同的饱和溶液;
(3)A和B两种物质的饱和溶液分别由t2℃升温到t3℃,溶解度变大,由饱和变为不饱和,溶质质量分数不变,所以升温后还是B的溶质质量分数大于A的溶质质量分数,C物质升温后溶解度变小,溶质质量分数变小,所以C物质溶质质量分数最小;
(4)t3℃时,A物质的溶解度是50g,所以t3℃时,A物质饱和溶液中溶质与溶剂的质量比为:50g:100g=1:2;
(5)溶解度大的物质需要的水少,所以t3℃时,用等质量的A、B、C三种固体物质配成饱和溶液,需要水的质量最多的是C。
故答案为:(1)C>B>A;
(2)能;
(3)B;
(4)1:2;
(5)C。
20.根据如图中的硝酸钾和氯化钠的溶解度曲线,回答下列问题:
(1)10℃时,将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的 不饱和 (选填“饱和”或“不饱和”)溶液;
(2)这两种物质中,溶解度受温度变化影响较小的是 氯化钠 ;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是 加溶质或恒温蒸发溶剂 (写一种即可);
(4)提纯混有少量硝酸钾的氯化钠,采用的方法是 蒸发结晶 (选填“蒸发结晶”或“降温结晶”)。
【解答】解:(1)10℃时,硝酸钾的溶解度是20g,所以将15g硝酸钾加入到100g水中,充分溶解后,得到硝酸钾的不饱和溶液;
(2)这两种物质中,氯化钠的溶解度曲线较平缓,所以溶解度受温度变化影响较小的是氯化钠;
(3)20℃时,将接近饱和的KNO3溶液转化为该温度下的KNO3饱和溶液,可使用的方法是:加溶质或恒温蒸发溶剂;
(4)硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以提纯混有少量硝酸钾的氯化钠,采用的方法是蒸发结晶。
故答案为:(1)不饱和;
(2)氯化钠;
(3)加溶质或恒温蒸发溶剂;
(4)蒸发结晶。
同课章节目录
