江苏省南京市六校联考2020-2021学年高一下学期期末考试化学试题 Word版含答案
文档属性
| 名称 | 江苏省南京市六校联考2020-2021学年高一下学期期末考试化学试题 Word版含答案 |  | |
| 格式 | docx | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-27 23:16:41 | ||
图片预览



文档简介
南京市六校2020~2021学年度第二学期期末联考
高一化学试卷
本卷:共100分 考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷(选择题 共60分)
一、选择题:本题共20小题,每小题3分,共计60 分。每小题只有一个选项符合题意。
1.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列
做法不符合绿色化学理念的是
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应2CH2==CH2+O2 制备环氧乙烷
D.用反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O制备硫酸铜
2.化学与生活、生产、环境等密切相关。下列说法错误的是
A.棉、丝、毛都是天然有机高分子化合物
B.蛋白质、油脂、糖类一定条件下都能发生水解反应
C.煤的液化、石油的裂化和油脂的皂化都属于化学变化
D.向鸡蛋清溶液中加入硫酸铜产生沉淀,是蛋白质发生了变性
3.下列有关化学用语使用正确的是
A.乙酸的结构简式:
B.一氯甲烷的电子式:
C.丙烷分子的空间充填模型:
D.聚氯乙烯的结构简式:false
4.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,
分别向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量NaOH溶液:Na+、AlO2-、OH-、SO42-
B.加入过量氨水:NH、Al3+、OH-、SO42-
C.通入过量Cl2:Fe2+、H+、ClO-、SO42-
D.加入过量H2SO4 溶液:Fe2+、Na+、NO3-、SO42-
5.NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g D2O中含有的电子数目为9NA
B.标准状况下,11.2L SO3中含有分子数目为0.5NA
C.1molfalse中含有碳碳双键的数目为4NA
D.16.8gFe与足量的水蒸气完全反应转移的电子数目为0.8NA
3670300219710浓硫酸
酒精、乙酸
碎瓷片
饱和碳酸钠
浓硫酸
酒精、乙酸
碎瓷片
饱和碳酸钠
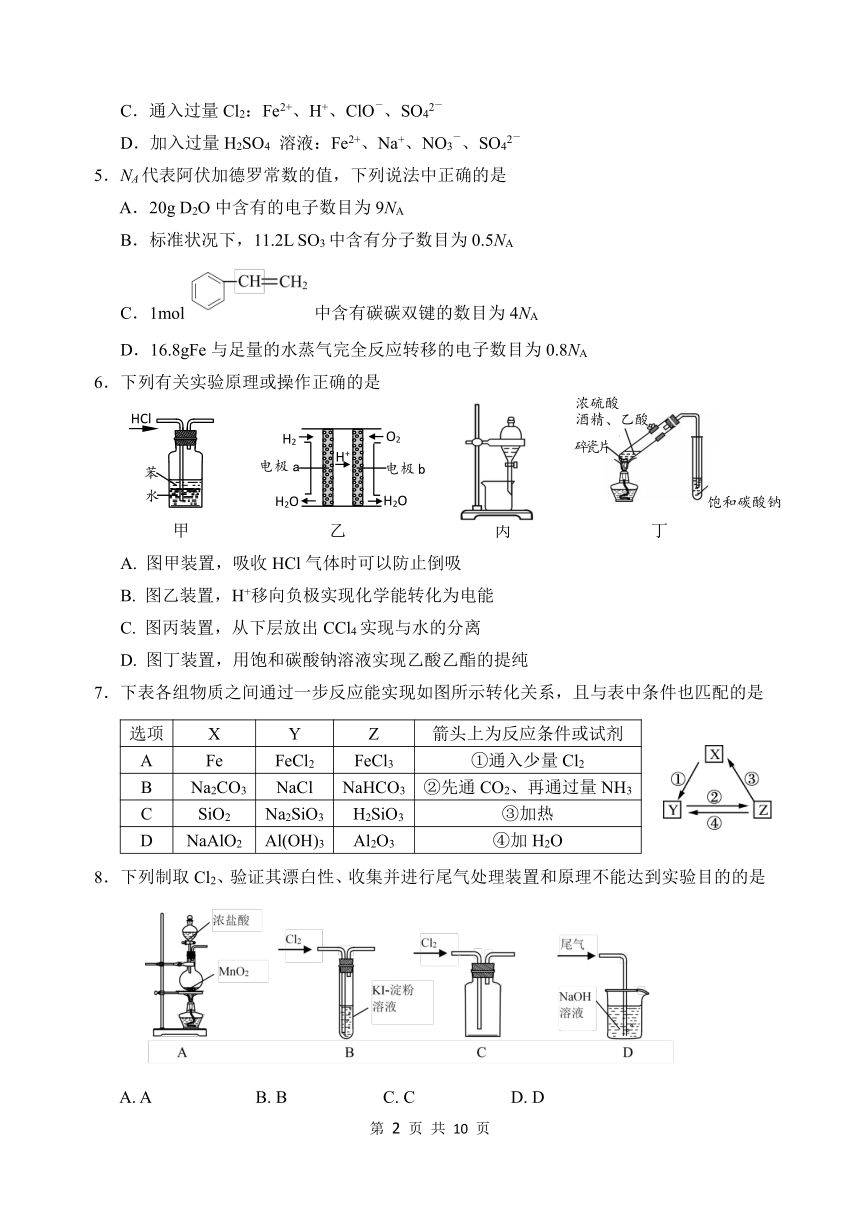
false6.下列有关实验原理或操作正确的是
26924088900苯
水
HCl
苯
水
HCl
1257300187960H2
O2
H2O
H+
H2O
电极a
电极b
H2
O2
H2O
H+
H2O
电极a
电极b
甲 乙 丙 丁
A. 图甲装置,吸收HCl气体时可以防止倒吸
B. 图乙装置,H+移向负极实现化学能转化为电能
C. 图丙装置,从下层放出CCl4实现与水的分离
D. 图丁装置,用饱和碳酸钠溶液实现乙酸乙酯的提纯
7.下表各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是
选项
X
Y
Z
箭头上为反应条件或试剂
A
Fe
FeCl2
FeCl3
①通入少量Cl2
B
Na2CO3
NaCl
NaHCO3
②先通CO2、再通过量NH3
C
SiO2
Na2SiO3
H2SiO3
③加热
D
NaAlO2
Al(OH)3
Al2O3
④加H2O
4318055880
下列制取Cl2、验证其漂白性、收集并进行尾气处理装置和原理不能达到实验目的的是
A. A B. B C. C D. D
9.下列表示对应化学反应的离子方程式正确的是
A.向Na2SO3中滴加稀HNO3溶液:SO+2H+=SO2↑+H2O
B.0.3 mol FeBr2与0.4 mol Cl2在溶液中反应:
8Cl2+6Fe2++10Br-=6Fe3++16Cl-+5Br2
C.用稀硝酸除去试管内壁银镜:Ag+2H++NO=Ag++NO2↑+H2O
D.酸性介质中KMnO4氧化H2O2:2MnO+2H2O2+8H+=2Mn2++3O2↑+6H2O
10.海水资源开发利用的部分过程如下图所示。下列说法正确的是
457200115570晒盐
盐卤
粗盐
溶液1
金属镁
沉淀剂
Mg(OH)2
海水
Br2
氧化剂
晒盐
盐卤
粗盐
溶液1
金属镁
沉淀剂
Mg(OH)2
海水
Br2
氧化剂
A.向盐卤中通入的氧化剂可能是SO2
B.工业生产中常选用NaOH作为沉淀剂
C.粗盐可采用除杂和重结晶等过程提纯
D.常用电解氢氧化镁的方法制备金属Mg
11.下列物质的制备过程中,涉及的反应原理及部分流程较为合理的是
18796022860
21653532385
2254251301753270250101600
338455013970026670080010
12.有机物结构可用“键线式”表示,如:CH3-CH=CH-CH3可简写为。松油醇具有紫丁香味,其酯类常用于香精调制,如图为松油醇的结构,以下关于它的说法正确的
405320552070A.能催化氧化成醛
B.分子式为C10H20O
C.与氢气加成后的产物有4种一氯化物
D.能发生加聚反应,所有C原子不可能共平面
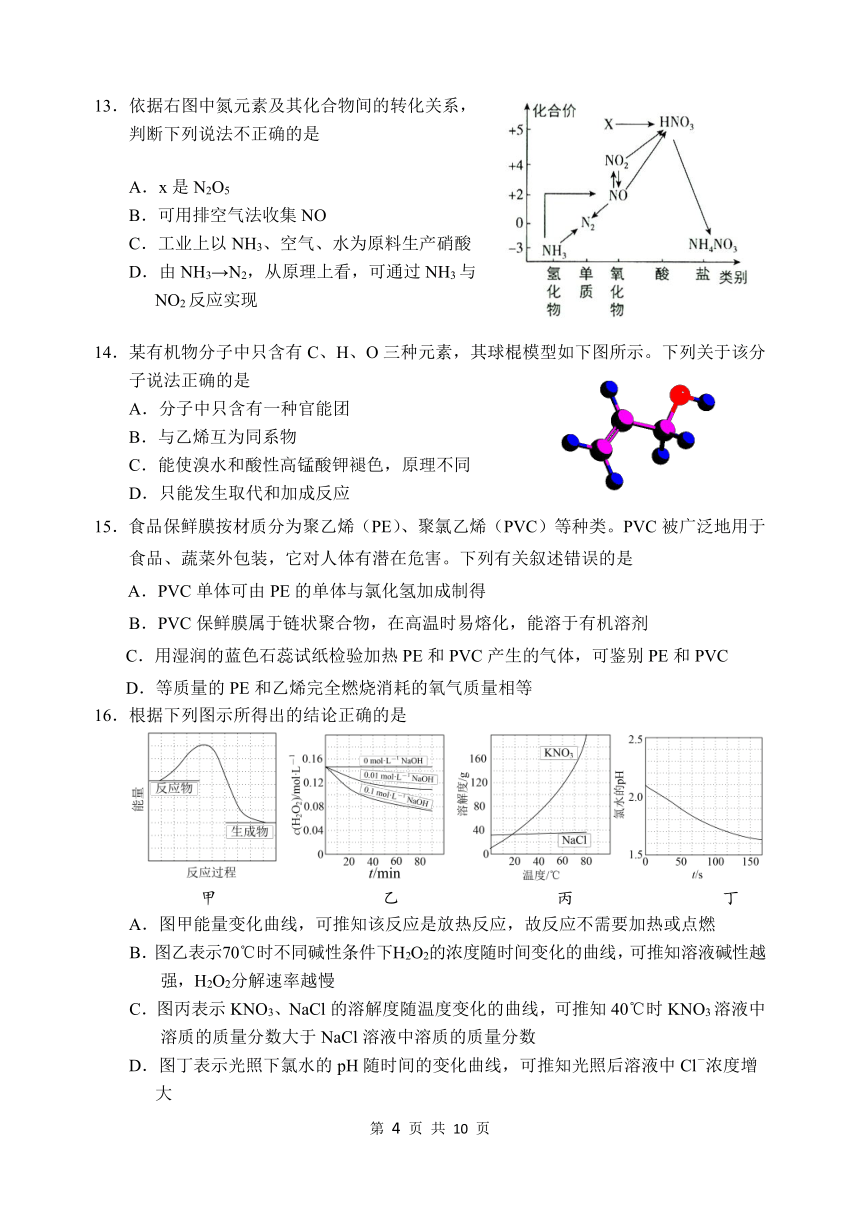
31146751651013.依据右图中氮元素及其化合物间的转化关系,
判断下列说法不正确的是
A.x是N2O5
B.可用排空气法收集NO
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,可通过NH3与
NO2反应实现
4288155290639514.某有机物分子中只含有C、H、O三种元素,其球棍模型如下图所示。下列关于该分子说法正确的是
A.分子中只含有一种官能团
B.与乙烯互为同系物
C.能使溴水和酸性高锰酸钾褪色,原理不同
D.只能发生取代和加成反应
15.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PVC被广泛地用于
食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述错误的是
A.PVC单体可由PE的单体与氯化氢加成制得
B.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于有机溶剂
C.用湿润的蓝色石蕊试纸检验加热PE和PVC产生的气体,可鉴别PE和PVC
D.等质量的PE和乙烯完全燃烧消耗的氧气质量相等
16.根据下列图示所得出的结论正确的是
false falsefalse
甲 乙 丙 丁
A.图甲能量变化曲线,可推知该反应是放热反应,故反应不需要加热或点燃
B.图乙表示70℃时不同碱性条件下H2O2的浓度随时间变化的曲线,可推知溶液碱性越强,H2O2分解速率越慢
C.图丙表示KNO3、NaCl的溶解度随温度变化的曲线,可推知40℃时KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数
D.图丁表示光照下氯水的pH随时间的变化曲线,可推知光照后溶液中Cl-浓度增大
17.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄色
说明氧化性:H2O2 > Fe3+
B
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中,溶液褪色
说明产物中含不饱和烃
C
将SO2气体通入溴水中,溴水褪色
说明SO2具有漂白性
D
淀粉与稀硫酸混合一段时间后,滴加银氨溶液并水浴加热,无银镜出现
说明淀粉没有水解
18.氢气、甲烷、乙醇等物质均可作为燃料电池的原料。燃料电池的基本组成为电极、电
解质、燃料和氧化剂。电池的能量利用率高,产物污染少。下列有关燃料电池的说法
不正确的是
A.上述燃料电池所用的电极材料不参加电极反应
B.氢氧燃料电池中,氢气应从电池的负极通入
C.乙醇燃料电池的电解质常用KOH,电池工作时负极周围pH增大
D.甲烷燃料电池的正极反应为:O2+2H2O+4e-=4OH-
19.取16.8 g NaHCO3固体,加热一段时间,将剩余固体分成四等份,分别取四份固体进行实验。下列能够说明NaHCO3固体已完全分解的是
A.加水溶解后向其中滴加酚酞,溶液变红
B.加水溶解后向其中滴加澄清石灰水,有白色沉淀产生
C.称量固体,继续加热,冷却后再次称量所得固体,质量不变
D.加入稍过量的盐酸,充分反应后将溶液蒸干,所得固体质量为2.925 g
20.为了测定铁铜合金的组成,将15.2 g铁、铜合金加入200 mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体4.48 L(标准状况下),并测得反应后溶液中H+的浓度为0.5 mol·L-1。若反应前后溶液的体积变化忽略不计,则下列判断正确的是
A.反应后的溶液中可继续溶解铁铜合金质量最多为1.9g
B.上述合金中铁与铜的质量之比为2:3
C.合金中,铁的质量分数为63.2%
D.原硝酸的物质的量浓度为c(HNO3)=4.5 mol·L-1
第Ⅱ卷(非选择题 共40分)
21.(10分)硫酸锌在农业、医药、食品行业中有着广泛的应用。以红锌矿(主要成分为
ZnO,还含有少量的FeO、MnO等)为原料制备ZnSO4·H2O的流程如下:
false (1)“酸浸”时pH分别与除铁率以及Zn2+的浸取率的关系如图16-1,“酸浸”时溶液的
pH应控制在 ▲ 左右。
(2)滤渣1的成分为FeO(OH),写出“氧化”时的离子方程式 ▲ 。
(3)“沉淀”得到的难溶物为Zn3(OH)4CO3,写出“沉淀”时的离子方程式 ▲ 。
(4)滤液1中主要的阳离子为 ▲ 、 ▲ 。
(5)硫酸锌晶体的溶解度与温度的变化如图16-2所示,从“酸化”后的溶液中得到ZnSO4·H2O
的操作是: ▲ ,洗涤,干燥。?
false false
22.(10分)琥珀酸二乙酯可用作增塑剂、特种润滑剂和有机合成中间体。以乙烯为原料
制备琥珀酸二乙酯的合成路线如下:
527055080A
B
C
琥珀酸二乙酯
NaOH/H2O
浓H2SO4/加热
D
E
A
B
C
琥珀酸二乙酯
NaOH/H2O
浓H2SO4/加热
D
E
已知:① RBr + NaCN→RCN + NaBr
falsefalse② RCN + 2H2O + H+→RCOOH + NH4+
③
(1)C→琥珀酸二乙酯的化学方程式为 ▲ 。
(2)E为八元环状化合物,写出E的结构简式 ▲ 。
(3)已知氧化羟基的条件足以氧化有机分子中的碳碳双键。
falsefalse 试设计由丙烯醇 制丙烯酸 的合成路线。
(合成路线常用的表示方式为:甲乙……目标产物)
23.(10分)外观与NaCl相似的亚硝酸钠(NaNO2)可用作建筑钢材缓蚀剂。某学习小组设计如下装置制备亚硝酸钠(夹持装置已省略)。
false
已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
(1)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡后再关上止水夹K。
①通入N2的目的是__________▲ ___________,若实验时观察到_____▲ ____,说明通入N2未达到预期目的。
②若通入N2未达到预期目的,装置B可除去NO中的NO2杂质,该反应的化学方程式为 _________________▲ ____________________________。
(2)装置C、E不可省去,省去会导致产品中混有杂质____▲ ____和_____▲_____。
(3)装置F的作用是____________________▲ ____________________________。
24.(10分)以Fe2O3/CeO2作催化剂,可用乙烯脱除烟气中SO2并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的CO2,实验装置(夹持装置已略)如下图所示:
已知:反应原理为:CH2=CH2+3SO2false3S+2CO2+2H2O。装置Ⅰ生成的S、
CO2、H2O均为气体。
(1)装置中玻璃纤维的作用是______▲ ______。
(2)为检验CO2,则装置Ⅱ、Ⅲ、Ⅳ中盛放的试剂依次是_____▲ _____(填序号)。
①酸性KMnO4溶液 ②澄清石灰水 ③Br2的CCl4溶液
(3)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,
为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20 g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10 mol·L-1 Na2S2O3 溶液,恰好完全反应时消耗Na2S2O3溶液体积为20.00 mL生成Na2S4O6。
计算样品中所含Fe2O3的质量分数。(写出计算过程)
南京市六校2020~2021学年度第二学期期末联考
高一化学试卷答案
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
A
D
C
C
B
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
C
D
B
C
A
D
B
C
C
D
21.(10分)
(1) 4 (3.5~4均可)
(2) 4Fe2++O2+6H2O= 4FeO(OH)+8H+
(3) 3Zn2++6HCO=Zn3(OH)4CO3+5CO2↑+H2O
(4) NH、Mn2+
(5)加热浓缩至大量晶体析出,高于70?C以上趁热过滤
(每空2分,共10分)
7052310655320+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
22.(10分)
(1) (2分)
(2) (2分)
(3)
第1步和第2步各1分,第3步和第4步各2分,第1步错后面步骤不得分(6分)
7052310655320+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
23.(10分)
(1) ①除去装置中的空气(氧气) A中气体变为红棕色
②3NO2+H2O=2HNO3+NO
(2) NaOH NaNO3
(3) 吸收尾气NO,防止污染空气
(每空2分,共10分)
24.(10分)
(1)防止冷却后的S的固体进入导管,将导管堵塞 (2分)
(2) ③①② (2分)
(4) n(Na2S2O3)= 0.10 mol·L-1×0.020 L=2.0×10-3 mol
根据方程可得出关系式:2 Fe3+ ~ I2 ~ 2 Na2S2O3 (2分)
n(Fe3+)= n(Na2S2O3)=2.0×10-3 mol
根据Fe元素守恒可得出:
n(Fe2O3)= 2.0×10-3 mol÷2=1.0×10-3 mol
m(Fe2O3) =1.0×10-3 mol × 160 g · mol-1 = 0.16 g (2分)
w(Fe2O3) = ×100% = 80% (2分)
高一化学试卷
本卷:共100分 考试时间:75分钟
可能用到的相对原子质量:H-1 C-12 O-16 Na-23 S-32 Cl-35.5 Fe-56 Cu-64
第Ⅰ卷(选择题 共60分)
一、选择题:本题共20小题,每小题3分,共计60 分。每小题只有一个选项符合题意。
1.绿色化学的核心就是利用化学原理从源头上减少和消除工业生产对环境的污染。下列
做法不符合绿色化学理念的是
A.研制水溶剂涂料替代有机溶剂涂料
B.用可降解塑料生产包装盒或快餐盒
C.用反应2CH2==CH2+O2 制备环氧乙烷
D.用反应Cu+2H2SO4(浓)CuSO4+SO2↑+2H2O制备硫酸铜
2.化学与生活、生产、环境等密切相关。下列说法错误的是
A.棉、丝、毛都是天然有机高分子化合物
B.蛋白质、油脂、糖类一定条件下都能发生水解反应
C.煤的液化、石油的裂化和油脂的皂化都属于化学变化
D.向鸡蛋清溶液中加入硫酸铜产生沉淀,是蛋白质发生了变性
3.下列有关化学用语使用正确的是
A.乙酸的结构简式:
B.一氯甲烷的电子式:
C.丙烷分子的空间充填模型:
D.聚氯乙烯的结构简式:false
4.常温下,取铝土矿(含有Al2O3、FeO、Fe2O3、SiO2等物质)用硫酸浸出后的溶液,
分别向其中加入指定物质,反应后的溶液中主要存在的一组离子正确的是
A.加入过量NaOH溶液:Na+、AlO2-、OH-、SO42-
B.加入过量氨水:NH、Al3+、OH-、SO42-
C.通入过量Cl2:Fe2+、H+、ClO-、SO42-
D.加入过量H2SO4 溶液:Fe2+、Na+、NO3-、SO42-
5.NA代表阿伏加德罗常数的值,下列说法中正确的是
A.20g D2O中含有的电子数目为9NA
B.标准状况下,11.2L SO3中含有分子数目为0.5NA
C.1molfalse中含有碳碳双键的数目为4NA
D.16.8gFe与足量的水蒸气完全反应转移的电子数目为0.8NA
3670300219710浓硫酸
酒精、乙酸
碎瓷片
饱和碳酸钠
浓硫酸
酒精、乙酸
碎瓷片
饱和碳酸钠
false6.下列有关实验原理或操作正确的是
26924088900苯
水
HCl
苯
水
HCl
1257300187960H2
O2
H2O
H+
H2O
电极a
电极b
H2
O2
H2O
H+
H2O
电极a
电极b
甲 乙 丙 丁
A. 图甲装置,吸收HCl气体时可以防止倒吸
B. 图乙装置,H+移向负极实现化学能转化为电能
C. 图丙装置,从下层放出CCl4实现与水的分离
D. 图丁装置,用饱和碳酸钠溶液实现乙酸乙酯的提纯
7.下表各组物质之间通过一步反应能实现如图所示转化关系,且与表中条件也匹配的是
选项
X
Y
Z
箭头上为反应条件或试剂
A
Fe
FeCl2
FeCl3
①通入少量Cl2
B
Na2CO3
NaCl
NaHCO3
②先通CO2、再通过量NH3
C
SiO2
Na2SiO3
H2SiO3
③加热
D
NaAlO2
Al(OH)3
Al2O3
④加H2O
4318055880
下列制取Cl2、验证其漂白性、收集并进行尾气处理装置和原理不能达到实验目的的是
A. A B. B C. C D. D
9.下列表示对应化学反应的离子方程式正确的是
A.向Na2SO3中滴加稀HNO3溶液:SO+2H+=SO2↑+H2O
B.0.3 mol FeBr2与0.4 mol Cl2在溶液中反应:
8Cl2+6Fe2++10Br-=6Fe3++16Cl-+5Br2
C.用稀硝酸除去试管内壁银镜:Ag+2H++NO=Ag++NO2↑+H2O
D.酸性介质中KMnO4氧化H2O2:2MnO+2H2O2+8H+=2Mn2++3O2↑+6H2O
10.海水资源开发利用的部分过程如下图所示。下列说法正确的是
457200115570晒盐
盐卤
粗盐
溶液1
金属镁
沉淀剂
Mg(OH)2
海水
Br2
氧化剂
晒盐
盐卤
粗盐
溶液1
金属镁
沉淀剂
Mg(OH)2
海水
Br2
氧化剂
A.向盐卤中通入的氧化剂可能是SO2
B.工业生产中常选用NaOH作为沉淀剂
C.粗盐可采用除杂和重结晶等过程提纯
D.常用电解氢氧化镁的方法制备金属Mg
11.下列物质的制备过程中,涉及的反应原理及部分流程较为合理的是
18796022860
21653532385
2254251301753270250101600
338455013970026670080010
12.有机物结构可用“键线式”表示,如:CH3-CH=CH-CH3可简写为。松油醇具有紫丁香味,其酯类常用于香精调制,如图为松油醇的结构,以下关于它的说法正确的
405320552070A.能催化氧化成醛
B.分子式为C10H20O
C.与氢气加成后的产物有4种一氯化物
D.能发生加聚反应,所有C原子不可能共平面
31146751651013.依据右图中氮元素及其化合物间的转化关系,
判断下列说法不正确的是
A.x是N2O5
B.可用排空气法收集NO
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,可通过NH3与
NO2反应实现
4288155290639514.某有机物分子中只含有C、H、O三种元素,其球棍模型如下图所示。下列关于该分子说法正确的是
A.分子中只含有一种官能团
B.与乙烯互为同系物
C.能使溴水和酸性高锰酸钾褪色,原理不同
D.只能发生取代和加成反应
15.食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PVC被广泛地用于
食品、蔬菜外包装,它对人体有潜在危害。下列有关叙述错误的是
A.PVC单体可由PE的单体与氯化氢加成制得
B.PVC保鲜膜属于链状聚合物,在高温时易熔化,能溶于有机溶剂
C.用湿润的蓝色石蕊试纸检验加热PE和PVC产生的气体,可鉴别PE和PVC
D.等质量的PE和乙烯完全燃烧消耗的氧气质量相等
16.根据下列图示所得出的结论正确的是
false falsefalse
甲 乙 丙 丁
A.图甲能量变化曲线,可推知该反应是放热反应,故反应不需要加热或点燃
B.图乙表示70℃时不同碱性条件下H2O2的浓度随时间变化的曲线,可推知溶液碱性越强,H2O2分解速率越慢
C.图丙表示KNO3、NaCl的溶解度随温度变化的曲线,可推知40℃时KNO3溶液中溶质的质量分数大于NaCl溶液中溶质的质量分数
D.图丁表示光照下氯水的pH随时间的变化曲线,可推知光照后溶液中Cl-浓度增大
17.根据下列实验操作和现象所得到的结论正确的是
选项
实验操作和现象
结论
A
向Fe(NO3)2溶液中滴入硫酸酸化的H2O2溶液,溶液变黄色
说明氧化性:H2O2 > Fe3+
B
将石蜡油加强热产生的气体通入溴的四氯化碳溶液中,溶液褪色
说明产物中含不饱和烃
C
将SO2气体通入溴水中,溴水褪色
说明SO2具有漂白性
D
淀粉与稀硫酸混合一段时间后,滴加银氨溶液并水浴加热,无银镜出现
说明淀粉没有水解
18.氢气、甲烷、乙醇等物质均可作为燃料电池的原料。燃料电池的基本组成为电极、电
解质、燃料和氧化剂。电池的能量利用率高,产物污染少。下列有关燃料电池的说法
不正确的是
A.上述燃料电池所用的电极材料不参加电极反应
B.氢氧燃料电池中,氢气应从电池的负极通入
C.乙醇燃料电池的电解质常用KOH,电池工作时负极周围pH增大
D.甲烷燃料电池的正极反应为:O2+2H2O+4e-=4OH-
19.取16.8 g NaHCO3固体,加热一段时间,将剩余固体分成四等份,分别取四份固体进行实验。下列能够说明NaHCO3固体已完全分解的是
A.加水溶解后向其中滴加酚酞,溶液变红
B.加水溶解后向其中滴加澄清石灰水,有白色沉淀产生
C.称量固体,继续加热,冷却后再次称量所得固体,质量不变
D.加入稍过量的盐酸,充分反应后将溶液蒸干,所得固体质量为2.925 g
20.为了测定铁铜合金的组成,将15.2 g铁、铜合金加入200 mL某浓度的稀硝酸中,待合金完全溶解后,共收集到NO气体4.48 L(标准状况下),并测得反应后溶液中H+的浓度为0.5 mol·L-1。若反应前后溶液的体积变化忽略不计,则下列判断正确的是
A.反应后的溶液中可继续溶解铁铜合金质量最多为1.9g
B.上述合金中铁与铜的质量之比为2:3
C.合金中,铁的质量分数为63.2%
D.原硝酸的物质的量浓度为c(HNO3)=4.5 mol·L-1
第Ⅱ卷(非选择题 共40分)
21.(10分)硫酸锌在农业、医药、食品行业中有着广泛的应用。以红锌矿(主要成分为
ZnO,还含有少量的FeO、MnO等)为原料制备ZnSO4·H2O的流程如下:
false (1)“酸浸”时pH分别与除铁率以及Zn2+的浸取率的关系如图16-1,“酸浸”时溶液的
pH应控制在 ▲ 左右。
(2)滤渣1的成分为FeO(OH),写出“氧化”时的离子方程式 ▲ 。
(3)“沉淀”得到的难溶物为Zn3(OH)4CO3,写出“沉淀”时的离子方程式 ▲ 。
(4)滤液1中主要的阳离子为 ▲ 、 ▲ 。
(5)硫酸锌晶体的溶解度与温度的变化如图16-2所示,从“酸化”后的溶液中得到ZnSO4·H2O
的操作是: ▲ ,洗涤,干燥。?
false false
22.(10分)琥珀酸二乙酯可用作增塑剂、特种润滑剂和有机合成中间体。以乙烯为原料
制备琥珀酸二乙酯的合成路线如下:
527055080A
B
C
琥珀酸二乙酯
NaOH/H2O
浓H2SO4/加热
D
E
A
B
C
琥珀酸二乙酯
NaOH/H2O
浓H2SO4/加热
D
E
已知:① RBr + NaCN→RCN + NaBr
falsefalse② RCN + 2H2O + H+→RCOOH + NH4+
③
(1)C→琥珀酸二乙酯的化学方程式为 ▲ 。
(2)E为八元环状化合物,写出E的结构简式 ▲ 。
(3)已知氧化羟基的条件足以氧化有机分子中的碳碳双键。
falsefalse 试设计由丙烯醇 制丙烯酸 的合成路线。
(合成路线常用的表示方式为:甲乙……目标产物)
23.(10分)外观与NaCl相似的亚硝酸钠(NaNO2)可用作建筑钢材缓蚀剂。某学习小组设计如下装置制备亚硝酸钠(夹持装置已省略)。
false
已知:2NO+Na2O2=2NaNO2,2NO2+Na2O2=2NaNO3。
(1)反应开始时先打开止水夹K,通入氮气至F中产生大量气泡后再关上止水夹K。
①通入N2的目的是__________▲ ___________,若实验时观察到_____▲ ____,说明通入N2未达到预期目的。
②若通入N2未达到预期目的,装置B可除去NO中的NO2杂质,该反应的化学方程式为 _________________▲ ____________________________。
(2)装置C、E不可省去,省去会导致产品中混有杂质____▲ ____和_____▲_____。
(3)装置F的作用是____________________▲ ____________________________。
24.(10分)以Fe2O3/CeO2作催化剂,可用乙烯脱除烟气中SO2并回收单质硫。某兴趣小组同学设计实验验证该反应并检验产物中的CO2,实验装置(夹持装置已略)如下图所示:
已知:反应原理为:CH2=CH2+3SO2false3S+2CO2+2H2O。装置Ⅰ生成的S、
CO2、H2O均为气体。
(1)装置中玻璃纤维的作用是______▲ ______。
(2)为检验CO2,则装置Ⅱ、Ⅲ、Ⅳ中盛放的试剂依次是_____▲ _____(填序号)。
①酸性KMnO4溶液 ②澄清石灰水 ③Br2的CCl4溶液
(3)为制作反应的催化剂,实验小组制备了一定质量的Fe2O3(含FeO杂质)样品,
为测定其中Fe2O3的质量分数,现进行如下实验:
步骤1:称取0.20 g样品,向样品中加入足量的盐酸使其完全溶解。
步骤2:向溶液中加入足量的KI溶液,充分反应。
步骤3:向溶液中加入0.10 mol·L-1 Na2S2O3 溶液,恰好完全反应时消耗Na2S2O3溶液体积为20.00 mL生成Na2S4O6。
计算样品中所含Fe2O3的质量分数。(写出计算过程)
南京市六校2020~2021学年度第二学期期末联考
高一化学试卷答案
题号
1
2
3
4
5
6
7
8
9
10
答案
D
B
D
A
D
C
C
B
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
C
D
B
C
A
D
B
C
C
D
21.(10分)
(1) 4 (3.5~4均可)
(2) 4Fe2++O2+6H2O= 4FeO(OH)+8H+
(3) 3Zn2++6HCO=Zn3(OH)4CO3+5CO2↑+H2O
(4) NH、Mn2+
(5)加热浓缩至大量晶体析出,高于70?C以上趁热过滤
(每空2分,共10分)
7052310655320+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
22.(10分)
(1) (2分)
(2) (2分)
(3)
第1步和第2步各1分,第3步和第4步各2分,第1步错后面步骤不得分(6分)
7052310655320+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
+HO-NO2
浓硝酸
NO2+H2O
Δ
+Br2
催化剂
Br2+HBr
浓H2SO4
140℃
C2H5- -OH+H- -O-C2H5
C2H5-O-C2H5+H2O
2CH3CH2OH+2Na
2CH3CH2ONa+H2↑
C2H5- -OH+H- -Br
C2H5Br+H2O
Δ
C2H5OH(液)+3O2(气)
2CO2(气)+3H2O(液)
点燃
2CH3CH2OH+O2
2CH3CHO+2H2O
催化剂
Δ
Δ
CH3CHO+2Cu(OH)2
CH3COOH+Cu2O↓+2H2O
催化剂
2CH3CHO+O2
2CH3COOH
23.(10分)
(1) ①除去装置中的空气(氧气) A中气体变为红棕色
②3NO2+H2O=2HNO3+NO
(2) NaOH NaNO3
(3) 吸收尾气NO,防止污染空气
(每空2分,共10分)
24.(10分)
(1)防止冷却后的S的固体进入导管,将导管堵塞 (2分)
(2) ③①② (2分)
(4) n(Na2S2O3)= 0.10 mol·L-1×0.020 L=2.0×10-3 mol
根据方程可得出关系式:2 Fe3+ ~ I2 ~ 2 Na2S2O3 (2分)
n(Fe3+)= n(Na2S2O3)=2.0×10-3 mol
根据Fe元素守恒可得出:
n(Fe2O3)= 2.0×10-3 mol÷2=1.0×10-3 mol
m(Fe2O3) =1.0×10-3 mol × 160 g · mol-1 = 0.16 g (2分)
w(Fe2O3) = ×100% = 80% (2分)
同课章节目录
