1.1.2 蒸馏和萃取 (人教版必修1)
文档属性
| 名称 | 1.1.2 蒸馏和萃取 (人教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 00:00:00 | ||
图片预览







文档简介
(共57张PPT)
第2课时 蒸馏和萃取
知道这个古怪的玻璃仪器是一种什么装置吗?告诉你吧,它其实也是一种蒸馏器。
1.掌握蒸馏的实验原理和操作技能。
2.掌握萃取、分液的实验原理和操作技能。
3.通过对离子的检验、物质提纯方法的讨论,加深对离子检验原理和物质提纯方法的理解。
1.蒸馏
(1)蒸馏原理
利用混合物中各组分的______不同,除去液 态混合物中________、________或________ 的杂质的方法。
沸点
易挥发
难挥发
不挥发
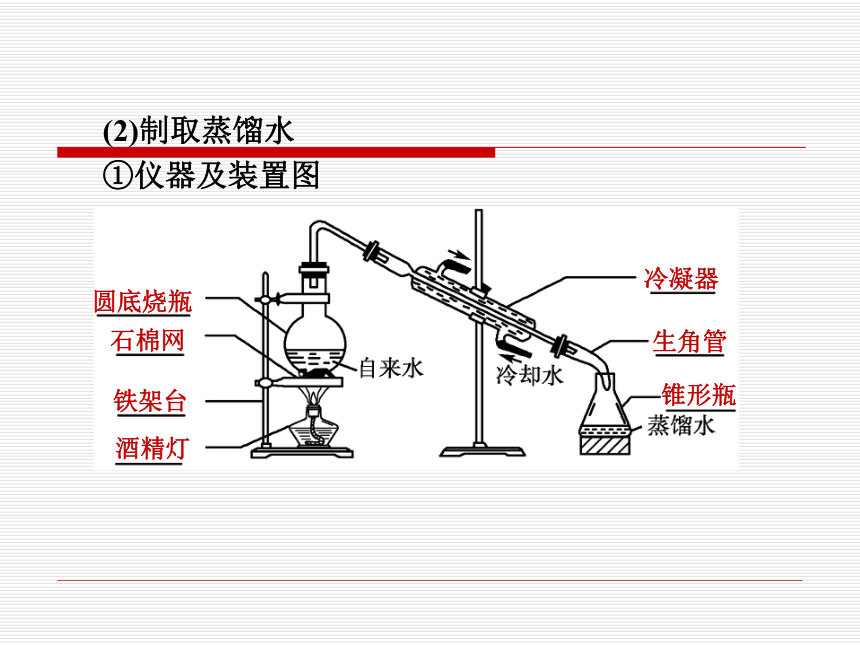
(2)制取蒸馏水
①仪器及装置图
圆底烧瓶
石棉网
铁架台
酒精灯
冷凝器
生角管
锥形瓶
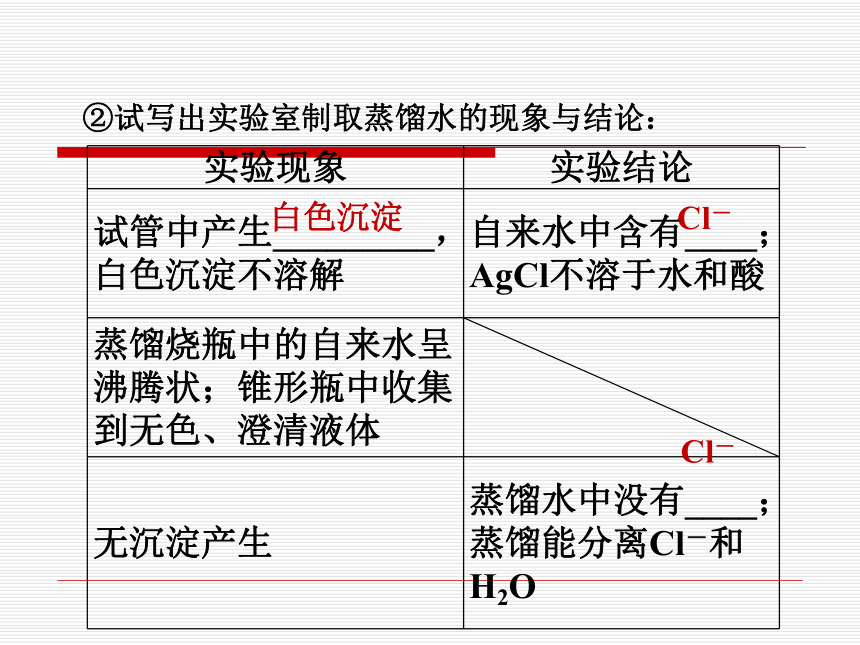
②试写出实验室制取蒸馏水的现象与结论:
实验现象 实验结论
试管中产生_________, 白色沉淀不溶解 自来水中含有____; AgCl不溶于水和酸
蒸馏烧瓶中的自来水呈沸腾状;锥形瓶中收集到无色、澄清液体
无沉淀产生 蒸馏水中没有____; 蒸馏能分离Cl-和H2O
白色沉淀
Cl-
Cl-
2.萃取与分液
(1)原理
①萃取
利用物质在__________的溶剂里________的 不同,用一种溶剂把物质从它与另一种溶剂
所组成的溶液里提取出来的方法。
②分液
将_____________的液体分开的操作。
互不相溶
溶解度
两种互不相溶
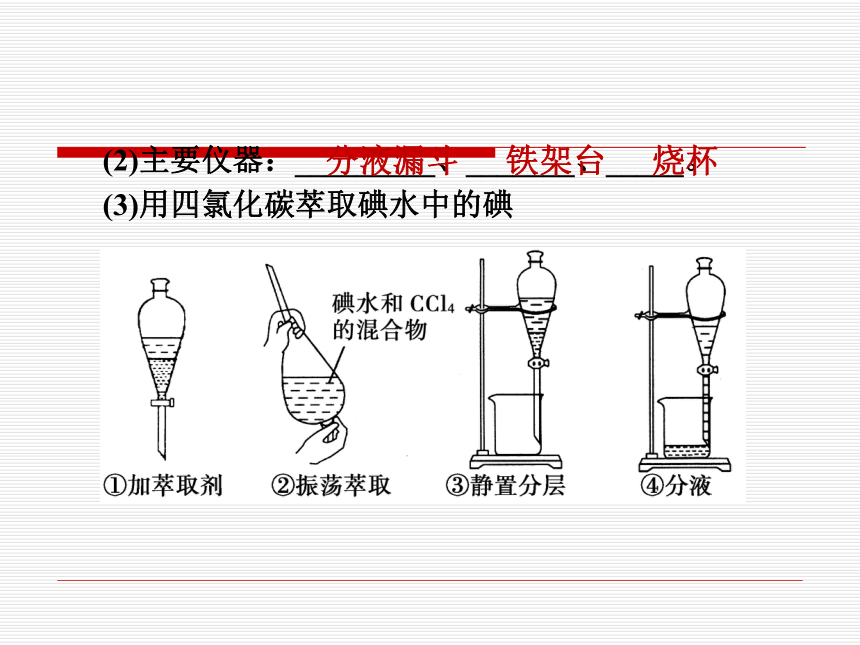
(2)主要仪器:_________、_______、_____。
(3)用四氯化碳萃取碘水中的碘
分液漏斗
铁架台
烧杯
①加萃取剂
用量筒量取10 mL碘的饱和水溶液,倒入 __________,然后再注入4 mL四氯化碳, 盖好玻璃塞,发现溶液分层。__________ 在下层。
②振荡萃取
用右手压住分液漏斗______,左手握住 ______部分,把分液漏斗倒转过来振荡, 使两种液体充分接触。
分液漏斗
四氯化碳
口部
活塞
③静置分层
将分液漏斗放在铁架台上静置,液体分层。 上层为水层,无色;下层为_____________ ______,显____色。
④分液
待液体分层后,将分液漏斗上的________打 开(或使塞上的______对准_____________), 再将分液漏斗下面的活塞拧开,使下层液体 沿________流下。上层液体从分液漏斗_____ 倒出。
碘的四氯化碳
溶液
紫
玻璃塞
凹槽
漏斗上的小孔
烧杯壁
上口
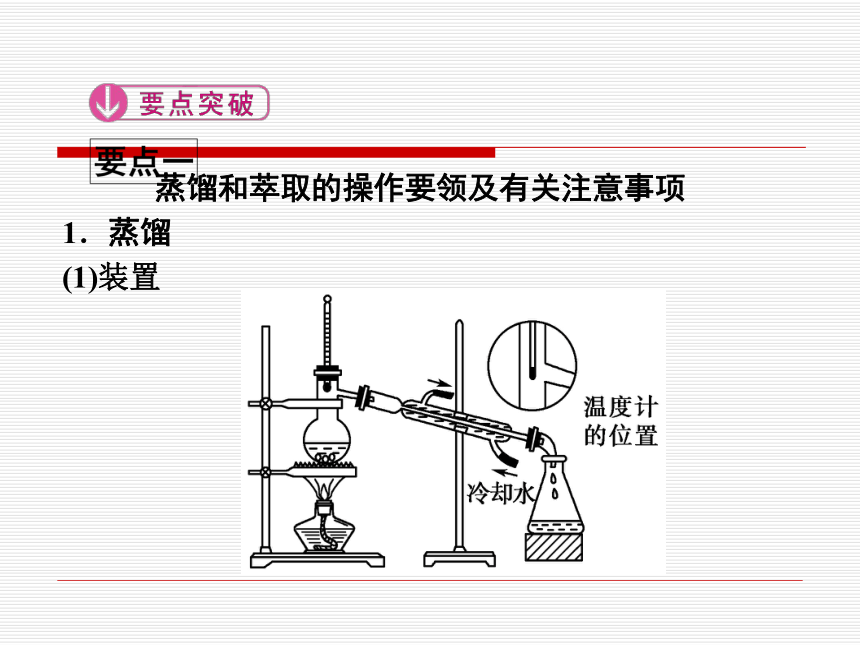
蒸馏和萃取的操作要领及有关注意事项
1.蒸馏
(1)装置
(2)注意事项
①分离多种液体时需使用蒸馏烧瓶和温度计,且温度计水银球在蒸馏烧瓶支管口处。
②蒸馏时在烧瓶中放少量碎瓷片或沸石,防止液体暴沸。
③冷凝管中冷却水从下口进,上口出。先通冷凝水,再加热,蒸馏结束时先熄灭酒精灯,再停止通冷却水。
[温馨提示] (1)蒸馏装置组装顺序:由下向上,由左往右,拆卸顺序恰好相反。
(2)用CCl4萃取了碘水中的碘所得的是碘的CCl4溶液,此时可用蒸馏法把二者分开。
2.萃取和分液
(1)萃取剂必须具备的三点性质
①萃取剂和水互不相溶;
②萃取剂和溶质不发生反应;
③溶质在萃取剂中的溶解度远大于它在原溶剂中的溶解度。
(2)分液操作的注意事项
①振荡时,要不时旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,分液漏斗下端要紧靠烧杯内壁,以防液体飞溅。
③旋开活塞,用烧杯接收下层液体时,要注意待下层液体恰好流出时及时关闭分液漏斗的活塞,注意不能让上层液体流出,上层液体应从上口放出。
[温馨提示] (1)常见的萃取剂:①苯、汽油(或煤油):难溶于水,密度比水小;②CCl4:难溶于水,密度比水大。
(2)由于酒精与水互溶,故酒精一般不作萃取剂。
(3)Cl2、Br2、I2的性质:易溶于有机溶剂,如苯、汽油、煤油、CCl4等在水中的溶解度不大。
1.下列四种化学操作名称从左到右分别是( )
A.过滤、蒸发、蒸馏、萃取
B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取
D.萃取、蒸馏、蒸发、过滤
解析: 掌握物质分离与提纯的基本实验装置图,即可立即选出。
答案: A
常见离子的检验
酚酞
石蕊
无
无
白色
盐酸
BaCl2
硝酸
AgNO3
物质的检验
1.物质的检验方法
(1)物理方法
利用物质的颜色、气味、溶解性加以区别,如区分CuSO4溶液和Na2SO4溶液可根据其颜色,区分Na2CO3和CaCO3可根据其溶解性。
(2)化学方法
常用指示剂、点燃、加热、加试剂等方法,如区分盐酸、NaOH溶液和NaCl溶液,可用石蕊试液。
答案: D
实验室里从海藻中提取碘的流程图如下:
(1)指出制取碘的过程中有关的实验操作名称:
①________,②____________。
(2)灼烧海藻时,除需要三脚架外,还需要用到的仪器是________。(从下列仪器中选择所需的仪器,用标号字母填写在空白处)
A.烧杯 B.坩埚
C.表面皿 D.泥三角
E.酒精灯 F.干燥器
(3)提取碘的过程中,可供选择的有机溶剂是___________________________。
理由是_____________________。(乙酸、甘油均可溶于水)
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)进行上述蒸馏操作时,使用水浴的原因是_________________________________,最后晶体碘在____________里聚集。
(5)含碘的有机物溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察下列实验装置指出其错误之处,并指出正确操作。
解析: (1)从流程图中可知,操作①是过滤,操作②是萃取和分液。(3)根据萃取原理,要从含碘水溶液中萃取碘,所选萃取剂一定要和水互不相溶或很难相溶,且溶质在萃取剂中溶解度要比在水中大得多,而选项中,酒精、乙酸、甘油皆与水互溶,因此B项正确。
(4)利用水浴加热可使被加热物质受热均匀,温度不会超过100 ℃,最后在蒸馏烧瓶中得到晶体碘。(5)检查实验装置的错误,要按实验进程逐一检查,通常是从左到右,自下而上。
答案: (1)①过滤 ②萃取和分液 (2)BDE (3)B 四氯化碳、苯与水互不相溶,且碘在这两种溶剂中的溶解度比在水中的大 (4)使蒸馏烧瓶受热均匀、控制温度不超过100 ℃ 蒸馏烧瓶 (5)①缺石棉网;②温度计的水银球不应插入液体中,而应位于蒸馏烧瓶支管口处;③冷凝管进出水的方向错误,应下口进水,上口出水。
[思考感悟] 萃取剂的选取原则:
①萃取剂和原溶液中的溶剂互不相溶且不发生化学反应;
②萃取剂与溶质不发生化学反应;
③溶质在萃取剂中的溶解度要远大于在原溶剂的溶解度;
④两溶剂的密度应相差较大。
1.(2010·湛江高一检测)下列实验操作中错误的是(多选)( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
解析: 蒸发时,待蒸发皿中有大量晶体出现时,停止加热,利用余热蒸干,A错误;蒸馏时,温度计水银球在蒸馏烧瓶支管口处,因为测得是蒸气的温度,B正确;分液时,分液漏斗的下层液体从下口放出,上层液体从上口倒出,C正确;选择萃取剂时,只要保证萃取剂与原溶剂、原溶质互不反应,与原溶剂互不相溶,溶质在萃取剂中的溶解度远大于它在原溶剂中的溶解度即可,D错误。
答案: AD
下列离子检验的方法正确的是( )
解析: 本题考查了典型离子的检验。
答案: C
2.按下列添加试剂的先后顺序,即可将盐酸、硫酸、硫酸钾、氢氧化钠和硝酸钾五种无色透明溶液鉴别开来的是( )
A.石蕊溶液、AgNO3溶液、稀HNO3
B.BaCl2溶液、酚酞溶液、AgNO3溶液
C.石蕊溶液、BaCl2溶液
D.酚酞溶液、BaCl2溶液、AgNO3溶液
解析: 在五种溶液中,遇紫色石蕊溶液变蓝色的是NaOH,变红色的是HCl和H2SO4,不变色的是K2SO4和KNO3。然后再借助BaCl2将HCl和H2SO4、K2SO4和KNO3鉴别开。
答案: C
热点实验 制取无水酒精的实验设计
[探究举例] 已知乙醇的沸点为78.3 ℃,与水以任意比互溶,且在78.15 ℃时与水可形成95.57%的恒沸混合物(即水和酒精可同时挥发)。酒精中的水可加入生石灰除去,反应如下:CaO+H2O===Ca(OH)2,CaO和Ca(OH)2均不溶于酒精。
某化学活动小组要用35%的酒精制取无水酒精,设计了如下四个方案:
方案一:对35%的酒精直接蒸馏得无水酒精。
方案二:先对35%的酒精蒸馏得95.57%的酒精,再加入生石灰,然后进行蒸馏得无水酒精。
方案三:用CCl4对35%的酒精进行萃取,然后对酒精的CCl4溶液进行蒸馏得无水酒精。
方案四:向35%的酒精中直接加入生石灰,然后进行蒸馏得无水酒精。
请对四个方案进行评价,回答下列问题:
(1)最好的方案是________,错误的方案是________,错误的原因是_____________。
(2)其余方案的不足是______________________________。
(3)用最好的方案进行实验时,所用到的玻璃仪器有________________________________
_____________________________________。
(4)蒸馏操作中要注意的事项是__________
_____________________________________
_______________________(回答三项即可)。
解析: 本题考查的主要是物质分离提纯的方法之一——蒸馏。依据本题题设条件可知,酒精与水可形成恒沸物,酒精先通过蒸馏,绝大部分从水中出来后,再对95.57%的酒精再加入生石灰进行再蒸馏,这样做消耗的生石灰较少(与方案四比较),又能得到无水酒精(与方案一比较)。
答案: (1)方案二 方案一和方案三 方案一,酒精与水可形成95.57%的恒沸混合物,直接蒸馏无法得无水酒精,方案三,酒精与水混溶,不能用CCl4萃取
(2)方案四的酒精中水太多,要消耗大量的生石灰
(3)蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计和酒精灯
(4)温度计水银球要在烧瓶支管口处;冷凝水要下口进上口出;加热时要适当调整酒精灯的位置,以控制温度;先通冷凝水后加热(回答三项即可)
1.下列仪器在使用前必须检查是否漏水的是( )
①量筒 ②圆底烧瓶 ③分液漏斗
A.① B.②
C.③ D.①③
解析: 有活塞、塞子等有封闭控流作用的仪器,在使用前都要检查是否漏水。
答案: C
2.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是( )
解析: 水与植物油互不相溶,故可以采取分液的方法进行分离。
答案: B
3.在不使用酸碱指示剂的前提下,欲除去氯化钙溶液中的少量盐酸,得到纯的氯化钙溶液,最适宜选用的一种试剂是( )
A.硝酸银溶液 B.澄清石灰水
C.生石灰粉末 D.碳酸钙粉末
解析: 由于题中强调不得使用指示剂,因此只能选用CaCO3粉末,当无气泡放出时即除去了少量的盐酸,原因是过量的CaCO3粉末是不溶于水的,可过滤出而得滤液CaCl2溶液,用生石灰粉末虽可除去少量盐酸,但现象不明显,无法控制用量。
答案: D
4.许多地区的自来水是利用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的( )
A.紫色石蕊试液 B.四氯化碳溶液
C.氢氧化钠溶液 D.硝酸银溶液
解析: 检验Cl-的试剂是经稀硝酸酸化的硝酸银溶液,形成不溶于稀硝酸的白色沉淀氯化银。
答案: D
5.请按要求回答问题:
(1)除去生石灰中的石灰石,方法是______________________________。
(2)除去乙酸中溶解的食盐,方法是______________________________。
(3)除去KNO3晶体中少量的NaCl,所进行的实验操作依次是________、蒸发、结晶、________。
(4)除去Ca(OH)2溶液中悬浮的CaCO3颗粒用________操作。
(5)除去CO2中少量的HCl通入________溶液洗气。
(6)除去稀HCl中少量的H2SO4,方法是_________________________________。
答案: (1)加热分解 (2)蒸馏 (3)溶解 过滤 (4)过滤
(5)饱和NaHCO3 (6)加入适量BaCl2溶液,过滤 (7)BaCl2[或Ba(OH)2] K2CO3 HCl (8)分液 蒸馏 萃取 萃取和分液
第2课时 蒸馏和萃取
知道这个古怪的玻璃仪器是一种什么装置吗?告诉你吧,它其实也是一种蒸馏器。
1.掌握蒸馏的实验原理和操作技能。
2.掌握萃取、分液的实验原理和操作技能。
3.通过对离子的检验、物质提纯方法的讨论,加深对离子检验原理和物质提纯方法的理解。
1.蒸馏
(1)蒸馏原理
利用混合物中各组分的______不同,除去液 态混合物中________、________或________ 的杂质的方法。
沸点
易挥发
难挥发
不挥发
(2)制取蒸馏水
①仪器及装置图
圆底烧瓶
石棉网
铁架台
酒精灯
冷凝器
生角管
锥形瓶
②试写出实验室制取蒸馏水的现象与结论:
实验现象 实验结论
试管中产生_________, 白色沉淀不溶解 自来水中含有____; AgCl不溶于水和酸
蒸馏烧瓶中的自来水呈沸腾状;锥形瓶中收集到无色、澄清液体
无沉淀产生 蒸馏水中没有____; 蒸馏能分离Cl-和H2O
白色沉淀
Cl-
Cl-
2.萃取与分液
(1)原理
①萃取
利用物质在__________的溶剂里________的 不同,用一种溶剂把物质从它与另一种溶剂
所组成的溶液里提取出来的方法。
②分液
将_____________的液体分开的操作。
互不相溶
溶解度
两种互不相溶
(2)主要仪器:_________、_______、_____。
(3)用四氯化碳萃取碘水中的碘
分液漏斗
铁架台
烧杯
①加萃取剂
用量筒量取10 mL碘的饱和水溶液,倒入 __________,然后再注入4 mL四氯化碳, 盖好玻璃塞,发现溶液分层。__________ 在下层。
②振荡萃取
用右手压住分液漏斗______,左手握住 ______部分,把分液漏斗倒转过来振荡, 使两种液体充分接触。
分液漏斗
四氯化碳
口部
活塞
③静置分层
将分液漏斗放在铁架台上静置,液体分层。 上层为水层,无色;下层为_____________ ______,显____色。
④分液
待液体分层后,将分液漏斗上的________打 开(或使塞上的______对准_____________), 再将分液漏斗下面的活塞拧开,使下层液体 沿________流下。上层液体从分液漏斗_____ 倒出。
碘的四氯化碳
溶液
紫
玻璃塞
凹槽
漏斗上的小孔
烧杯壁
上口
蒸馏和萃取的操作要领及有关注意事项
1.蒸馏
(1)装置
(2)注意事项
①分离多种液体时需使用蒸馏烧瓶和温度计,且温度计水银球在蒸馏烧瓶支管口处。
②蒸馏时在烧瓶中放少量碎瓷片或沸石,防止液体暴沸。
③冷凝管中冷却水从下口进,上口出。先通冷凝水,再加热,蒸馏结束时先熄灭酒精灯,再停止通冷却水。
[温馨提示] (1)蒸馏装置组装顺序:由下向上,由左往右,拆卸顺序恰好相反。
(2)用CCl4萃取了碘水中的碘所得的是碘的CCl4溶液,此时可用蒸馏法把二者分开。
2.萃取和分液
(1)萃取剂必须具备的三点性质
①萃取剂和水互不相溶;
②萃取剂和溶质不发生反应;
③溶质在萃取剂中的溶解度远大于它在原溶剂中的溶解度。
(2)分液操作的注意事项
①振荡时,要不时旋开活塞放气,以防止分液漏斗内压强过大引起危险。
②分液时,分液漏斗下端要紧靠烧杯内壁,以防液体飞溅。
③旋开活塞,用烧杯接收下层液体时,要注意待下层液体恰好流出时及时关闭分液漏斗的活塞,注意不能让上层液体流出,上层液体应从上口放出。
[温馨提示] (1)常见的萃取剂:①苯、汽油(或煤油):难溶于水,密度比水小;②CCl4:难溶于水,密度比水大。
(2)由于酒精与水互溶,故酒精一般不作萃取剂。
(3)Cl2、Br2、I2的性质:易溶于有机溶剂,如苯、汽油、煤油、CCl4等在水中的溶解度不大。
1.下列四种化学操作名称从左到右分别是( )
A.过滤、蒸发、蒸馏、萃取
B.过滤、蒸馏、蒸发、萃取
C.蒸发、蒸馏、过滤、萃取
D.萃取、蒸馏、蒸发、过滤
解析: 掌握物质分离与提纯的基本实验装置图,即可立即选出。
答案: A
常见离子的检验
酚酞
石蕊
无
无
白色
盐酸
BaCl2
硝酸
AgNO3
物质的检验
1.物质的检验方法
(1)物理方法
利用物质的颜色、气味、溶解性加以区别,如区分CuSO4溶液和Na2SO4溶液可根据其颜色,区分Na2CO3和CaCO3可根据其溶解性。
(2)化学方法
常用指示剂、点燃、加热、加试剂等方法,如区分盐酸、NaOH溶液和NaCl溶液,可用石蕊试液。
答案: D
实验室里从海藻中提取碘的流程图如下:
(1)指出制取碘的过程中有关的实验操作名称:
①________,②____________。
(2)灼烧海藻时,除需要三脚架外,还需要用到的仪器是________。(从下列仪器中选择所需的仪器,用标号字母填写在空白处)
A.烧杯 B.坩埚
C.表面皿 D.泥三角
E.酒精灯 F.干燥器
(3)提取碘的过程中,可供选择的有机溶剂是___________________________。
理由是_____________________。(乙酸、甘油均可溶于水)
A.甲苯、酒精 B.四氯化碳、苯
C.汽油、乙酸 D.汽油、甘油
(4)进行上述蒸馏操作时,使用水浴的原因是_________________________________,最后晶体碘在____________里聚集。
(5)含碘的有机物溶液中提取碘和回收有机溶剂,还需要经过蒸馏,观察下列实验装置指出其错误之处,并指出正确操作。
解析: (1)从流程图中可知,操作①是过滤,操作②是萃取和分液。(3)根据萃取原理,要从含碘水溶液中萃取碘,所选萃取剂一定要和水互不相溶或很难相溶,且溶质在萃取剂中溶解度要比在水中大得多,而选项中,酒精、乙酸、甘油皆与水互溶,因此B项正确。
(4)利用水浴加热可使被加热物质受热均匀,温度不会超过100 ℃,最后在蒸馏烧瓶中得到晶体碘。(5)检查实验装置的错误,要按实验进程逐一检查,通常是从左到右,自下而上。
答案: (1)①过滤 ②萃取和分液 (2)BDE (3)B 四氯化碳、苯与水互不相溶,且碘在这两种溶剂中的溶解度比在水中的大 (4)使蒸馏烧瓶受热均匀、控制温度不超过100 ℃ 蒸馏烧瓶 (5)①缺石棉网;②温度计的水银球不应插入液体中,而应位于蒸馏烧瓶支管口处;③冷凝管进出水的方向错误,应下口进水,上口出水。
[思考感悟] 萃取剂的选取原则:
①萃取剂和原溶液中的溶剂互不相溶且不发生化学反应;
②萃取剂与溶质不发生化学反应;
③溶质在萃取剂中的溶解度要远大于在原溶剂的溶解度;
④两溶剂的密度应相差较大。
1.(2010·湛江高一检测)下列实验操作中错误的是(多选)( )
A.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
B.蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶的支管口处
C.分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
D.萃取操作时,应选择有机萃取剂,且萃取剂的密度必须比水大
解析: 蒸发时,待蒸发皿中有大量晶体出现时,停止加热,利用余热蒸干,A错误;蒸馏时,温度计水银球在蒸馏烧瓶支管口处,因为测得是蒸气的温度,B正确;分液时,分液漏斗的下层液体从下口放出,上层液体从上口倒出,C正确;选择萃取剂时,只要保证萃取剂与原溶剂、原溶质互不反应,与原溶剂互不相溶,溶质在萃取剂中的溶解度远大于它在原溶剂中的溶解度即可,D错误。
答案: AD
下列离子检验的方法正确的是( )
解析: 本题考查了典型离子的检验。
答案: C
2.按下列添加试剂的先后顺序,即可将盐酸、硫酸、硫酸钾、氢氧化钠和硝酸钾五种无色透明溶液鉴别开来的是( )
A.石蕊溶液、AgNO3溶液、稀HNO3
B.BaCl2溶液、酚酞溶液、AgNO3溶液
C.石蕊溶液、BaCl2溶液
D.酚酞溶液、BaCl2溶液、AgNO3溶液
解析: 在五种溶液中,遇紫色石蕊溶液变蓝色的是NaOH,变红色的是HCl和H2SO4,不变色的是K2SO4和KNO3。然后再借助BaCl2将HCl和H2SO4、K2SO4和KNO3鉴别开。
答案: C
热点实验 制取无水酒精的实验设计
[探究举例] 已知乙醇的沸点为78.3 ℃,与水以任意比互溶,且在78.15 ℃时与水可形成95.57%的恒沸混合物(即水和酒精可同时挥发)。酒精中的水可加入生石灰除去,反应如下:CaO+H2O===Ca(OH)2,CaO和Ca(OH)2均不溶于酒精。
某化学活动小组要用35%的酒精制取无水酒精,设计了如下四个方案:
方案一:对35%的酒精直接蒸馏得无水酒精。
方案二:先对35%的酒精蒸馏得95.57%的酒精,再加入生石灰,然后进行蒸馏得无水酒精。
方案三:用CCl4对35%的酒精进行萃取,然后对酒精的CCl4溶液进行蒸馏得无水酒精。
方案四:向35%的酒精中直接加入生石灰,然后进行蒸馏得无水酒精。
请对四个方案进行评价,回答下列问题:
(1)最好的方案是________,错误的方案是________,错误的原因是_____________。
(2)其余方案的不足是______________________________。
(3)用最好的方案进行实验时,所用到的玻璃仪器有________________________________
_____________________________________。
(4)蒸馏操作中要注意的事项是__________
_____________________________________
_______________________(回答三项即可)。
解析: 本题考查的主要是物质分离提纯的方法之一——蒸馏。依据本题题设条件可知,酒精与水可形成恒沸物,酒精先通过蒸馏,绝大部分从水中出来后,再对95.57%的酒精再加入生石灰进行再蒸馏,这样做消耗的生石灰较少(与方案四比较),又能得到无水酒精(与方案一比较)。
答案: (1)方案二 方案一和方案三 方案一,酒精与水可形成95.57%的恒沸混合物,直接蒸馏无法得无水酒精,方案三,酒精与水混溶,不能用CCl4萃取
(2)方案四的酒精中水太多,要消耗大量的生石灰
(3)蒸馏烧瓶、冷凝管、牛角管、锥形瓶、温度计和酒精灯
(4)温度计水银球要在烧瓶支管口处;冷凝水要下口进上口出;加热时要适当调整酒精灯的位置,以控制温度;先通冷凝水后加热(回答三项即可)
1.下列仪器在使用前必须检查是否漏水的是( )
①量筒 ②圆底烧瓶 ③分液漏斗
A.① B.②
C.③ D.①③
解析: 有活塞、塞子等有封闭控流作用的仪器,在使用前都要检查是否漏水。
答案: C
2.如果你家里的食用花生油不小心混入了大量的水,利用你所学的知识,最简便的分离方法是( )
解析: 水与植物油互不相溶,故可以采取分液的方法进行分离。
答案: B
3.在不使用酸碱指示剂的前提下,欲除去氯化钙溶液中的少量盐酸,得到纯的氯化钙溶液,最适宜选用的一种试剂是( )
A.硝酸银溶液 B.澄清石灰水
C.生石灰粉末 D.碳酸钙粉末
解析: 由于题中强调不得使用指示剂,因此只能选用CaCO3粉末,当无气泡放出时即除去了少量的盐酸,原因是过量的CaCO3粉末是不溶于水的,可过滤出而得滤液CaCl2溶液,用生石灰粉末虽可除去少量盐酸,但现象不明显,无法控制用量。
答案: D
4.许多地区的自来水是利用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的( )
A.紫色石蕊试液 B.四氯化碳溶液
C.氢氧化钠溶液 D.硝酸银溶液
解析: 检验Cl-的试剂是经稀硝酸酸化的硝酸银溶液,形成不溶于稀硝酸的白色沉淀氯化银。
答案: D
5.请按要求回答问题:
(1)除去生石灰中的石灰石,方法是______________________________。
(2)除去乙酸中溶解的食盐,方法是______________________________。
(3)除去KNO3晶体中少量的NaCl,所进行的实验操作依次是________、蒸发、结晶、________。
(4)除去Ca(OH)2溶液中悬浮的CaCO3颗粒用________操作。
(5)除去CO2中少量的HCl通入________溶液洗气。
(6)除去稀HCl中少量的H2SO4,方法是_________________________________。
答案: (1)加热分解 (2)蒸馏 (3)溶解 过滤 (4)过滤
(5)饱和NaHCO3 (6)加入适量BaCl2溶液,过滤 (7)BaCl2[或Ba(OH)2] K2CO3 HCl (8)分液 蒸馏 萃取 萃取和分液
