1.2.2 气体摩尔体积(人教版必修1)
文档属性
| 名称 | 1.2.2 气体摩尔体积(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 11:18:18 | ||
图片预览











文档简介
(共44张PPT)
第2课时 气体摩尔体积
在化学实验中,需要量取1 mol H2来做实验,如何量取1 mol H2?对于气体来说,我们宏观量取的通常不是质量而是体积,那么1 mol H2的体积到底是多少呢?气体的体积与物质的量之间有什么联系呢?
1.了解气体摩尔体积的含义。
2.掌握标准状况下有关气体摩尔体积的计算。
3.理解阿伏加德罗定律及其推论,并能进行气体多方面的计算与判断。
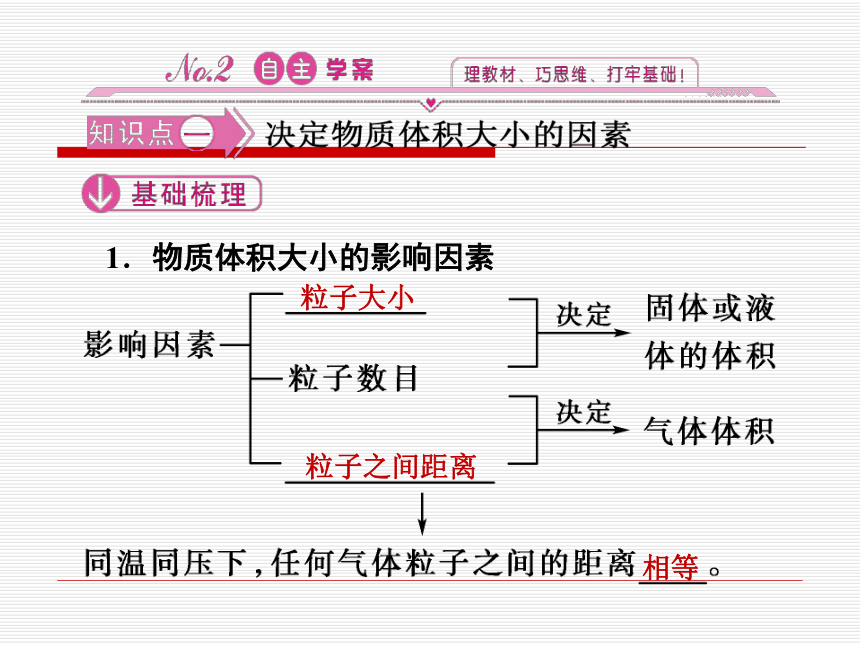
1.物质体积大小的影响因素
粒子大小
粒子之间距离
相等
2.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相 同______________。
数目的粒子
阿伏加德罗定律推论
[温馨提示] (1)阿伏加德罗定律的适用条件不仅仅是标准状况,也可以是其他温度和压强条件下,只要物质的存在状态一定是气态即可。
(2)同温、同压、同体积和同分子数,共同存在、相互制约,只要三“同”成立,第四“同”必定成立。
(3)阿伏加德罗定律推论不可死记公式,要通过阿伏加德罗定律进行推导,在理解的基础上记忆。
1.关于同温同压下等体积的CO2和CO,下列叙述:①质量相等,②密度相等,③所含分子数相等,④所含碳原子数相等,其中正确的是( )
A.①②③④ B.②③④
C.③④ D.③
解析: 根据阿伏加德罗定律知,同温同压同体积,则物质的量相等,物质的量相等则碳原子数相等,但其质量和密度不相等。
答案: C
1.定义:单位__________的气体所占有的 _____。符号:____,单位______________
和m3/mol(或m3·mol-1)。
2.计算公式:Vm=______。
3.影响气体摩尔体积的因素
(1)气体摩尔体积的数值取决于气体所处的 ______和______。
(2)标准状况下(即_____________),气体摩 尔体积约为__________。
物质的量
体积
Vm
L/mol(或L·mol-1)
温度
压强
0 ℃和101 kPa
22.4 L/mol
气体摩尔体积
1.适用范围
气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。
2.下列说法不正确的是( )
A.1 mol H2的质量只有在标准状况下才约为2 g
B.在标准状况下,1 mol任何气体的体积都约为22.4 L
C.273 ℃,1.01×105 Pa状况下,1 mol气体体积大于22.4 L
D.标准状况下,0.5 mol O2和0.5 mol N2组成的混合气体体积约为22.4 L
解析: 气体的质量只与气体的摩尔质量和气体的物质的量有关,与气体的温度、压强无关,1 mol H2的质量为2 g是不变的,A选项不正确;B选项正确;C选项中273 ℃高于0 ℃,温度升高,气体分子间的距离增大,气体的体积增大,C选项正确;无论是混合气体还是纯净的气体,在标准状况下,1 mol任何气体的体积都约为22.4 L,D选项正确。
答案: A
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
答案: B
[思考感悟] 本题主要考查阿伏加德罗定律的应用。
1.在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物Z,则该化合物的化学式为( )
A.XY3 B.XY
C.X3Y D.X2Y3
解析: 同温同压下气体的体积之比等于其物质的量之比,可以确定反应物与生成物的系数之比,根据系数之比确定反应方程式为X2+3Y2===2Z,利用反应前后的原子个数相等可知Z的化学式为XY3。
答案: A
下列叙述正确的是( )
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.标准状况下,1 mol H2O所占的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都是1 mol
解析: A项,没有指明所处的状况;B项,没有指明物质的状态,气体摩尔体积仅适用于气体;C项,水在标准状况下不是气体;D项正确。
答案: D
[思考感悟] 应用“22.4 L/mol”时应注意以下两点:
(1)该物质是否为气体。
(2)该物质是否在标准状况下。
2.在273 K和101 kPa的条件下,将2.00 g氦气,1.40 g 氮气和1.60 g氧气混合,该混合气体的体积是( )
A.6.72 L B.7.84 L
C.10.08 L D.13.44 L
答案: D
热点实验 对一定量气体体积的探究
[探究举例] (1)已知1 mol不同气体在不同条件下的体积:
化学式 条件 1 mol气体体积/L
H2 0 ℃,101 kPa 22.4
O2 0 ℃,101 kPa 22.4
CO 0 ℃,101 kPa 22.4
化学式 条件 1 mol气体体积/L
H2 0 ℃,202 kPa 11.2
CO2 0 ℃,202 kPa 11.2
N2 273 ℃,202 kPa 22.4
NH3 273 ℃,202 kPa 22.4
(2)从上表分析得出的结论:①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”、“一定不”或“不一定”)相等。
(3)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:①______________________,②___________。
(4)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
1.(原创题)意大利科学家合成出了一种新型的氧分子,其化学式为O4。下列关于O4的说法正确的是( )
A.一个O4分子由两个O2分子构成
B.O4是一种单质
C.等质量的O4和O2含有相同数目的分子
D.O4是一种化合物
解析: 依据单质和化合物的概念可知:O4分子中只含一种元素,属于单质,故B对,D错。A中,一个O4分子应由4个氧原子构成;C中,等质量的O4和O2,其物质的量之比为1∶2,故分子数之比应为1∶2。
答案: B
2.下列说法正确的是( )
A.在常温、常压下,11.2 L N2含有的分子数为0.5NA
B.标准状况下,22.4 L H2和O2的混合物所含分子数为NA
C.标准状况下,60 g乙酸的体积是22.4 L
D.1 mol SO2的体积是22.4 L
答案: B
3.常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )
解析: 由阿伏加德罗定律推论可知:同温同压下,同质量的气体体积之比等于摩尔质量的反比,由于CH4分子的摩尔质量最小,故体积最大。
答案: D
答案: D
5.标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为________;混合气体中甲烷的体积为________;一氧化碳的质量为________。
答案: 19 g·mol-1 6.72 L 2.8 g
第2课时 气体摩尔体积
在化学实验中,需要量取1 mol H2来做实验,如何量取1 mol H2?对于气体来说,我们宏观量取的通常不是质量而是体积,那么1 mol H2的体积到底是多少呢?气体的体积与物质的量之间有什么联系呢?
1.了解气体摩尔体积的含义。
2.掌握标准状况下有关气体摩尔体积的计算。
3.理解阿伏加德罗定律及其推论,并能进行气体多方面的计算与判断。
1.物质体积大小的影响因素
粒子大小
粒子之间距离
相等
2.阿伏加德罗定律
同温同压下,相同体积的任何气体都含有相 同______________。
数目的粒子
阿伏加德罗定律推论
[温馨提示] (1)阿伏加德罗定律的适用条件不仅仅是标准状况,也可以是其他温度和压强条件下,只要物质的存在状态一定是气态即可。
(2)同温、同压、同体积和同分子数,共同存在、相互制约,只要三“同”成立,第四“同”必定成立。
(3)阿伏加德罗定律推论不可死记公式,要通过阿伏加德罗定律进行推导,在理解的基础上记忆。
1.关于同温同压下等体积的CO2和CO,下列叙述:①质量相等,②密度相等,③所含分子数相等,④所含碳原子数相等,其中正确的是( )
A.①②③④ B.②③④
C.③④ D.③
解析: 根据阿伏加德罗定律知,同温同压同体积,则物质的量相等,物质的量相等则碳原子数相等,但其质量和密度不相等。
答案: C
1.定义:单位__________的气体所占有的 _____。符号:____,单位______________
和m3/mol(或m3·mol-1)。
2.计算公式:Vm=______。
3.影响气体摩尔体积的因素
(1)气体摩尔体积的数值取决于气体所处的 ______和______。
(2)标准状况下(即_____________),气体摩 尔体积约为__________。
物质的量
体积
Vm
L/mol(或L·mol-1)
温度
压强
0 ℃和101 kPa
22.4 L/mol
气体摩尔体积
1.适用范围
气体摩尔体积的适用范围是气体,可以是单一气体,也可以是混合气体,如0.2 mol H2与0.8 mol O2的混合气体在标准状况下的体积约为22.4 L。
2.下列说法不正确的是( )
A.1 mol H2的质量只有在标准状况下才约为2 g
B.在标准状况下,1 mol任何气体的体积都约为22.4 L
C.273 ℃,1.01×105 Pa状况下,1 mol气体体积大于22.4 L
D.标准状况下,0.5 mol O2和0.5 mol N2组成的混合气体体积约为22.4 L
解析: 气体的质量只与气体的摩尔质量和气体的物质的量有关,与气体的温度、压强无关,1 mol H2的质量为2 g是不变的,A选项不正确;B选项正确;C选项中273 ℃高于0 ℃,温度升高,气体分子间的距离增大,气体的体积增大,C选项正确;无论是混合气体还是纯净的气体,在标准状况下,1 mol任何气体的体积都约为22.4 L,D选项正确。
答案: A
在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小
答案: B
[思考感悟] 本题主要考查阿伏加德罗定律的应用。
1.在一定温度和压强下,1体积X2气体与3体积Y2气体化合生成2体积气体化合物Z,则该化合物的化学式为( )
A.XY3 B.XY
C.X3Y D.X2Y3
解析: 同温同压下气体的体积之比等于其物质的量之比,可以确定反应物与生成物的系数之比,根据系数之比确定反应方程式为X2+3Y2===2Z,利用反应前后的原子个数相等可知Z的化学式为XY3。
答案: A
下列叙述正确的是( )
A.1 mol任何气体的体积都为22.4 L
B.1 mol任何物质在标准状况下所占的体积都为22.4 L
C.标准状况下,1 mol H2O所占的体积是22.4 L
D.标准状况下,22.4 L的任何气体的物质的量都是1 mol
解析: A项,没有指明所处的状况;B项,没有指明物质的状态,气体摩尔体积仅适用于气体;C项,水在标准状况下不是气体;D项正确。
答案: D
[思考感悟] 应用“22.4 L/mol”时应注意以下两点:
(1)该物质是否为气体。
(2)该物质是否在标准状况下。
2.在273 K和101 kPa的条件下,将2.00 g氦气,1.40 g 氮气和1.60 g氧气混合,该混合气体的体积是( )
A.6.72 L B.7.84 L
C.10.08 L D.13.44 L
答案: D
热点实验 对一定量气体体积的探究
[探究举例] (1)已知1 mol不同气体在不同条件下的体积:
化学式 条件 1 mol气体体积/L
H2 0 ℃,101 kPa 22.4
O2 0 ℃,101 kPa 22.4
CO 0 ℃,101 kPa 22.4
化学式 条件 1 mol气体体积/L
H2 0 ℃,202 kPa 11.2
CO2 0 ℃,202 kPa 11.2
N2 273 ℃,202 kPa 22.4
NH3 273 ℃,202 kPa 22.4
(2)从上表分析得出的结论:①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”、“一定不”或“不一定”)相等。
(3)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:①______________________,②___________。
(4)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
1.(原创题)意大利科学家合成出了一种新型的氧分子,其化学式为O4。下列关于O4的说法正确的是( )
A.一个O4分子由两个O2分子构成
B.O4是一种单质
C.等质量的O4和O2含有相同数目的分子
D.O4是一种化合物
解析: 依据单质和化合物的概念可知:O4分子中只含一种元素,属于单质,故B对,D错。A中,一个O4分子应由4个氧原子构成;C中,等质量的O4和O2,其物质的量之比为1∶2,故分子数之比应为1∶2。
答案: B
2.下列说法正确的是( )
A.在常温、常压下,11.2 L N2含有的分子数为0.5NA
B.标准状况下,22.4 L H2和O2的混合物所含分子数为NA
C.标准状况下,60 g乙酸的体积是22.4 L
D.1 mol SO2的体积是22.4 L
答案: B
3.常温常压下,用等质量的CH4、CO2、O2、SO2四种气体分别吹出四个气球,其中气体为CH4的是( )
解析: 由阿伏加德罗定律推论可知:同温同压下,同质量的气体体积之比等于摩尔质量的反比,由于CH4分子的摩尔质量最小,故体积最大。
答案: D
答案: D
5.标准状况下的甲烷和一氧化碳的混合气体8.96 L,其质量为7.60 g,则混合气体平均相对分子质量为________;混合气体中甲烷的体积为________;一氧化碳的质量为________。
答案: 19 g·mol-1 6.72 L 2.8 g
