3.1.2 金属与酸和水的反应 (人教版必修1)
文档属性
| 名称 | 3.1.2 金属与酸和水的反应 (人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 647.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 12:04:51 | ||
图片预览











文档简介
(共47张PPT)
第2课时 金属与酸和水的反应
铝与氢氧化钠溶液的反应
铝与酸溶液反应可生成H2,你还知道铝与哪些溶液反应也能产生H2吗?
1.掌握钠与水反应的原理、现象。
2.了解Al与NaOH溶液的反应。
3.通过金属及其化合物性质的实验,提高对“化学是一门以实验为基础的科学”的认识,培养实验意识、操作技能、观察能力和分析问题的能力等。
1.金属与酸的反应
酸与金属活动性顺序表中氢以前的金属发生置换反应生成盐和氢气。金属越活泼,反应越剧烈。如Zn、Al、Fe和稀盐酸反应化学方程式分别为:
金属与酸和水的反应
Zn+2HCl===ZnCl2+H2↑
2Al+6HCl===2AlCl3+3H2↑
Fe+2HCl===FeCl2+H2↑
2.钠与水(已滴加酚酞试液)剧烈反应
现象 产生此现象的原因
钠块浮在水面上 ____________
熔成光亮的小球 钠的________,
反应放热
在水面迅速地四处游动,并发出“嘶嘶”的声音 _________
溶液由无色变成红色 _______
密度比水小
熔点低
生成气体
生成碱
钠与水反应的离子方程式为
2Na+2H2O===2Na++2OH-+H2↑
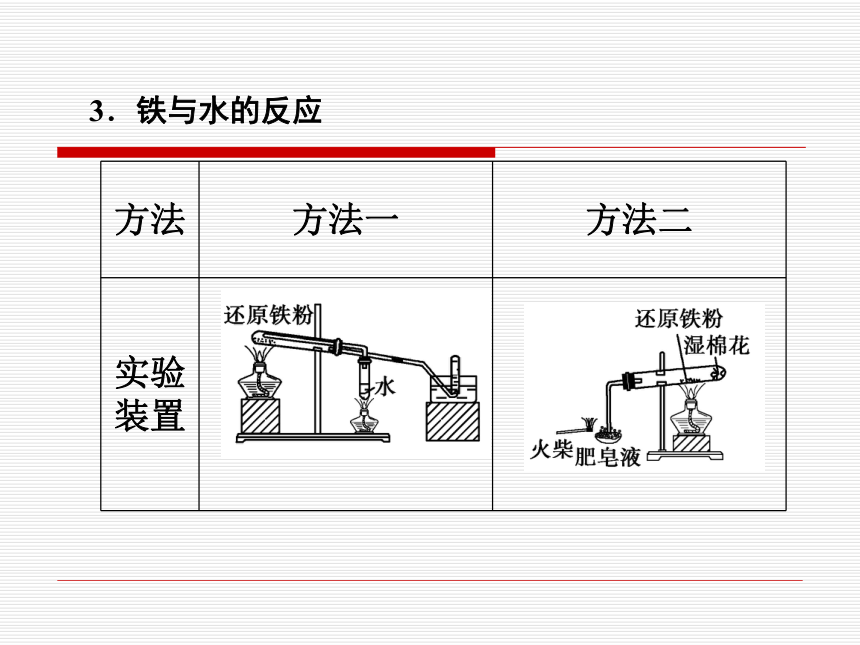
3.铁与水的反应
方法 方法一 方法二
实验装置
气体 用小试管收集一试管 气体,点燃,听到轻 微噗声证明生成了___ 用火柴点燃肥皂泡, 听到爆鸣声,证明 生成了___
实验结论 铁不能与冷水、热水反应,但高温能与水蒸气反应,化学反应方程式为:
_____________________________
H2
H2
钠与酸、碱、盐的反应
1.反应实质:一般情况下钠与任何水溶液反应时,都是钠与该溶液中的H+反应,产生H2。
2.具体反应的分析
物质分类 反应分析
酸 钠与酸反应时先与酸中的H+反应,如2Na+2HCl===2NaCl+H2↑
(2)如果钠过量,钠把酸消耗尽之后,再与水反应
碱 钠与碱溶液反应时其实质是钠与水的反应
碱 钠与碱溶液反应时其实质是钠与水的反应
盐 钠与盐溶液反应时先与水反应,它包括两种情况:
(1)如果盐溶液中的溶质与氢氧化钠不反应只发生钠与水的反应
(2)如果盐溶液中的溶质与氢氧化钠反应,则会发生两个反应
如钠与FeCl3溶液反应:
2Na+2H2O===2NaOH+H2↑
3NaOH+FeCl3===Fe(OH)3↓+3NaCl
总反应为:6Na+6H2O+2FeCl3===2Fe(OH)3↓+3H2↑+6NaCl
1.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是(多选)( )
A.BaCl2溶液 B.K2SO4溶液
C.FeCl3溶液 D.饱和石灰水溶液
解析: Na与H2O反应生成了NaOH和H2,Fe3++3OH-===Fe(OH)3↓,Na投入到饱和石灰水溶液之后,与水反应溶剂减少,并且Na与水反应放热,Ca(OH)2的溶解度降低,所以有Ca(OH)2析出。
答案: CD
铝分别与盐酸、NaOH溶液反应的对比实验
铝与氢氧化钠溶液的反应
实验操作
实验
现象 试管中___________,铝片_________; 点燃的木条放在试管口时发出_____声
化学
方程式 ___________________________
离子
方程式 ___________________________
有气泡冒出
慢慢溶解
爆鸣
2Al+6HCl===2AlCl3+3H2↑
2Al+6H+===2Al3++3H2↑
铝与盐酸、氢氧化钠溶液反应的比较
1.反应原理
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2.称取两份铝粉,第一份加入足量的浓NaOH溶液,第二份加入足量的盐酸,如果放出等体积的气体(在同温同压下),则两份铝粉的质量之比为( )
A.1∶2 B.1∶3
C.3∶2 D.1∶1
解析: 不论铝与氢氧化钠溶液反应,还是与盐酸反应,均是Al失电子:Al-3e-===Al3+,还原产物都是H2,则都有如下关系:2Al~6e-~3H2。两种反应虽不同,但放出H2的体积相同,所以消耗Al的质量也相同。
答案: D
由Zn、Fe、Mg、Al四种金属中的两种组成的混合物10 g与足量的盐酸反应产生1.0 g H2,则混合物中一定含有的金属是( )
A.Zn B.Fe
C.Al D.Mg
金属与酸的反应
答案: C
1.(2010·西安高一检测)Mg、Al、Fe三种金属分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量相等,则下列说法中正确的是( )
A.三种金属物质的量相等
B.三种金属均过量
C.三种金属的质量相等
D.盐酸均过量
解析: 根据反应的化学方程式知,等质量的三种金属与酸反应产生H2不等,等物质的量时,Al、Mg、Fe与酸反应产生H2的量不等,若三种金属均过量,则产生H2的量由盐酸决定。
答案: B
(2010·合肥高一检测)取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则消耗的HCl和NaOH的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
铝与氢氧化钠溶液反应的计算
思路点拨:
解析: 铝与盐酸和烧碱溶液反应的化学方程式分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,当生成等体积气体时消耗HCl、NaOH的物质的量之比为3∶1。
答案: C
2.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5∶6,则甲、乙烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
解析: 若酸碱过量,则等质量的铝与之反应,生成等量的H2,因生成气体体积比为5∶6,则H2SO4不足。
答案: B
热点实验 铝的相对原子质量的实验探究
[探究举例] 某学习小组用如图装置测定铝镁混合物中铝的相对原子质量。
(1)A中试剂为____________。
(2)B中发生反应的化学方程式为____________________________________________。
(3)若实验用铝镁混合物的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________。
解析: (1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而Mg不反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量。(2)B中发生的是Al与碱溶液的反应。(3)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量。而n(Al)可以由产生的H2的量求得。
1.钠与水反应时产生的各种现象如下:
①钠浮在水面上 ②钠沉在水底 ③钠熔化成小球 ④小球迅速游动逐渐减小,最后消失 ⑤发生嘶嘶的声音 ⑥滴入酚酞后溶液显红色。其中正确的一组是( )
A.①②③④⑤ B.全部
C.①②③⑤⑥ D.①③④⑤⑥
解析: 金属钠的密度比水的要小,熔点较
低,与水反应时剧烈,产生气体和氢氧化钠。
答案: D
2.下列说法正确的是( )
A.钠在溶液中可置换出铁
B.铁在溶液中可置换出铜
C.Fe不与H2O反应
D.Fe比Al活泼
解析: 钠在铁盐溶液中先与H2O发生反应,故不能置换出铁。铁可置换出铜盐溶液中的铜,如:Fe+CuSO4===FeSO4+Cu。Fe在高温下可以与H2O(g)发生反应而生成Fe3O4和H2。在金属活动性顺序表中Al排在Fe的前面,故Al比Fe活泼。
答案: B
3.如图所示的实验中,投入铝片后( )
A.①中产生气泡,②中不产
生气泡
B.①和②中都不产生气泡
C.①和②中都产生气泡,
①中是H2,②中是O2
D.①和②中都产生气泡,
且都是H2
解析: 铝片既能与酸溶液反应又能与强碱溶液反应产生氢气。
答案: D
解析: A项产物Fe2O3错,应为Fe3O4,B项错,应有H2O参与反应;C项原子不守恒。
答案: D
5.(1)分别取W克钠、铁、铝与足量的盐酸反
应,在相同条件下产生氢气的体积比是____________;
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反
应,在相同条件下产生氢气的体积比是____________;
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是______________;
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是____________。
第2课时 金属与酸和水的反应
铝与氢氧化钠溶液的反应
铝与酸溶液反应可生成H2,你还知道铝与哪些溶液反应也能产生H2吗?
1.掌握钠与水反应的原理、现象。
2.了解Al与NaOH溶液的反应。
3.通过金属及其化合物性质的实验,提高对“化学是一门以实验为基础的科学”的认识,培养实验意识、操作技能、观察能力和分析问题的能力等。
1.金属与酸的反应
酸与金属活动性顺序表中氢以前的金属发生置换反应生成盐和氢气。金属越活泼,反应越剧烈。如Zn、Al、Fe和稀盐酸反应化学方程式分别为:
金属与酸和水的反应
Zn+2HCl===ZnCl2+H2↑
2Al+6HCl===2AlCl3+3H2↑
Fe+2HCl===FeCl2+H2↑
2.钠与水(已滴加酚酞试液)剧烈反应
现象 产生此现象的原因
钠块浮在水面上 ____________
熔成光亮的小球 钠的________,
反应放热
在水面迅速地四处游动,并发出“嘶嘶”的声音 _________
溶液由无色变成红色 _______
密度比水小
熔点低
生成气体
生成碱
钠与水反应的离子方程式为
2Na+2H2O===2Na++2OH-+H2↑
3.铁与水的反应
方法 方法一 方法二
实验装置
气体 用小试管收集一试管 气体,点燃,听到轻 微噗声证明生成了___ 用火柴点燃肥皂泡, 听到爆鸣声,证明 生成了___
实验结论 铁不能与冷水、热水反应,但高温能与水蒸气反应,化学反应方程式为:
_____________________________
H2
H2
钠与酸、碱、盐的反应
1.反应实质:一般情况下钠与任何水溶液反应时,都是钠与该溶液中的H+反应,产生H2。
2.具体反应的分析
物质分类 反应分析
酸 钠与酸反应时先与酸中的H+反应,如2Na+2HCl===2NaCl+H2↑
(2)如果钠过量,钠把酸消耗尽之后,再与水反应
碱 钠与碱溶液反应时其实质是钠与水的反应
碱 钠与碱溶液反应时其实质是钠与水的反应
盐 钠与盐溶液反应时先与水反应,它包括两种情况:
(1)如果盐溶液中的溶质与氢氧化钠不反应只发生钠与水的反应
(2)如果盐溶液中的溶质与氢氧化钠反应,则会发生两个反应
如钠与FeCl3溶液反应:
2Na+2H2O===2NaOH+H2↑
3NaOH+FeCl3===Fe(OH)3↓+3NaCl
总反应为:6Na+6H2O+2FeCl3===2Fe(OH)3↓+3H2↑+6NaCl
1.金属钠分别与下列溶液反应时,既有沉淀析出,又有气体逸出的是(多选)( )
A.BaCl2溶液 B.K2SO4溶液
C.FeCl3溶液 D.饱和石灰水溶液
解析: Na与H2O反应生成了NaOH和H2,Fe3++3OH-===Fe(OH)3↓,Na投入到饱和石灰水溶液之后,与水反应溶剂减少,并且Na与水反应放热,Ca(OH)2的溶解度降低,所以有Ca(OH)2析出。
答案: CD
铝分别与盐酸、NaOH溶液反应的对比实验
铝与氢氧化钠溶液的反应
实验操作
实验
现象 试管中___________,铝片_________; 点燃的木条放在试管口时发出_____声
化学
方程式 ___________________________
离子
方程式 ___________________________
有气泡冒出
慢慢溶解
爆鸣
2Al+6HCl===2AlCl3+3H2↑
2Al+6H+===2Al3++3H2↑
铝与盐酸、氢氧化钠溶液反应的比较
1.反应原理
2Al+6HCl===2AlCl3+3H2↑
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2.称取两份铝粉,第一份加入足量的浓NaOH溶液,第二份加入足量的盐酸,如果放出等体积的气体(在同温同压下),则两份铝粉的质量之比为( )
A.1∶2 B.1∶3
C.3∶2 D.1∶1
解析: 不论铝与氢氧化钠溶液反应,还是与盐酸反应,均是Al失电子:Al-3e-===Al3+,还原产物都是H2,则都有如下关系:2Al~6e-~3H2。两种反应虽不同,但放出H2的体积相同,所以消耗Al的质量也相同。
答案: D
由Zn、Fe、Mg、Al四种金属中的两种组成的混合物10 g与足量的盐酸反应产生1.0 g H2,则混合物中一定含有的金属是( )
A.Zn B.Fe
C.Al D.Mg
金属与酸的反应
答案: C
1.(2010·西安高一检测)Mg、Al、Fe三种金属分别跟同浓度、同体积的稀盐酸反应时,放出的氢气质量相等,则下列说法中正确的是( )
A.三种金属物质的量相等
B.三种金属均过量
C.三种金属的质量相等
D.盐酸均过量
解析: 根据反应的化学方程式知,等质量的三种金属与酸反应产生H2不等,等物质的量时,Al、Mg、Fe与酸反应产生H2的量不等,若三种金属均过量,则产生H2的量由盐酸决定。
答案: B
(2010·合肥高一检测)取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则消耗的HCl和NaOH的物质的量之比为( )
A.1∶1 B.2∶1
C.3∶1 D.1∶3
铝与氢氧化钠溶液反应的计算
思路点拨:
解析: 铝与盐酸和烧碱溶液反应的化学方程式分别为2Al+6HCl===2AlCl3+3H2↑,2Al+2NaOH+2H2O===2NaAlO2+3H2↑,当生成等体积气体时消耗HCl、NaOH的物质的量之比为3∶1。
答案: C
2.等体积、等物质的量浓度的硫酸、氢氧化钠溶液分别放在甲、乙两烧杯中,各加入等质量的铝,生成氢气的体积比为5∶6,则甲、乙烧杯中的反应情况可能分别是( )
A.甲、乙中都是铝过量
B.甲中铝过量,乙中碱过量
C.甲中酸过量,乙中铝过量
D.甲中酸过量,乙中碱过量
解析: 若酸碱过量,则等质量的铝与之反应,生成等量的H2,因生成气体体积比为5∶6,则H2SO4不足。
答案: B
热点实验 铝的相对原子质量的实验探究
[探究举例] 某学习小组用如图装置测定铝镁混合物中铝的相对原子质量。
(1)A中试剂为____________。
(2)B中发生反应的化学方程式为____________________________________________。
(3)若实验用铝镁混合物的质量为a g,测得氢气体积为b mL(已换算为标准状况),B中剩余固体的质量为c g,则铝的相对原子质量为________。
解析: (1)Mg、Al均可以和酸反应,因此不可以用酸来实验,由于Al可以和碱反应而Mg不反应,则可以用NaOH与Al反应制得H2,然后用排水法收集H2,以计算Al的量。(2)B中发生的是Al与碱溶液的反应。(3)(a-c)即为铝的质量,再除以Al的物质的量即为铝的摩尔质量。而n(Al)可以由产生的H2的量求得。
1.钠与水反应时产生的各种现象如下:
①钠浮在水面上 ②钠沉在水底 ③钠熔化成小球 ④小球迅速游动逐渐减小,最后消失 ⑤发生嘶嘶的声音 ⑥滴入酚酞后溶液显红色。其中正确的一组是( )
A.①②③④⑤ B.全部
C.①②③⑤⑥ D.①③④⑤⑥
解析: 金属钠的密度比水的要小,熔点较
低,与水反应时剧烈,产生气体和氢氧化钠。
答案: D
2.下列说法正确的是( )
A.钠在溶液中可置换出铁
B.铁在溶液中可置换出铜
C.Fe不与H2O反应
D.Fe比Al活泼
解析: 钠在铁盐溶液中先与H2O发生反应,故不能置换出铁。铁可置换出铜盐溶液中的铜,如:Fe+CuSO4===FeSO4+Cu。Fe在高温下可以与H2O(g)发生反应而生成Fe3O4和H2。在金属活动性顺序表中Al排在Fe的前面,故Al比Fe活泼。
答案: B
3.如图所示的实验中,投入铝片后( )
A.①中产生气泡,②中不产
生气泡
B.①和②中都不产生气泡
C.①和②中都产生气泡,
①中是H2,②中是O2
D.①和②中都产生气泡,
且都是H2
解析: 铝片既能与酸溶液反应又能与强碱溶液反应产生氢气。
答案: D
解析: A项产物Fe2O3错,应为Fe3O4,B项错,应有H2O参与反应;C项原子不守恒。
答案: D
5.(1)分别取W克钠、铁、铝与足量的盐酸反
应,在相同条件下产生氢气的体积比是____________;
(2)分别取0.1 mol钠、铁、铝与足量的盐酸反
应,在相同条件下产生氢气的体积比是____________;
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量比是______________;
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝三种金属的物质的量之比是____________。
