3.2.1 钠的重要化合物(人教版必修1)
文档属性
| 名称 | 3.2.1 钠的重要化合物(人教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 00:00:00 | ||
图片预览











文档简介
(共60张PPT)
第二节 几种重要的金属化合物
第1课时 钠的重要化合物
我们在化学课和日常生活中接触过很多含钠的化合物,如NaCl、NaOH、Na2O以及家里的厨房中使用的纯碱和小苏打等。你知道它们有哪些性质和用途吗?
1.了解氧化钠、过氧化钠的主要性质和用途。
2.了解碳酸钠、碳酸氢钠的主要性质和用途。
3.了解焰色反应的概念及操作。
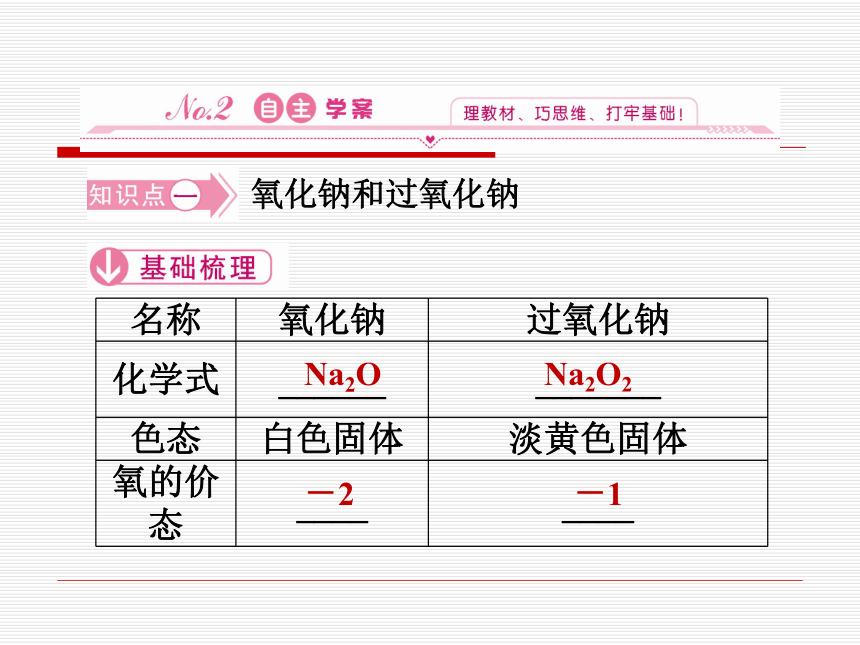
氧化钠和过氧化钠
名称 氧化钠 过氧化钠
化学式 ______ _______
色态 白色固体 淡黄色固体
氧的价态 ____ ____
Na2O
-2
Na2O2
-1
与H2O 反应 Na2O+H2O===2NaOH ________________
__________________
与CO2
反应 Na2O+CO2===Na2CO3 _________________
_______________
稳定性 _________ _______
用途 _______________________
保存 隔绝空气、密封保存 隔绝空气、密封保存、远离易燃物
2Na2O2+2H2O
===4NaOH+O2↑
2Na2O2+2CO2===
2Na2CO3+O2
较不稳定
较稳定
氧化剂、供氧剂、漂白剂
Na2O2与CO2、H2O反应的有关量的关系
(1)物质的量的关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O(g)与放出O2的物质的量之比均为2∶1,即气体减小的体积等于生成O2的体积。
(2)固体质量关系
相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(实际上两反应不能发生)。
(3)先后顺序关系
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,解决问题时可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应(实际情况复杂得多)。
(4)电子转移关系
不论是与CO2还是与H2O反应,CO2与H2O均既不是氧化剂也不是还原剂,反应的实质都是Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。
1.下列关于Na2O、Na2O2的比较,正确的是 ( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2在和CO2的反应中,既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子
解析:A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不是碱性氧化物;B项,Na2O2是淡黄色固体;C项,Na2O2与CO2反应时电子转移关系:2Na2O2+2CO2===2Na2CO3得到2×e-+O2失去2×e-,Na2O2中-1价的O变成了-2价的O和零价的O;D项,Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和零价的O,故1 mol Na2O2转移1 mol电子。
答案: C
碳酸钠和碳酸氢钠
名称 碳酸钠 碳酸氢钠
化学式 ________ __________
色态 ___色粉末 细小___色晶体
俗名 __________ _______
溶解性 水中_____ 水中_____,但比 Na2CO3溶解度小
Na2CO3
NaHCO3
白
白
纯碱、苏打
小苏打
易溶
易溶
与足量盐酸反应 产生气体速率 ___ 快
原理
_______________ __________________ ______ __________
_________________________
与CO2
反应 Na2CO3+CO2+H2O===2NaHCO3 不反应
Na2CO3+2HCl
===2NaCl+H2O+
CO2↑
NaHCO3+
HCl===NaCl+
H2O+CO2↑
慢
与NaOH溶液反应(离子方程式) 不反应 _______________
__________
受热分解
(化学方程式) 不分解 ________________ ______________
水溶液
酸碱性 ___性 ___性
HCO+OH-===
CO+H2O
2NaHCO3Na2CO3
+H2O+CO2↑
碱
碱
Na2CO3与NaHCO3的鉴别、除杂与转化
1.鉴别
依据 方法
热稳定性 加热有气体产生的是NaHCO3,无变化的是Na2CO3
与CaCl2(BaCl2)的反应 有沉淀生成的是Na2CO3,无变化的是NaHCO3
固体与盐酸反应的剧烈程度 生成气体剧烈的是NaHCO3相对不剧烈的是Na2CO3
溶液中逐滴加入盐酸时的现象 逐滴加入盐酸立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
2.除杂(括号内为杂质)
混合物 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
3.转化
2.下列说法不正确的是( )
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3比NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,得到的CO2物质的量比为2∶1
解析: 根据碳原子守恒,等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成CO2的物质的量比为1∶1。
答案: D
1.定义
很多____________________在灼烧时都会使火 焰呈现特殊的颜色。
焰色反应
金属或它们的化合物
2.操作
3.几种金属的焰色
钠:___色,钾:___色(观察时要透过 ___________)
黄
紫
蓝色钴玻璃
焰色反应及实验操作
1.焰色反应的含义
多种金属及其化合物在灼烧时使火焰呈现特殊的颜色,这种现象在化学上叫焰色反应。
常见金属或金属化合物焰色反应的颜色如下:
金属或金属离子 锂 钠 钾 铷 钙 锶 钡 铜
焰色反应的颜色 紫红色 黄色 紫色(透过蓝色钴玻璃) 紫色 砖红色 洋红色 黄绿色 绿色
2.焰色反应的操作方法
若以铂丝作为灼烧物质的载体,操作方法如下。
①洗——用稀盐酸刷洗铂丝。目的是使铂丝上的高沸点杂质转化为沸点相对较低的氯化物。
②烧——将用盐酸洗涤过的铂丝在火焰上灼烧。目的是除去铂丝上的杂质。注意:a.所用的火焰是无色或浅色的;b.要一直烧至火焰恢复到原来的无色或浅色为止。
③蘸——用灼烧合格的铂丝蘸取被灼烧的物质。
④烧——将沾在铂丝上的物质在火焰上灼烧。
[温馨提示] (1)在观察钾的焰色反应的焰色时,要透过蓝色的钴玻璃片观察,其主要原因是钾及钾的化合物中可能混有钠元素,钠的黄色火焰能掩盖钾的紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾或钾的化合物中混有钠元素所造成的干扰。
(2)①焰色反应的元素对象是金属元素,物质对象是单质或化合物;
②焰色反应并不是化学反应,但钠、钾等金属单质在燃烧过程中既有化学反应又有焰色反应;
③不是所有金属元素都能发生焰色反应;
④焰色反应常用于对金属元素(主要是钠和钾)进行鉴别或鉴定。
3.鉴别下列物质只能采用焰色反应的是( )
A.KClO3、NaCl B.KCl、Na2CO3
C.NaCl、MgCl2 D.NaCl、KCl
答案: D
下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
Na2O与Na2O2的性质
解析: Na2O2和Na2O都能与H2O和CO2反应,共同的产物分别是NaOH、Na2CO3,不同之处是Na2O2与H2O和CO2的产物中还有O2。A项,二者长期置于空气中,都最终生成Na2CO3,A项正确;B项,Na2O2与H2O或CO2的反应不是化合反应;C项,Na2O2和Na2O与水反应都有NaOH生成,正确;D项,Na2O2是强氧化剂,Na2O没有强氧化性,属于碱性氧化物,正确。
答案: B
[思考感悟] 过氧化钠性质的特殊性
(1)在氧化钠中含有Na+和O2-,在过氧化钠中含有Na+和O,所以二者中阳离子和阴离子的个数比都是2∶1。
(2)过氧化钠和其他物质反应时不一定有氧气产生,如具有强还原性的SO2,能被Na2O2氧化成Na2SO4:SO2+Na2O2===Na2SO4。
(3)过氧化钠虽然能够和盐酸反应生成盐和水,但同时还有氧气产生,所以它不属于碱性氧化物。
1.经测定某固体混合物中,只含钠和氧两种元素,将其放入足量水中,可产生两种气体,则该混合物( )
A.一定没有钠单质
B.一定有氧化钠
C.含有两种或两种以上物质
D.只含有两种物质
解析: 固体物质只含钠和氧两种元素,与水反应产生两种气体,两种气体分别为H2和O2。固体物质中一定有钠和过氧化钠,可能有Na2O,也可能没有Na2O。
答案: C
有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸
C.分别将它们配制成溶液,再加入CaCl2溶液
D.分别加热,再用石灰水检验是否有CO2产生
Na2CO3与NaHCO3性质比较
解析: A项中发生的反应分别为:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项Na2CO3溶液中滴加盐酸,开始无现象,后来产生气体,而NaHCO3溶液中一滴入盐酸立即产生气体,现象不同;
答案: A
2.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体
B.加入氢氧化钡溶液
C.加入澄清石灰水
D.加入稀盐酸
解析: 除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成分。溶液中可用这样的方法:Na2CO3+CO2+H2O===2NaHCO3。
答案: A
热点实验 物质稳定性实验探究
[探究举例] “套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。请观察下列实验装置,分析实验原理,并回答下列问题:
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有____________________________。
(2)整个实验结束时,在操作上需要特别注意的问题是____________________________。
(3)通过该实验可以得出的结论是(结合化学方程式来说明)
____________________________。
解析:(1)气体受热膨胀,所以一开始加热,A、B烧杯中均有气泡逸出,加热一段时间后可看到小试管内有水珠,说明NaHCO3分解,同时烧杯B溶液变浑浊,而烧杯A中无明显变化。
(2)当实验结束时应先将导管从澄清石灰水中取出,防止倒吸。
(3)从图示可以看出NaHCO3受热分解了,而Na2CO3受热没有分解,说明Na2CO3比NaHCO3稳定。
1.北京奥运会开幕式向全世界兑现了“科技奥运”的承诺,其中焰火打出的五环标志如图所示。下列有关说法正确的是( )
A.焰火是碱金属等发生燃烧的现象
B.焰火是碱金属等发生焰色反应
C.焰火的火树银花的效果是金属单质在空气中燃烧产生的
D.某样品的焰色反应呈黄色,说明它只含钠元素,不含其他金属元素
解析: 北京奥运会开幕式上的焰火是碱金属等发生焰色反应形成的,它不属于化学变化。钠的焰色会掩盖钾的焰色,所以,某样品的焰色呈黄色,说明它一定含有钠元素,可能还含有钾元素等。
答案: B
2.钠在空气中燃烧的有关叙述正确的是( )
A.钠在空气中燃烧时火焰呈淡蓝色
B.钠在空气中燃烧时生成的是白色的氧化钠
C.钠在空气中燃烧时生成的是淡黄色的过氧化钠
D.钠在燃烧时生成的过氧化钠中氧元素的化合价为-2价
解析: 钠在空气中燃烧生成的是淡黄色的过氧化钠,由于钠的焰色反应呈黄色,所以燃烧时火焰呈黄色。
答案: C
3.关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3B.在水中的溶解性:NaHCO3C.与盐酸反应的速率:NaHCO3D.等物质的量的Na2CO3、NaHCO3分别与足量盐酸反应产生的CO2质量相同
答案: C
4.下列物质必须隔绝空气保存的是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl
A.①② B.②③④⑤
C.①②③④ D.①②③④⑤
解析: Na与空气中的水、O2反应,Na2O和Na2O2均与空气中的CO2、H2O反应,NaOH与空气中的CO2反应,都必须隔绝空气保存。
答案: C
5.下图所示各步变化,A为金属,B为淡黄色固体粉末,每一物质均含有A元素。
(1)写出下列物质的化学式:
B______,C______,E______,F________。
(2)写出下列各步反应的化学方程式。
C→E_______________________________________________________________;
可知,D、E分别为Na2O、NaCl、NaOH中的一种,由Na2O2的性质可知,C必为Na2CO3,则F为NaHCO3,由Na2CO3→E可知,E为NaOH或NaCl,由D→C知,E为NaOH时,D只能为Na2O;当E为NaCl时,D可以为Na2O或NaOH。
第二节 几种重要的金属化合物
第1课时 钠的重要化合物
我们在化学课和日常生活中接触过很多含钠的化合物,如NaCl、NaOH、Na2O以及家里的厨房中使用的纯碱和小苏打等。你知道它们有哪些性质和用途吗?
1.了解氧化钠、过氧化钠的主要性质和用途。
2.了解碳酸钠、碳酸氢钠的主要性质和用途。
3.了解焰色反应的概念及操作。
氧化钠和过氧化钠
名称 氧化钠 过氧化钠
化学式 ______ _______
色态 白色固体 淡黄色固体
氧的价态 ____ ____
Na2O
-2
Na2O2
-1
与H2O 反应 Na2O+H2O===2NaOH ________________
__________________
与CO2
反应 Na2O+CO2===Na2CO3 _________________
_______________
稳定性 _________ _______
用途 _______________________
保存 隔绝空气、密封保存 隔绝空气、密封保存、远离易燃物
2Na2O2+2H2O
===4NaOH+O2↑
2Na2O2+2CO2===
2Na2CO3+O2
较不稳定
较稳定
氧化剂、供氧剂、漂白剂
Na2O2与CO2、H2O反应的有关量的关系
(1)物质的量的关系
无论是CO2或H2O(g)的单一物质还是二者的混合物,通过足量的Na2O2时,CO2或H2O(g)与放出O2的物质的量之比均为2∶1,即气体减小的体积等于生成O2的体积。
(2)固体质量关系
相当于固体(Na2O2)只吸收了CO2中的“CO”,H2O中的“H2”;可以看作发生相应的反应:Na2O2+CO===Na2CO3、Na2O2+H2===2NaOH(实际上两反应不能发生)。
(3)先后顺序关系
一定量的Na2O2与一定量CO2和H2O(g)的混合物的反应,解决问题时可视作Na2O2先与CO2反应,待CO2反应完成后,Na2O2再与H2O发生反应(实际情况复杂得多)。
(4)电子转移关系
不论是与CO2还是与H2O反应,CO2与H2O均既不是氧化剂也不是还原剂,反应的实质都是Na2O2自身发生的氧化还原反应,所以每有1 mol O2生成时,转移的电子均为2 mol。
1.下列关于Na2O、Na2O2的比较,正确的是 ( )
A.Na2O2、Na2O都是钠的氧化物,都是碱性氧化物
B.Na2O2、Na2O都是可溶于水(或能与水反应)的白色固体
C.Na2O2在和CO2的反应中,既是氧化剂,又是还原剂
D.Na2O2与水反应时,1 mol Na2O2转移2 mol电子
解析:A项,Na2O2与水反应除了生成NaOH外,还有O2生成,所以Na2O2只是Na的氧化物,但不是碱性氧化物;B项,Na2O2是淡黄色固体;C项,Na2O2与CO2反应时电子转移关系:2Na2O2+2CO2===2Na2CO3得到2×e-+O2失去2×e-,Na2O2中-1价的O变成了-2价的O和零价的O;D项,Na2O2与H2O反应时,Na2O2中-1价的O变成了-2价的O和零价的O,故1 mol Na2O2转移1 mol电子。
答案: C
碳酸钠和碳酸氢钠
名称 碳酸钠 碳酸氢钠
化学式 ________ __________
色态 ___色粉末 细小___色晶体
俗名 __________ _______
溶解性 水中_____ 水中_____,但比 Na2CO3溶解度小
Na2CO3
NaHCO3
白
白
纯碱、苏打
小苏打
易溶
易溶
与足量盐酸反应 产生气体速率 ___ 快
原理
_______________ __________________ ______ __________
_________________________
与CO2
反应 Na2CO3+CO2+H2O===2NaHCO3 不反应
Na2CO3+2HCl
===2NaCl+H2O+
CO2↑
NaHCO3+
HCl===NaCl+
H2O+CO2↑
慢
与NaOH溶液反应(离子方程式) 不反应 _______________
__________
受热分解
(化学方程式) 不分解 ________________ ______________
水溶液
酸碱性 ___性 ___性
HCO+OH-===
CO+H2O
2NaHCO3Na2CO3
+H2O+CO2↑
碱
碱
Na2CO3与NaHCO3的鉴别、除杂与转化
1.鉴别
依据 方法
热稳定性 加热有气体产生的是NaHCO3,无变化的是Na2CO3
与CaCl2(BaCl2)的反应 有沉淀生成的是Na2CO3,无变化的是NaHCO3
固体与盐酸反应的剧烈程度 生成气体剧烈的是NaHCO3相对不剧烈的是Na2CO3
溶液中逐滴加入盐酸时的现象 逐滴加入盐酸立即产生气体的是NaHCO3,开始不产生气体,滴加一会才产生气体的是Na2CO3
2.除杂(括号内为杂质)
混合物 除杂方法及试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
3.转化
2.下列说法不正确的是( )
A.Na2CO3比NaHCO3溶解度大
B.Na2CO3比NaHCO3稳定
C.Na2CO3比NaHCO3都能跟石灰水反应得到白色沉淀
D.物质的量相等的Na2CO3和NaHCO3分别与足量盐酸反应,得到的CO2物质的量比为2∶1
解析: 根据碳原子守恒,等物质的量的Na2CO3和NaHCO3与足量盐酸反应生成CO2的物质的量比为1∶1。
答案: D
1.定义
很多____________________在灼烧时都会使火 焰呈现特殊的颜色。
焰色反应
金属或它们的化合物
2.操作
3.几种金属的焰色
钠:___色,钾:___色(观察时要透过 ___________)
黄
紫
蓝色钴玻璃
焰色反应及实验操作
1.焰色反应的含义
多种金属及其化合物在灼烧时使火焰呈现特殊的颜色,这种现象在化学上叫焰色反应。
常见金属或金属化合物焰色反应的颜色如下:
金属或金属离子 锂 钠 钾 铷 钙 锶 钡 铜
焰色反应的颜色 紫红色 黄色 紫色(透过蓝色钴玻璃) 紫色 砖红色 洋红色 黄绿色 绿色
2.焰色反应的操作方法
若以铂丝作为灼烧物质的载体,操作方法如下。
①洗——用稀盐酸刷洗铂丝。目的是使铂丝上的高沸点杂质转化为沸点相对较低的氯化物。
②烧——将用盐酸洗涤过的铂丝在火焰上灼烧。目的是除去铂丝上的杂质。注意:a.所用的火焰是无色或浅色的;b.要一直烧至火焰恢复到原来的无色或浅色为止。
③蘸——用灼烧合格的铂丝蘸取被灼烧的物质。
④烧——将沾在铂丝上的物质在火焰上灼烧。
[温馨提示] (1)在观察钾的焰色反应的焰色时,要透过蓝色的钴玻璃片观察,其主要原因是钾及钾的化合物中可能混有钠元素,钠的黄色火焰能掩盖钾的紫色火焰,而蓝色钴玻璃能滤去黄色的光,这样可以避免钾或钾的化合物中混有钠元素所造成的干扰。
(2)①焰色反应的元素对象是金属元素,物质对象是单质或化合物;
②焰色反应并不是化学反应,但钠、钾等金属单质在燃烧过程中既有化学反应又有焰色反应;
③不是所有金属元素都能发生焰色反应;
④焰色反应常用于对金属元素(主要是钠和钾)进行鉴别或鉴定。
3.鉴别下列物质只能采用焰色反应的是( )
A.KClO3、NaCl B.KCl、Na2CO3
C.NaCl、MgCl2 D.NaCl、KCl
答案: D
下面是比较过氧化钠和氧化钠性质异同点的有关叙述,其中错误的是( )
A.过氧化钠和氧化钠长期置于空气中最终产物相同
B.过氧化钠和氧化钠都能与二氧化碳或水发生化合反应
C.过氧化钠和氧化钠与水反应都有氢氧化钠生成
D.过氧化钠是强氧化剂,而氧化钠只是一种碱性氧化物
Na2O与Na2O2的性质
解析: Na2O2和Na2O都能与H2O和CO2反应,共同的产物分别是NaOH、Na2CO3,不同之处是Na2O2与H2O和CO2的产物中还有O2。A项,二者长期置于空气中,都最终生成Na2CO3,A项正确;B项,Na2O2与H2O或CO2的反应不是化合反应;C项,Na2O2和Na2O与水反应都有NaOH生成,正确;D项,Na2O2是强氧化剂,Na2O没有强氧化性,属于碱性氧化物,正确。
答案: B
[思考感悟] 过氧化钠性质的特殊性
(1)在氧化钠中含有Na+和O2-,在过氧化钠中含有Na+和O,所以二者中阳离子和阴离子的个数比都是2∶1。
(2)过氧化钠和其他物质反应时不一定有氧气产生,如具有强还原性的SO2,能被Na2O2氧化成Na2SO4:SO2+Na2O2===Na2SO4。
(3)过氧化钠虽然能够和盐酸反应生成盐和水,但同时还有氧气产生,所以它不属于碱性氧化物。
1.经测定某固体混合物中,只含钠和氧两种元素,将其放入足量水中,可产生两种气体,则该混合物( )
A.一定没有钠单质
B.一定有氧化钠
C.含有两种或两种以上物质
D.只含有两种物质
解析: 固体物质只含钠和氧两种元素,与水反应产生两种气体,两种气体分别为H2和O2。固体物质中一定有钠和过氧化钠,可能有Na2O,也可能没有Na2O。
答案: C
有两个无标签的试剂瓶,分别装有Na2CO3和NaHCO3固体,有四位同学为鉴别它们采用以下不同方法,其中不可行的是( )
A.分别将它们配制成溶液,再加入澄清石灰水
B.分别将它们配制成溶液,再逐滴加入等浓度的稀盐酸
C.分别将它们配制成溶液,再加入CaCl2溶液
D.分别加热,再用石灰水检验是否有CO2产生
Na2CO3与NaHCO3性质比较
解析: A项中发生的反应分别为:Na2CO3+Ca(OH)2===CaCO3↓+2NaOH,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O,两者现象相同(产生白色沉淀);B项Na2CO3溶液中滴加盐酸,开始无现象,后来产生气体,而NaHCO3溶液中一滴入盐酸立即产生气体,现象不同;
答案: A
2.除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是( )
A.通入二氧化碳气体
B.加入氢氧化钡溶液
C.加入澄清石灰水
D.加入稀盐酸
解析: 除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成分。溶液中可用这样的方法:Na2CO3+CO2+H2O===2NaHCO3。
答案: A
热点实验 物质稳定性实验探究
[探究举例] “套管实验”是将一支较小的玻璃仪器装入另一玻璃仪器中,经组装来完成原来需要两只或更多普通玻璃仪器进行的实验。因其具有许多优点,近年被广泛开发并应用于化学实验中。请观察下列实验装置,分析实验原理,并回答下列问题:
(1)从点燃酒精灯开始,试管及烧杯A、B中能观察到的现象有____________________________。
(2)整个实验结束时,在操作上需要特别注意的问题是____________________________。
(3)通过该实验可以得出的结论是(结合化学方程式来说明)
____________________________。
解析:(1)气体受热膨胀,所以一开始加热,A、B烧杯中均有气泡逸出,加热一段时间后可看到小试管内有水珠,说明NaHCO3分解,同时烧杯B溶液变浑浊,而烧杯A中无明显变化。
(2)当实验结束时应先将导管从澄清石灰水中取出,防止倒吸。
(3)从图示可以看出NaHCO3受热分解了,而Na2CO3受热没有分解,说明Na2CO3比NaHCO3稳定。
1.北京奥运会开幕式向全世界兑现了“科技奥运”的承诺,其中焰火打出的五环标志如图所示。下列有关说法正确的是( )
A.焰火是碱金属等发生燃烧的现象
B.焰火是碱金属等发生焰色反应
C.焰火的火树银花的效果是金属单质在空气中燃烧产生的
D.某样品的焰色反应呈黄色,说明它只含钠元素,不含其他金属元素
解析: 北京奥运会开幕式上的焰火是碱金属等发生焰色反应形成的,它不属于化学变化。钠的焰色会掩盖钾的焰色,所以,某样品的焰色呈黄色,说明它一定含有钠元素,可能还含有钾元素等。
答案: B
2.钠在空气中燃烧的有关叙述正确的是( )
A.钠在空气中燃烧时火焰呈淡蓝色
B.钠在空气中燃烧时生成的是白色的氧化钠
C.钠在空气中燃烧时生成的是淡黄色的过氧化钠
D.钠在燃烧时生成的过氧化钠中氧元素的化合价为-2价
解析: 钠在空气中燃烧生成的是淡黄色的过氧化钠,由于钠的焰色反应呈黄色,所以燃烧时火焰呈黄色。
答案: C
3.关于Na2CO3和NaHCO3性质的说法不正确的是( )
A.热稳定性:NaHCO3
答案: C
4.下列物质必须隔绝空气保存的是( )
①Na ②Na2O ③Na2O2 ④NaOH ⑤Na2CO3 ⑥NaCl
A.①② B.②③④⑤
C.①②③④ D.①②③④⑤
解析: Na与空气中的水、O2反应,Na2O和Na2O2均与空气中的CO2、H2O反应,NaOH与空气中的CO2反应,都必须隔绝空气保存。
答案: C
5.下图所示各步变化,A为金属,B为淡黄色固体粉末,每一物质均含有A元素。
(1)写出下列物质的化学式:
B______,C______,E______,F________。
(2)写出下列各步反应的化学方程式。
C→E_______________________________________________________________;
可知,D、E分别为Na2O、NaCl、NaOH中的一种,由Na2O2的性质可知,C必为Na2CO3,则F为NaHCO3,由Na2CO3→E可知,E为NaOH或NaCl,由D→C知,E为NaOH时,D只能为Na2O;当E为NaCl时,D可以为Na2O或NaOH。
