3.2.2 铝的重要化合物(人教版必修1)
文档属性
| 名称 | 3.2.2 铝的重要化合物(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 12:09:17 | ||
图片预览











文档简介
(共59张PPT)
第2课时 铝的重要化合物
铝有很多种化合物,氧化铝就是其中的一种,氧化铝可以制成不同的物质,有的硬度很小,性质活泼,容易和酸、碱反应;有的硬度很大,性质非常稳定,同学们知道其中的奥秘吗?
1.了解铝的重要化合物的主要性质及应用。
2.了解铝的化合物相互转变的图象。
3.了解与Al(OH)3相关的简单计算。
1.氧化铝
(1)物理性质
铝的重要化合物
色态 溶解性 熔点 硬度
白色固体 难溶于水 很高 很大
(2)化学性质
Al2O3是_____氧化物,与强酸或强碱溶液都能 反应生成盐和水。
①与强酸反应的离子方程式: __________________________。
②与强碱反应的离子方程式:
__________________________ 。
两性
Al2O3+6H+===2Al3++3H2O
(3)用途
①冶炼金属___的原料
②良好的_____材料
2.氢氧化铝
(1)物理性质
_____于水的_________物质。
铝
耐火
不溶
白色胶状
(3)用途
①能凝聚水中的悬浮物并能_________,可用 来净水。
②利用其_____性,可用做胃酸中和剂。
吸附色素
弱碱
(2)十二水合硫酸铝钾
化学式:________________,俗名:____,无 色晶体,可溶于水,在天然水中生成________ 胶体,可用做净水剂。
KAl(SO4)2·12H2O
明矾
Al(OH)3
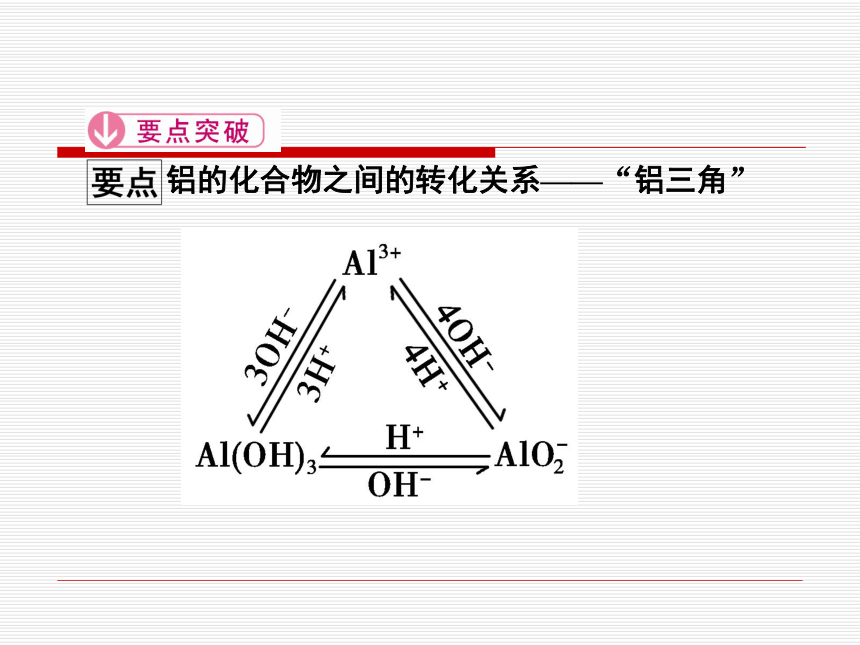
铝的化合物之间的转化关系——“铝三角”
2.Al(OH)3―→Al3+:Al(OH)3溶于强酸溶液:
Al(OH)3+3H+===Al3++3H2O
3.Al3+―→AlO:可溶性铝盐与过量的强碱反应:
Al3++4OH-(过量)===AlO+2H2O
4.AlO―→Al3+:偏铝酸盐溶液与足量的盐酸反应:
AlO+4H+===Al3++2H2O
答案: A
有关Al(OH)3沉淀的图象分析
[温馨提示] 向AlCl3溶液中加NaOH溶液和向NaAlO2溶液中加盐酸,计算生成a mol Al(OH)3沉淀时,有两种情况,即碱(酸)不足和碱(酸)过量,如图象中所示。计算时要注意讨论分析。
2.将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示。下面说法正确的是(多选)( )
A.A点的沉淀是Mg(OH)2、Al(OH)3
B.B点的沉淀是Mg(OH)2、Al(OH)3
C.A点的沉淀是Al(OH)3
D.B点的沉淀是Mg(OH)2
答案: AD
A、B、C、D、E五种化合物,均含有常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
铝的化合物之间的转化关系
(1)写出化学式:A______,C______,D______,E______。
(2)写出下列反应的离子方程式。
A→B________________________________________________________________________,
F→E________________________________________________________________________。
解析: 题目应以B物质作为突破口:
[思考感悟] 既能和盐酸反应,又能和NaOH溶液反应的物质
(1)某此单质:Al
(2)两性物质:Al(OH)3、Al2O3
(3)弱酸的酸式盐:NaHCO3、NaHSO3
(4)弱酸的铵盐:(NH4)2CO3、(NH4)2SO3
③C+NaOH(适量)―→B+NaCl
④E+H2O―→NaOH+F
⑤C+D+H2O―→B
则A、B、C、D的化学式分别是:A________,B________,C________,D________。
写出4 mol C和6 mol E在水溶液中发生反应的化学方程式为:__________________________________________________________________。
解析: 本题应从反应④开始,由气体F在标况下的相对密度知MF=29×1.103=32,故F为O2。由④的反应知E中必含有Na,且能与H2O反应放出O2,故E为Na2O2;由反应③可知C中一定含有氯元素又知C中含铝元素,故C为AlCl3;在铝的常见化合物中,受热分解成一种化合物和水的物质为Al(OH)3,故B为Al(OH)3,则A为Al2O3。由①可知D为NaAlO2。
答案: Al2O3 Al(OH)3 AlCl3 NaAlO2 4AlCl3+6Na2O2+6H2O===4Al(OH)3↓+12NaCl+3O2↑
如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。
铝的化合物转化的图象分析
溶液 加入的物质 字母代号
①饱和石灰水 通过量CO2
②AlCl3溶液 通过量NH3
③MgCl2、AlCl3混合溶液 逐滴加NaOH溶液至过量
④AlCl3溶液 逐滴加NaOH溶液至过量
⑤含少量HCl的AlCl3溶液 逐滴加NaOH溶液至过量
⑥FeCl3溶液 逐滴加NaOH溶液至过量
③发生如下反应:MgCl2+2NaOH===Mg(OH)2↓+2NaCl,AlCl3+3NaOH===Al(OH)3↓+3NaCl,故先生成沉淀,当NaOH过量时又发生如下反应而部分溶解:Al(OH)3+NaOH===NaAlO2+2H2O,因Mg(OH)2与碱不反应故沉淀不能完全消失,因此其对应图象为A。④发生如下反应:AlCl3+3NaOH===Al(OH)3↓+3NaCl,Al(OH)3+NaOH===NaAlO2+2H2O。其反应现象为先生成白色沉淀,再逐渐溶解且前后消耗NaOH的物质的量之比为3∶1,故其对应图象为E。
⑤反应如下:HCl+NaOH===NaCl+H2O,AlCl3+3NaOH===3NaCl+Al(OH)3↓,Al(OH)3+NaOH===NaAlO2+2H2O。此时优先发生的是酸碱中和反应,故开始时应无沉淀产生,后续反应与上述④中相同,故其图象应为F。⑥FeCl3溶液中逐滴加NaOH溶液至过量,只发生如下反应生成红褐色沉淀且不消失:FeCl3+3NaOH===Fe(OH)3↓+3NaCl,其对应图象应为C。
答案: B C A E F C
2.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示加入氢氧化钠的量(x)与生成沉淀的物质的量(y)的关系示意图中,正确的是( )
解析: 在Al(NO3)3、Mg(NO3)2的混合溶液中,逐滴加入稀NaOH溶液后,发生的反应有:Mg2++2OH-===Mg(OH)2↓;Al3++3OH-===Al(OH)3↓,Al(OH)3+NaOH===NaAlO2+2H2O,因此正确答案为C。
答案: C
热点实验 氧化铝性质的实验探究
[探究举例] 某校化学兴趣小组的同学经查阅资料得知:铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,但奇怪的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组的同学对铝表面的氧化膜进行了探究,其过程如下,请完成下列填空。
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软,轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的熔点________(填“高于”或“低于”)内层铝的熔点,并将其裹住,所以不易发生滴落现象。
(2)取两块未用砂纸打磨过的铝片,一块浸入CuCl2稀溶液中后,很快析出较多的红色固体;另一块浸入CuSO4稀溶液中,无明显现象。试推测产生不同现象的原因:__________________________________________________________________。
(3)用砂纸打磨一铝片,使其表面变粗糙,再将其放入CuSO4稀溶液中,2~3 min后有少量红色固体附着在其表面。试写出产生红色固体的离子方程式:____________________________。
(4)取两块铝片,用砂纸磨去其氧化膜,分别把它们浸入浓硝酸中,无显著变化。铝片浸入浓硝酸中无显著变化的原因是
____________________________。
(5)把两块未用砂纸打磨过的铝片都浸入氢氧化钠溶液中,片刻后其表面产生无色气体。试写出铝的氧化膜与氢氧化钠溶液反应的离子方程式:___________________________。
解析: 本题是多方面能力的考查,通过阅读分析,得出结论,
通过阅读CuCl2与CuSO4溶液的不同,只能是Cl-的作用,使铝片表面的氧化膜被破坏。其余问题不难解答。
1.物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①Al ②Na ③Al2O3 ④Al(OH)3
A.③④ B.全部
C.②③④ D.①③④
解析:上面4种物质均既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应,其中钠与氢氧化钠溶液的反应是与溶剂水的反应。
答案:B
2.下列关于Al(OH)3的性质叙述错误的是( )
A.Al(OH)3是两性氢氧化物
B.Al(OH)3是难溶于水的白色胶状物质
C.Al(OH)3能凝聚水中的悬浮物,也能吸附色素
D.Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸
解析: Al(OH)3胶体由于结构疏松,表面积大,能吸附色素及凝聚水中悬浮物,可用于自来水净化。Al(OH)3只能溶于强碱、强酸,不能溶于弱碱(氨水)、弱酸(碳酸)。
答案: D
答案: D
4.向用HCl酸化过的AlCl3溶液中逐滴滴入NaOH溶液,图中能正确表示这个反应的是
( )
解析: 向AlCl3溶液中逐滴滴入NaOH溶液,先生成白色沉淀,再加入NaOH溶液,沉淀逐渐溶解,最后完全消失,生成1 mol Al(OH)3需3 mol时NaOH,溶解1 mol Al(OH)3需1 mol NaOH。NaOH的用量应是3∶1,A、B错误,用HCl酸化过的AlCl3溶液中含有酸,加入NaOH溶液先中和溶液中的酸,然后才生成Al(OH)3沉淀,故C也是错误的。
答案: D
5.在含有Ag+、Al3+、Ca2+、Mg2+四种离子的溶液中,逐一加入有关物质,填写下列空白:
(1)往混合溶液中加入盐酸,生成________沉淀,反应的离子方程式是:___________________________________________________________________。
(2)把(1)中所得的物质过滤,往滤液中加入氨水,使溶液呈碱性,又出现________色沉淀,是______________(写名称),反应的离子方程式是:__________________________。
(3)把(2)中所得的物质过滤,往滤液中加入碳酸钠溶液,又出现________色沉淀,反应的离子方程式是:___________________________________________________________________。
(4)向(2)中所得的沉淀中加入过量的NaOH溶液,所观察到的现象是______________,反应的离子方程式是:______________________________,不溶的物质是________。
解析: 弄清楚Mg2+、Al3+共存的环境与条件是解题的关键。正确的思路是Mg2+、Al3+都不能在碱性条件下共存,且Al(OH)3只溶于强碱和强酸,Mg(OH)2只溶于酸。
第2课时 铝的重要化合物
铝有很多种化合物,氧化铝就是其中的一种,氧化铝可以制成不同的物质,有的硬度很小,性质活泼,容易和酸、碱反应;有的硬度很大,性质非常稳定,同学们知道其中的奥秘吗?
1.了解铝的重要化合物的主要性质及应用。
2.了解铝的化合物相互转变的图象。
3.了解与Al(OH)3相关的简单计算。
1.氧化铝
(1)物理性质
铝的重要化合物
色态 溶解性 熔点 硬度
白色固体 难溶于水 很高 很大
(2)化学性质
Al2O3是_____氧化物,与强酸或强碱溶液都能 反应生成盐和水。
①与强酸反应的离子方程式: __________________________。
②与强碱反应的离子方程式:
__________________________ 。
两性
Al2O3+6H+===2Al3++3H2O
(3)用途
①冶炼金属___的原料
②良好的_____材料
2.氢氧化铝
(1)物理性质
_____于水的_________物质。
铝
耐火
不溶
白色胶状
(3)用途
①能凝聚水中的悬浮物并能_________,可用 来净水。
②利用其_____性,可用做胃酸中和剂。
吸附色素
弱碱
(2)十二水合硫酸铝钾
化学式:________________,俗名:____,无 色晶体,可溶于水,在天然水中生成________ 胶体,可用做净水剂。
KAl(SO4)2·12H2O
明矾
Al(OH)3
铝的化合物之间的转化关系——“铝三角”
2.Al(OH)3―→Al3+:Al(OH)3溶于强酸溶液:
Al(OH)3+3H+===Al3++3H2O
3.Al3+―→AlO:可溶性铝盐与过量的强碱反应:
Al3++4OH-(过量)===AlO+2H2O
4.AlO―→Al3+:偏铝酸盐溶液与足量的盐酸反应:
AlO+4H+===Al3++2H2O
答案: A
有关Al(OH)3沉淀的图象分析
[温馨提示] 向AlCl3溶液中加NaOH溶液和向NaAlO2溶液中加盐酸,计算生成a mol Al(OH)3沉淀时,有两种情况,即碱(酸)不足和碱(酸)过量,如图象中所示。计算时要注意讨论分析。
2.将一定量的镁铝合金放入一定量的盐酸中,合金恰好全部溶解,向所得溶液中滴加一定浓度的NaOH溶液,加入的NaOH溶液的体积(V)与沉淀质量(m)的关系如图所示。下面说法正确的是(多选)( )
A.A点的沉淀是Mg(OH)2、Al(OH)3
B.B点的沉淀是Mg(OH)2、Al(OH)3
C.A点的沉淀是Al(OH)3
D.B点的沉淀是Mg(OH)2
答案: AD
A、B、C、D、E五种化合物,均含有常见元素,它们的转化关系如图所示,其中A为澄清溶液,C为难溶的白色固体,E则易溶于水,若取A溶液灼烧,焰色反应为浅紫色(透过蓝色钴玻璃)。
铝的化合物之间的转化关系
(1)写出化学式:A______,C______,D______,E______。
(2)写出下列反应的离子方程式。
A→B________________________________________________________________________,
F→E________________________________________________________________________。
解析: 题目应以B物质作为突破口:
[思考感悟] 既能和盐酸反应,又能和NaOH溶液反应的物质
(1)某此单质:Al
(2)两性物质:Al(OH)3、Al2O3
(3)弱酸的酸式盐:NaHCO3、NaHSO3
(4)弱酸的铵盐:(NH4)2CO3、(NH4)2SO3
③C+NaOH(适量)―→B+NaCl
④E+H2O―→NaOH+F
⑤C+D+H2O―→B
则A、B、C、D的化学式分别是:A________,B________,C________,D________。
写出4 mol C和6 mol E在水溶液中发生反应的化学方程式为:__________________________________________________________________。
解析: 本题应从反应④开始,由气体F在标况下的相对密度知MF=29×1.103=32,故F为O2。由④的反应知E中必含有Na,且能与H2O反应放出O2,故E为Na2O2;由反应③可知C中一定含有氯元素又知C中含铝元素,故C为AlCl3;在铝的常见化合物中,受热分解成一种化合物和水的物质为Al(OH)3,故B为Al(OH)3,则A为Al2O3。由①可知D为NaAlO2。
答案: Al2O3 Al(OH)3 AlCl3 NaAlO2 4AlCl3+6Na2O2+6H2O===4Al(OH)3↓+12NaCl+3O2↑
如下六个图中,横坐标为某溶液中加入某物质的物质的量,纵坐标为生成沉淀的物质的量,将图中的字母代号填入下表。
铝的化合物转化的图象分析
溶液 加入的物质 字母代号
①饱和石灰水 通过量CO2
②AlCl3溶液 通过量NH3
③MgCl2、AlCl3混合溶液 逐滴加NaOH溶液至过量
④AlCl3溶液 逐滴加NaOH溶液至过量
⑤含少量HCl的AlCl3溶液 逐滴加NaOH溶液至过量
⑥FeCl3溶液 逐滴加NaOH溶液至过量
③发生如下反应:MgCl2+2NaOH===Mg(OH)2↓+2NaCl,AlCl3+3NaOH===Al(OH)3↓+3NaCl,故先生成沉淀,当NaOH过量时又发生如下反应而部分溶解:Al(OH)3+NaOH===NaAlO2+2H2O,因Mg(OH)2与碱不反应故沉淀不能完全消失,因此其对应图象为A。④发生如下反应:AlCl3+3NaOH===Al(OH)3↓+3NaCl,Al(OH)3+NaOH===NaAlO2+2H2O。其反应现象为先生成白色沉淀,再逐渐溶解且前后消耗NaOH的物质的量之比为3∶1,故其对应图象为E。
⑤反应如下:HCl+NaOH===NaCl+H2O,AlCl3+3NaOH===3NaCl+Al(OH)3↓,Al(OH)3+NaOH===NaAlO2+2H2O。此时优先发生的是酸碱中和反应,故开始时应无沉淀产生,后续反应与上述④中相同,故其图象应为F。⑥FeCl3溶液中逐滴加NaOH溶液至过量,只发生如下反应生成红褐色沉淀且不消失:FeCl3+3NaOH===Fe(OH)3↓+3NaCl,其对应图象应为C。
答案: B C A E F C
2.在硝酸铝和硝酸镁的混合溶液中,逐滴加入稀氢氧化钠溶液,直至过量。下列表示加入氢氧化钠的量(x)与生成沉淀的物质的量(y)的关系示意图中,正确的是( )
解析: 在Al(NO3)3、Mg(NO3)2的混合溶液中,逐滴加入稀NaOH溶液后,发生的反应有:Mg2++2OH-===Mg(OH)2↓;Al3++3OH-===Al(OH)3↓,Al(OH)3+NaOH===NaAlO2+2H2O,因此正确答案为C。
答案: C
热点实验 氧化铝性质的实验探究
[探究举例] 某校化学兴趣小组的同学经查阅资料得知:铝表面致密的氧化膜能使铝与其周围的介质(空气、水等)隔绝,但奇怪的是铝制容器仍不能用来盛放和腌制咸菜。为此该小组的同学对铝表面的氧化膜进行了探究,其过程如下,请完成下列填空。
(1)用坩埚钳夹住一块擦去氧化膜的铝片,放在酒精灯火焰上灼烧,铝片表面接触火焰的部分变暗,片刻后变软,轻轻摇动,会左右摇晃,却不像蜡烛那样滴落。这是因为铝表面氧化膜的熔点________(填“高于”或“低于”)内层铝的熔点,并将其裹住,所以不易发生滴落现象。
(2)取两块未用砂纸打磨过的铝片,一块浸入CuCl2稀溶液中后,很快析出较多的红色固体;另一块浸入CuSO4稀溶液中,无明显现象。试推测产生不同现象的原因:__________________________________________________________________。
(3)用砂纸打磨一铝片,使其表面变粗糙,再将其放入CuSO4稀溶液中,2~3 min后有少量红色固体附着在其表面。试写出产生红色固体的离子方程式:____________________________。
(4)取两块铝片,用砂纸磨去其氧化膜,分别把它们浸入浓硝酸中,无显著变化。铝片浸入浓硝酸中无显著变化的原因是
____________________________。
(5)把两块未用砂纸打磨过的铝片都浸入氢氧化钠溶液中,片刻后其表面产生无色气体。试写出铝的氧化膜与氢氧化钠溶液反应的离子方程式:___________________________。
解析: 本题是多方面能力的考查,通过阅读分析,得出结论,
通过阅读CuCl2与CuSO4溶液的不同,只能是Cl-的作用,使铝片表面的氧化膜被破坏。其余问题不难解答。
1.物质中既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应的是( )
①Al ②Na ③Al2O3 ④Al(OH)3
A.③④ B.全部
C.②③④ D.①③④
解析:上面4种物质均既能跟稀H2SO4反应,又能跟氢氧化钠溶液反应,其中钠与氢氧化钠溶液的反应是与溶剂水的反应。
答案:B
2.下列关于Al(OH)3的性质叙述错误的是( )
A.Al(OH)3是两性氢氧化物
B.Al(OH)3是难溶于水的白色胶状物质
C.Al(OH)3能凝聚水中的悬浮物,也能吸附色素
D.Al(OH)3既溶于NaOH溶液、氨水,又能溶于盐酸
解析: Al(OH)3胶体由于结构疏松,表面积大,能吸附色素及凝聚水中悬浮物,可用于自来水净化。Al(OH)3只能溶于强碱、强酸,不能溶于弱碱(氨水)、弱酸(碳酸)。
答案: D
答案: D
4.向用HCl酸化过的AlCl3溶液中逐滴滴入NaOH溶液,图中能正确表示这个反应的是
( )
解析: 向AlCl3溶液中逐滴滴入NaOH溶液,先生成白色沉淀,再加入NaOH溶液,沉淀逐渐溶解,最后完全消失,生成1 mol Al(OH)3需3 mol时NaOH,溶解1 mol Al(OH)3需1 mol NaOH。NaOH的用量应是3∶1,A、B错误,用HCl酸化过的AlCl3溶液中含有酸,加入NaOH溶液先中和溶液中的酸,然后才生成Al(OH)3沉淀,故C也是错误的。
答案: D
5.在含有Ag+、Al3+、Ca2+、Mg2+四种离子的溶液中,逐一加入有关物质,填写下列空白:
(1)往混合溶液中加入盐酸,生成________沉淀,反应的离子方程式是:___________________________________________________________________。
(2)把(1)中所得的物质过滤,往滤液中加入氨水,使溶液呈碱性,又出现________色沉淀,是______________(写名称),反应的离子方程式是:__________________________。
(3)把(2)中所得的物质过滤,往滤液中加入碳酸钠溶液,又出现________色沉淀,反应的离子方程式是:___________________________________________________________________。
(4)向(2)中所得的沉淀中加入过量的NaOH溶液,所观察到的现象是______________,反应的离子方程式是:______________________________,不溶的物质是________。
解析: 弄清楚Mg2+、Al3+共存的环境与条件是解题的关键。正确的思路是Mg2+、Al3+都不能在碱性条件下共存,且Al(OH)3只溶于强碱和强酸,Mg(OH)2只溶于酸。
