3.2.3 铁的重要化合物(人教版必修1)
文档属性
| 名称 | 3.2.3 铁的重要化合物(人教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 752.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 00:00:00 | ||
图片预览










文档简介
(共57张PPT)
第3课时 铁的重要化合物
铁的单质与其他物质反应时,既可以失去两个电子,也可以失去三个电子,也就是说在化合物中铁有+2价和+3价两种化合价。你知道吗?
1.了解Fe、Cu的重要化合物的主要性质及应用。
2.掌握Fe2+、Fe3+的检验方法。
3.利用Fe及其化合物的性质推断物质及鉴别物质。
1.铁的存在
铁在地壳中的含量仅次于__________,主要 以____和____价化合物的形式存在。
铁的重要化合物
氧、硅、铝
+2
+3
2.铁的氧化物
(1)物理性质
名称 氧化亚铁 氧化铁 四氧化三铁
化学式 ____ Fe2O3 _______
俗名 铁红 磁性氧化铁
铁的化合价 _____ ____ __________
颜色、状态 _________ __________ 黑色晶体
溶解性 均不溶于水
Fe3O4
+2
+3
+2、+3
FeO
黑色粉末
红棕色粉末
(2)化学性质
①FeO不稳定,在空气中受热易被氧化成 ______。
②FeO和Fe2O3属于____氧化物,与盐酸反应 的化学方程式分别为:FeO+2HCl===FeCl2 +H2O,Fe2O3+6HCl===2FeCl3+3H2O。
(3)用途
Fe2O3常用做红色油漆和涂料,______(主要成 分是______)是炼铁原料。
Fe3O4
碱性
赤铁矿
Fe2O3
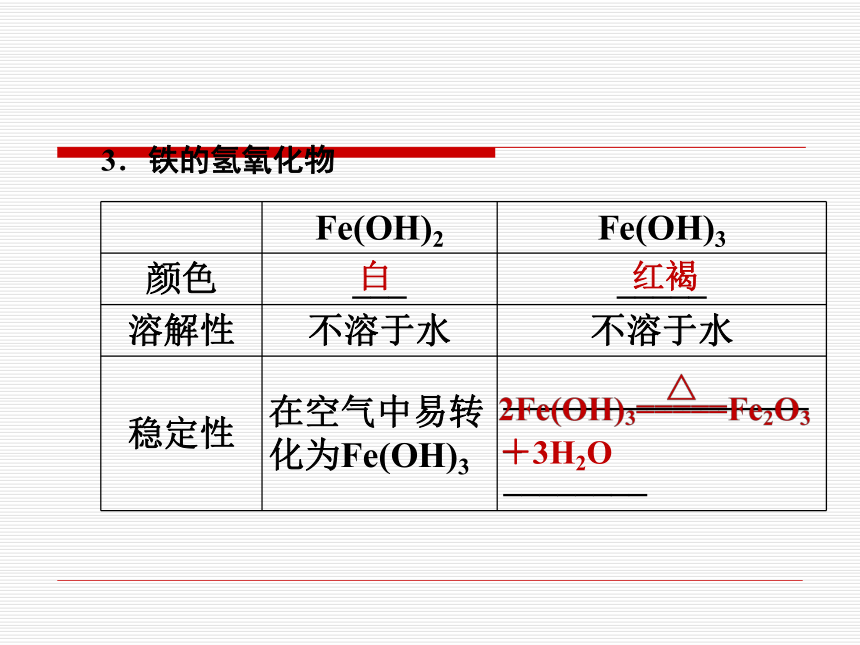
3.铁的氢氧化物
Fe(OH)2 Fe(OH)3
颜色 ___ _____
溶解性 不溶于水 不溶于水
稳定性 在空气中易转化为Fe(OH)3 __________________ ________
白
红褐
+3H2O
与盐酸反应(离子方程式) Fe(OH)2+2H+===Fe2++2H2O ______________ ______________
制备 Fe2++2OH-===Fe(OH)2↓ ______________
______________
Fe(OH)3+3H+ ===Fe3++3H2O
Fe3++3OH-
===Fe(OH)3↓
转
化
化学
方程式 4Fe(OH)2+O2+2H2O=== 4Fe(OH)3
现象 白色沉淀迅速变为______, 最终变为红褐色
灰绿色
4.铁盐和亚铁盐
(1)Fe3+的检验
①试剂:___________
②现象:含Fe3+的溶液_________
(2)Fe3+和Fe2+的转化
如FeCl3溶液中加入铁粉,反应的离子方程式为:__________________,
KSCN溶液
变成红色
2Fe3++Fe===3Fe2+
如向FeCl2溶液中滴加氯水,反应的离子方程式为:___________________________
(3)铁盐的净水作用
向混有少量泥沙的浑浊水中加入Fe2(SO4)3溶液后,会_______。
2Fe2++Cl2===2Fe3++2Cl-
变澄清
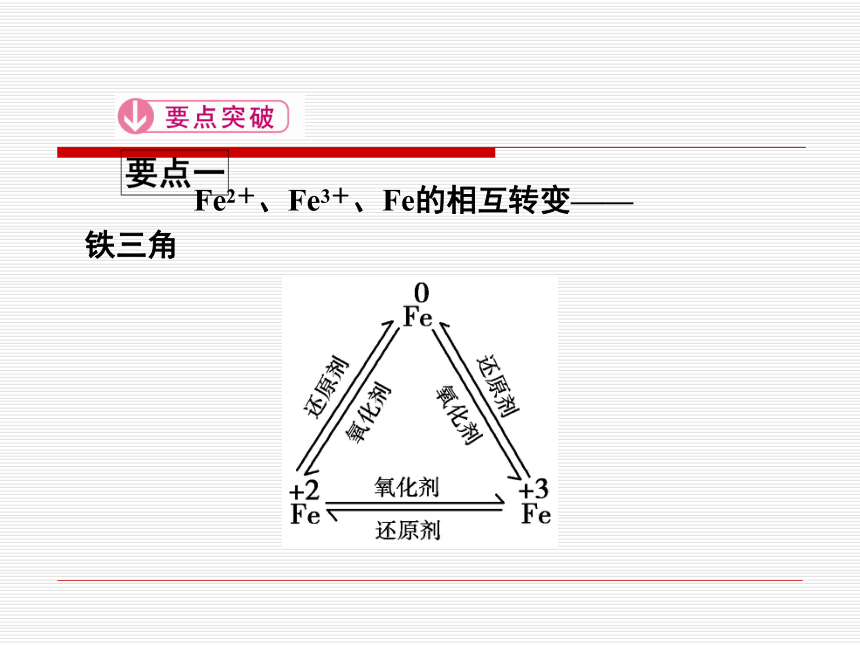
Fe2+、Fe3+、Fe的相互转变——
铁三角
2.Fe2+既具有氧化性又具有还原性
(1)与氧化剂反应
当Fe2+遇到强氧化剂(如Cl2、HNO3、KMnO4)时,被氧化为Fe3+,如2Fe2++Cl2===2Fe3++2Cl-
[温馨提示] (1)不同价态的铁及铁的化合物在相互转化时,注意所用氧化剂和还原剂的强弱不同。
(2)亚铁盐保存时,为了防止被氧化为铁盐,通常在溶液中加少量还原铁粉或铁钉。
1.(2010·洛阳高一检测)某化合物的溶液中可能含有下列离子,当加入NaOH溶液时,有沉淀生成;另取该化合物的溶液,并加入铁粉,溶液的质量增加,该溶液中一定含有( )
A.Cu2+ B.Fe3+
C.Al3+ D.Mg2+
解析:加入铁粉溶液质量增加,若为Cu2+,Cu2++Fe===Fe2++Cu,则溶液质量减少,若为Fe3+,反应为Fe+2Fe3+===3Fe2+,溶液质量增加,若为Al3+或Mg2+,溶液质量不变。
答案:B
Fe3+、Fe2+的检验
2.能检验某溶液中有Fe2+无Fe3+的实验事实是( )
A.向溶液中加入2滴KSCN溶液立即变红色
B.向溶液中加入少许氯水后再加2滴KSCN溶液立即变红色
C.向溶液中加入2滴KSCN溶液无明显变化,再加入少许氯水立即变红色
D.向溶液中加入少许NaOH溶液立即产生红褐色沉淀
解析: A选项证实溶液中一定含Fe3+,不一定含Fe2+。B选项因先加氯水,后加KSCN溶液,变红色,无法证明原溶液含Fe2+还是Fe3+。C选项先加KSCN溶液无变化,证明无Fe3+,加氯水后,由于2Fe2++Cl2===2Fe3++2Cl-,生成的Fe3+与KSCN反应生成红色物质,证明溶液中含有Fe2+。D选项证明溶液中含有Fe3+。
答案: C
1.铜化学性质_______,使用铜器皿比较安全。 2.铜属于_______,铜盐溶液都____,因为Cu2+ 与蛋白质作用,使蛋白质_____而失去生理活性。
3.铜绿的主要成分是_____________。
铜的化合物
不活泼
重金属
有毒
变性
Cu2(OH)2CO3
铜及其化合物的相互关系
1.
2.物质颜色:Cu、Cu2O为红色;Cu2S、CuS、CuO为黑色;CuSO4为白色;CuSO4溶液、CuSO4·5H2O、Cu(OH)2为蓝色;Cu2(OH)2CO3为绿色;CuCl2为棕色,水溶液为蓝绿色。
3.完成要点三第1部分相互转化的化学反应方程式,是氧化还原反应的请注明。
①_________________________________;
③_________________________________;
⑤_________________________________;
⑦_________________________________;
⑨_________________________________;
_________________________________;
_________________________________。
按下图要求写出下列三个反应的化 学方程式,属于离子反应的写出离子方程式。
①B—C+D;②E—F;③F—D
不同价态铁元素的转化
解析: 此题从反应转化过程来看,唯一能作为解题突破口的是红褐色固体F。结合题意不妨设F即为Fe(OH)3固体。由题可知,A在不同条件下反应能得到C和D,而A经反应得到的B在同一反应中能产生C和D,C应为低价态,C经反应得到E,而E经O2氧化可得F[Fe(OH)3]。由此可判断E为Fe(OH)2,则C为Fe2+,所以D为Fe3+,而B则应是Fe3O4,A是Fe。把推断的结论进行验证,符合题意。
答案: ①Fe3O4+8H+===Fe2++2Fe3++4H2O
②4Fe(OH)2+O2+2H2O===4Fe(OH)3
③Fe(OH)3+3H+===Fe3++3H2O
[思考感悟] 铁元素及其化合物的推断题的解题关键:
一是寻找特征反应及特征现象,二是正确运用“铁三角”的转化关系,三是注意与其他金属及其化合物知识的综合。化学框图题综合性强,难度大,解题时常由于知识的综合性不够,找不到“突破口”而无法下手。
1.将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。试判断下列情况下,溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有的离子是________;铜单质________(填“一定”或“可能”)存在。
(2)若氯化铜有剩余,则容器中还可能有的离子为________;铜单质________(填“一定”或“可能”)存在。
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有的单质是________,Fe2+________(填“一定”或“可能”)存在。
答案: (1)Fe3+、Cu2+ 一定 (2)Fe3+ 可能 (3)Fe、Cu 一定
解析: 本题考查物质的共存问题,依据金属活动性:Fe>Cu,离子氧化性:Fe3+>Cu2+。
要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳顺序是( )
①加足量氯水 ②加足量KMnO4溶液 ③加少量KSCN溶液
A.①② B.③②
C.③① D.①②③
Fe2+和Fe3+的检验
解析: 本题检验方法的关键是Fe3+遇SCN-反应显红色,而Fe2+遇SCN-不显红色,加入KSCN溶液不显红色证明无Fe3+,再加氯水,如有Fe2+则可被氧化为Fe3+遇SCN-反应显红色。KMnO4溶液也能氧化Fe2+,但因其本身呈紫色,使Fe3+与SCN-反应显红色不易观察。
答案: C
[思考感悟] 解答本题要注意以下两点:
(1)首先检验溶液中是否有Fe3+,可用KSCN溶液。
(2)加入氧化剂,验证溶液中含有Fe2+,但要注意加入的氧化剂不能对观察现象产生干扰。
2.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁含有OH-
D.苹果汁含有Fe3+
解析: 苹果汁中的淡绿色的Fe2+被空气中的氧气氧化成棕黄色的Fe3+。
答案: A
热点实验 金属氧化物测定的实验探究
[探究举例] 氧化铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
查阅资料 Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设 假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物。
设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是___________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法合理吗?___________________________。
简述你的理由:(不需写出反应的化学方程式_________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是______________________,写出发生反应的离子方程式:
___________________________________________________________________。
延伸探究 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量 不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
1.(2011·兰州高一检测)下列化合物中,不能由单质直接化合而得到的是( )
A.FeCl2 B.FeS
C.Fe3O4 D.FeCl3
解析: 铁单质在点燃条件下可以和Cl2反应生成FeCl3,和O2反应生成Fe3O4,在加热条件下可以和S反应生成FeS。
答案: A
2.世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型炼钢厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A.FeO粉尘 B.P2O5粉尘
C.Fe2O3粉尘 D.SiO2粉尘
解析: Fe2O3呈棕红色,故炼钢厂产生的棕红色烟雾是Fe2O3所致。
答案: C
3.(2010·广州高一检测)下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中含有Fe2+,不含有Mg2+
解析: A项说明含Fe3+,但不能说明是否含Fe2+;B项说明通入Cl2后溶液中含有Fe3+,不能说明原溶液中是否含有Fe2+;因为Mg(OH)2为白色沉淀,Fe(OH)2转化为Fe(OH)3时的颜色变化会掩盖其他白色沉淀的现象,所以当溶液中含有Mg2+时,会出现同样的上述现象,故D项不能说明溶液中是否含Mg2+,C选项正确。
答案: C
4.下列离子方程式正确的是( )
A.铁跟FeCl3溶液反应:Fe+Fe3+===2Fe2+
B.Fe跟稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C.FeCl2溶液跟Cl2反应:Fe2++Cl2===Fe3++2Cl-
D.Fe(OH)3跟盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
解析: A中电荷不守恒,应为:Fe+2Fe3+===3Fe2+;B中违反反应事实,应为:Fe+ 2H+===Fe2++H2↑;C中得失电子、电荷均不守恒,应为:2Fe2++Cl2===2Fe3++2Cl-。
答案: D
5.电子工业常用30%的FeCl3溶液腐蚀镀有铜箔的绝缘板,制印刷电路板。
(1)发生反应的离子方程式为________________________________________________________________________。
(2)为了从废液中回收铜,并重新制得纯净的FeCl3溶液,拟采用下列步骤,请在空格及括号内填入适当的分子式(化学式),以达预期目的。
解析: (1)用FeCl3溶液制印刷电路板发生的反应为:
2Fe3++Cu===2Fe2++Cu2+。
(2)回收铜,就需把Cu置换出来,同时要制得纯净的FeCl3,则只能用Fe还原,过量的Fe用稀盐酸溶液,所得FeCl2溶液通入Cl2即可得FeCl3。
答案: (1)2Fe3++Cu===2Fe2++Cu2+
(2)
第3课时 铁的重要化合物
铁的单质与其他物质反应时,既可以失去两个电子,也可以失去三个电子,也就是说在化合物中铁有+2价和+3价两种化合价。你知道吗?
1.了解Fe、Cu的重要化合物的主要性质及应用。
2.掌握Fe2+、Fe3+的检验方法。
3.利用Fe及其化合物的性质推断物质及鉴别物质。
1.铁的存在
铁在地壳中的含量仅次于__________,主要 以____和____价化合物的形式存在。
铁的重要化合物
氧、硅、铝
+2
+3
2.铁的氧化物
(1)物理性质
名称 氧化亚铁 氧化铁 四氧化三铁
化学式 ____ Fe2O3 _______
俗名 铁红 磁性氧化铁
铁的化合价 _____ ____ __________
颜色、状态 _________ __________ 黑色晶体
溶解性 均不溶于水
Fe3O4
+2
+3
+2、+3
FeO
黑色粉末
红棕色粉末
(2)化学性质
①FeO不稳定,在空气中受热易被氧化成 ______。
②FeO和Fe2O3属于____氧化物,与盐酸反应 的化学方程式分别为:FeO+2HCl===FeCl2 +H2O,Fe2O3+6HCl===2FeCl3+3H2O。
(3)用途
Fe2O3常用做红色油漆和涂料,______(主要成 分是______)是炼铁原料。
Fe3O4
碱性
赤铁矿
Fe2O3
3.铁的氢氧化物
Fe(OH)2 Fe(OH)3
颜色 ___ _____
溶解性 不溶于水 不溶于水
稳定性 在空气中易转化为Fe(OH)3 __________________ ________
白
红褐
+3H2O
与盐酸反应(离子方程式) Fe(OH)2+2H+===Fe2++2H2O ______________ ______________
制备 Fe2++2OH-===Fe(OH)2↓ ______________
______________
Fe(OH)3+3H+ ===Fe3++3H2O
Fe3++3OH-
===Fe(OH)3↓
转
化
化学
方程式 4Fe(OH)2+O2+2H2O=== 4Fe(OH)3
现象 白色沉淀迅速变为______, 最终变为红褐色
灰绿色
4.铁盐和亚铁盐
(1)Fe3+的检验
①试剂:___________
②现象:含Fe3+的溶液_________
(2)Fe3+和Fe2+的转化
如FeCl3溶液中加入铁粉,反应的离子方程式为:__________________,
KSCN溶液
变成红色
2Fe3++Fe===3Fe2+
如向FeCl2溶液中滴加氯水,反应的离子方程式为:___________________________
(3)铁盐的净水作用
向混有少量泥沙的浑浊水中加入Fe2(SO4)3溶液后,会_______。
2Fe2++Cl2===2Fe3++2Cl-
变澄清
Fe2+、Fe3+、Fe的相互转变——
铁三角
2.Fe2+既具有氧化性又具有还原性
(1)与氧化剂反应
当Fe2+遇到强氧化剂(如Cl2、HNO3、KMnO4)时,被氧化为Fe3+,如2Fe2++Cl2===2Fe3++2Cl-
[温馨提示] (1)不同价态的铁及铁的化合物在相互转化时,注意所用氧化剂和还原剂的强弱不同。
(2)亚铁盐保存时,为了防止被氧化为铁盐,通常在溶液中加少量还原铁粉或铁钉。
1.(2010·洛阳高一检测)某化合物的溶液中可能含有下列离子,当加入NaOH溶液时,有沉淀生成;另取该化合物的溶液,并加入铁粉,溶液的质量增加,该溶液中一定含有( )
A.Cu2+ B.Fe3+
C.Al3+ D.Mg2+
解析:加入铁粉溶液质量增加,若为Cu2+,Cu2++Fe===Fe2++Cu,则溶液质量减少,若为Fe3+,反应为Fe+2Fe3+===3Fe2+,溶液质量增加,若为Al3+或Mg2+,溶液质量不变。
答案:B
Fe3+、Fe2+的检验
2.能检验某溶液中有Fe2+无Fe3+的实验事实是( )
A.向溶液中加入2滴KSCN溶液立即变红色
B.向溶液中加入少许氯水后再加2滴KSCN溶液立即变红色
C.向溶液中加入2滴KSCN溶液无明显变化,再加入少许氯水立即变红色
D.向溶液中加入少许NaOH溶液立即产生红褐色沉淀
解析: A选项证实溶液中一定含Fe3+,不一定含Fe2+。B选项因先加氯水,后加KSCN溶液,变红色,无法证明原溶液含Fe2+还是Fe3+。C选项先加KSCN溶液无变化,证明无Fe3+,加氯水后,由于2Fe2++Cl2===2Fe3++2Cl-,生成的Fe3+与KSCN反应生成红色物质,证明溶液中含有Fe2+。D选项证明溶液中含有Fe3+。
答案: C
1.铜化学性质_______,使用铜器皿比较安全。 2.铜属于_______,铜盐溶液都____,因为Cu2+ 与蛋白质作用,使蛋白质_____而失去生理活性。
3.铜绿的主要成分是_____________。
铜的化合物
不活泼
重金属
有毒
变性
Cu2(OH)2CO3
铜及其化合物的相互关系
1.
2.物质颜色:Cu、Cu2O为红色;Cu2S、CuS、CuO为黑色;CuSO4为白色;CuSO4溶液、CuSO4·5H2O、Cu(OH)2为蓝色;Cu2(OH)2CO3为绿色;CuCl2为棕色,水溶液为蓝绿色。
3.完成要点三第1部分相互转化的化学反应方程式,是氧化还原反应的请注明。
①_________________________________;
③_________________________________;
⑤_________________________________;
⑦_________________________________;
⑨_________________________________;
_________________________________;
_________________________________。
按下图要求写出下列三个反应的化 学方程式,属于离子反应的写出离子方程式。
①B—C+D;②E—F;③F—D
不同价态铁元素的转化
解析: 此题从反应转化过程来看,唯一能作为解题突破口的是红褐色固体F。结合题意不妨设F即为Fe(OH)3固体。由题可知,A在不同条件下反应能得到C和D,而A经反应得到的B在同一反应中能产生C和D,C应为低价态,C经反应得到E,而E经O2氧化可得F[Fe(OH)3]。由此可判断E为Fe(OH)2,则C为Fe2+,所以D为Fe3+,而B则应是Fe3O4,A是Fe。把推断的结论进行验证,符合题意。
答案: ①Fe3O4+8H+===Fe2++2Fe3++4H2O
②4Fe(OH)2+O2+2H2O===4Fe(OH)3
③Fe(OH)3+3H+===Fe3++3H2O
[思考感悟] 铁元素及其化合物的推断题的解题关键:
一是寻找特征反应及特征现象,二是正确运用“铁三角”的转化关系,三是注意与其他金属及其化合物知识的综合。化学框图题综合性强,难度大,解题时常由于知识的综合性不够,找不到“突破口”而无法下手。
1.将铁粉、铜粉、FeCl3溶液和CuCl2溶液混合于某容器中充分反应(假定容器不参与反应)。试判断下列情况下,溶液中存在的金属离子和金属单质。
(1)若铁粉有剩余,则容器中不可能有的离子是________;铜单质________(填“一定”或“可能”)存在。
(2)若氯化铜有剩余,则容器中还可能有的离子为________;铜单质________(填“一定”或“可能”)存在。
(3)若氯化铁和氯化铜都有剩余,则容器中不可能有的单质是________,Fe2+________(填“一定”或“可能”)存在。
答案: (1)Fe3+、Cu2+ 一定 (2)Fe3+ 可能 (3)Fe、Cu 一定
解析: 本题考查物质的共存问题,依据金属活动性:Fe>Cu,离子氧化性:Fe3+>Cu2+。
要证明某溶液中不含Fe3+而可能含Fe2+,进行如下实验操作时,最佳顺序是( )
①加足量氯水 ②加足量KMnO4溶液 ③加少量KSCN溶液
A.①② B.③②
C.③① D.①②③
Fe2+和Fe3+的检验
解析: 本题检验方法的关键是Fe3+遇SCN-反应显红色,而Fe2+遇SCN-不显红色,加入KSCN溶液不显红色证明无Fe3+,再加氯水,如有Fe2+则可被氧化为Fe3+遇SCN-反应显红色。KMnO4溶液也能氧化Fe2+,但因其本身呈紫色,使Fe3+与SCN-反应显红色不易观察。
答案: C
[思考感悟] 解答本题要注意以下两点:
(1)首先检验溶液中是否有Fe3+,可用KSCN溶液。
(2)加入氧化剂,验证溶液中含有Fe2+,但要注意加入的氧化剂不能对观察现象产生干扰。
2.现榨的苹果汁在空气中会由淡绿色变为棕黄色,其原因可能是( )
A.苹果汁中的Fe2+变成Fe3+
B.苹果汁中含有Cu2+
C.苹果汁含有OH-
D.苹果汁含有Fe3+
解析: 苹果汁中的淡绿色的Fe2+被空气中的氧气氧化成棕黄色的Fe3+。
答案: A
热点实验 金属氧化物测定的实验探究
[探究举例] 氧化铁和氧化亚铜都是红色粉末,常用作颜料。某校一化学实验小组通过实验来探究一红色粉末是Fe2O3、Cu2O或两者的混合物。探究过程如下:
查阅资料 Cu2O是一种碱性氧化物,溶于稀硫酸生成Cu和CuSO4,在空气中加热生成CuO。
提出假设 假设1:红色粉末是Fe2O3;假设2:红色粉末是Cu2O;假设3:红色粉末是Fe2O3和Cu2O的混合物。
设计探究实验 取少量粉末放入足量稀硫酸中,在所得溶液中再滴加KSCN试剂。
(1)若假设1成立,则实验现象是___________________________。
(2)若滴加KSCN试剂后溶液不变红色,则证明原固体粉末中一定不含氧化铁。你认为这种说法合理吗?___________________________。
简述你的理由:(不需写出反应的化学方程式_________________________。
(3)若固体粉末完全溶解无固体存在,滴加KSCN试剂时溶液不变红色,则证明原固体粉末是______________________,写出发生反应的离子方程式:
___________________________________________________________________。
延伸探究 经实验分析,确定红色粉末为Fe2O3和Cu2O的混合物。
(4)实验小组欲用加热法测定Cu2O的质量分数。取a g固体粉末在空气中充分加热,待质量 不再变化时,称其质量为b g(b>a),则混合物中Cu2O的质量分数为________。
1.(2011·兰州高一检测)下列化合物中,不能由单质直接化合而得到的是( )
A.FeCl2 B.FeS
C.Fe3O4 D.FeCl3
解析: 铁单质在点燃条件下可以和Cl2反应生成FeCl3,和O2反应生成Fe3O4,在加热条件下可以和S反应生成FeS。
答案: A
2.世博园地区改造规划的实施将提升上海的环境质量。位于规划区的一座大型炼钢厂搬迁后,附近居民将不再受到该厂产生的棕红色烟雾的困扰。你估计这一空气污染物可能含有( )
A.FeO粉尘 B.P2O5粉尘
C.Fe2O3粉尘 D.SiO2粉尘
解析: Fe2O3呈棕红色,故炼钢厂产生的棕红色烟雾是Fe2O3所致。
答案: C
3.(2010·广州高一检测)下列离子的检验方法合理的是( )
A.向某溶液中滴入KSCN溶液呈红色,说明不含Fe2+
B.向某溶液中通入Cl2,然后再加入KSCN溶液变红色,说明原溶液中含有Fe2+
C.向某溶液中加入NaOH溶液,得到红褐色沉淀,说明溶液中含有Fe3+
D.向某溶液中加入NaOH溶液得白色沉淀,又观察到颜色逐渐变为红褐色,说明溶液中含有Fe2+,不含有Mg2+
解析: A项说明含Fe3+,但不能说明是否含Fe2+;B项说明通入Cl2后溶液中含有Fe3+,不能说明原溶液中是否含有Fe2+;因为Mg(OH)2为白色沉淀,Fe(OH)2转化为Fe(OH)3时的颜色变化会掩盖其他白色沉淀的现象,所以当溶液中含有Mg2+时,会出现同样的上述现象,故D项不能说明溶液中是否含Mg2+,C选项正确。
答案: C
4.下列离子方程式正确的是( )
A.铁跟FeCl3溶液反应:Fe+Fe3+===2Fe2+
B.Fe跟稀盐酸反应:2Fe+6H+===2Fe3++3H2↑
C.FeCl2溶液跟Cl2反应:Fe2++Cl2===Fe3++2Cl-
D.Fe(OH)3跟盐酸反应:Fe(OH)3+3H+===Fe3++3H2O
解析: A中电荷不守恒,应为:Fe+2Fe3+===3Fe2+;B中违反反应事实,应为:Fe+ 2H+===Fe2++H2↑;C中得失电子、电荷均不守恒,应为:2Fe2++Cl2===2Fe3++2Cl-。
答案: D
5.电子工业常用30%的FeCl3溶液腐蚀镀有铜箔的绝缘板,制印刷电路板。
(1)发生反应的离子方程式为________________________________________________________________________。
(2)为了从废液中回收铜,并重新制得纯净的FeCl3溶液,拟采用下列步骤,请在空格及括号内填入适当的分子式(化学式),以达预期目的。
解析: (1)用FeCl3溶液制印刷电路板发生的反应为:
2Fe3++Cu===2Fe2++Cu2+。
(2)回收铜,就需把Cu置换出来,同时要制得纯净的FeCl3,则只能用Fe还原,过量的Fe用稀盐酸溶液,所得FeCl2溶液通入Cl2即可得FeCl3。
答案: (1)2Fe3++Cu===2Fe2++Cu2+
(2)
