3.3 用途广泛的金属材料(人教版必修1)
文档属性
| 名称 | 3.3 用途广泛的金属材料(人教版必修1) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 00:00:00 | ||
图片预览











文档简介
(共55张PPT)
第三节 用途广泛的金属材料
金属材料在生活中随处可见,常见的金属材料有哪些?如何正确的选择金属材料呢?
1.了解合金的定义及特性。
2.了解铜合金和钢的分类、组成及用途。
3.初步认识正确选择和合理使用金属材料的意义。
1.合金的定义
合金是指由两种或两种以上的_____ (或______ ______)熔合而成的具有金属特性的物质。
常见合金
金属
金属跟
非金属
2.合金的部分性质
(1)硬度:合金的硬度及机械加工性能一般 _____各成分金属。
(2)熔点:合金的熔点一般_____各成分金属。
高于
低于
3.常见的合金
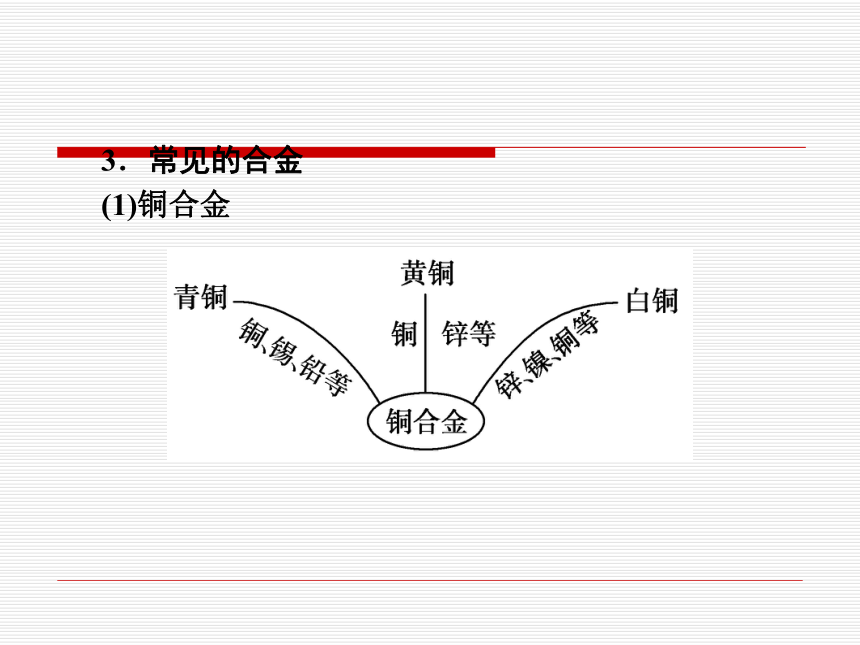
(1)铜合金
(2)钢
常见合金的成分及其重要应用
1.铜合金
合金 主要成分 主要性能 主要用途
青铜 铜、锡 强度高、可塑性好、耐磨、耐腐蚀 机械零件,如轴承、齿轮等
黄铜 铜、锌 强度高、可塑性好、易加工、耐腐蚀 机械零件、仪表、日用品
白铜 铜、镍 光泽好、耐磨、耐腐蚀、易加工 钱币、代替银做饰品
2.合金钢
名称 主要合金元素 主要特性 主要用途
锰钢 锰 韧性好,硬度大 钢轨、轴承、钢模、挖掘机铲斗、坦克装甲
不锈钢 铬、镍 抗腐蚀性好 医疗器械、容器、反应釜、炊具
硅钢 硅 导磁性好 变压器、发电机和电动机中的铁芯
钨钢 钨 耐高温、硬度大 刀具
3.铝合金
4.钛合金
钛的合金具有密度小、强度高、耐腐蚀、耐高温等优点,主要用于飞机、火箭、导弹、人造卫星、宇宙飞船等领域。
成分元素 主要特性 主要用途
Al、Mg、Cu、Si等 密度小,强度大 用于汽车、飞机、火箭、船舶制造
[温馨提示] 合金的形成改变了金属的内部结构,对部分物理性质影响较大。同时对化学性质也有影响,如不锈钢的抗腐蚀能力比纯铁强的多。
1.合金相对纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它的各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
解析: 合金具有许多优良的物理、化学或机械性能,在许多方面优于各成分金属。例如,合金的硬度一般比各成分金属硬度大,多数合金的熔点一般比各成分金属的熔点低。
答案: A
1.金属材料的分类
金属材料
正确选用金属材料
2.金属材料的正确选用
在进行金属材料选择时,常常要考虑以下几 个方面:主要用途、____、____性质(密度、 硬度、强度、导电性)、化学性质(对水的作 用、耐____性)、价格、加工难度、日常维护 等方面。
外观
物理
腐蚀
正确选用金属材料
金属材料的用途广泛,涉及日常生活、工农业生产和科学研究等方面,它的选择不仅关系到生活质量、生产效益、经济成本等问题,还关系到环境保护、可持续发展等方面。选择金属材料时,一般从以下几个方面考虑:
1.主要用途:材料的用途与材料的性能有很密切的关系。
2.外观:不仅要材料本身外观美,还要使材料的外观与周边环境相协调。
3.物理性质:物理性质包括密度、硬度、强度、伸缩性、导电导热性、被水浸润性等。
4.化学性质:化学性质主要包括在空气、水、阳光、酸、碱、盐等的环境里的化学稳定性。这些性质会影响到材料的使用寿命。
5.价格:考虑价格时要把对材料的基本需求和材料的基本性能放在前面。
6.加工难度:考虑加工难度时要将材料的性质与加工的技术、设备相结合。
7.日常维护:金属材料耐腐蚀性相对较弱,在选金属材料时必须要考虑到使用后的日常维护问题。
8.对环境的影响:一是要考虑到在使用材料的过程中,它的反光性、放射性、产生的噪音等对环境的不利影响;二是要考虑到材料的废弃物对环境有哪些不利影响。要尽量做到避免有关的不利影响。
2.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、耐腐蚀等,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,做钛合金装饰门
解析: 由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;由于钛和钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排异反应,因此可以用来制造人造骨,C正确;由于其密度小、可塑性好、易于加工,因此可用于家庭装修,做钛合金装饰门,D正确;只有A错误,由于其熔点高,不适合做保险丝。
答案: A
铜是生命必要的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2几种化合价。
合金的性质
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)跟铁反应生成铜],试写出该反应的离子方程式:_________________。
(2)虽然铜比铁稳定,但铜器表面经常会生成铜锈[即铜绿,化学式为Cu2(OH)2CO3],其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:____________
__________________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币,试从物理性质和化学性质的角度分析为什么铜常用于制造货币(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃):________________
________________________________________________________。
思路点拨: 解答本题要注意以下两点:
(1)铜元素的主要性质及其单质的物理性质和化学性质。
(2)准确分析并应用题给信息。
解析: (1)铁跟硫酸铜发生置换反应;(2)铜生锈的反应物有好几种,缺一不可,所以保持空气干燥,可以减缓铜的锈蚀;(3)从物理性质上看,铜比铁熔点低,易于铸造,从化学性质看,铜排在金属活动性顺序中氢之后,比较稳定,不易锈蚀。
答案: (1)Fe+Cu2+===Fe2++Cu
(2)干燥空气中保存
(3)铜的化学性质比较稳定,不易被腐蚀;铜的熔点比较低,容易冶炼铸造成型
1.纯铁的熔点为1 535 ℃,而高炉中炼铁时生铁(含碳量较高的铁合金)在1 200 ℃左右就熔化了,这是因为( )
A.铁的纯度越高,熔点越低
B.合金的熔点比其成分物质的熔点高
C.形成了铁碳合金,所以熔点变低
D.在高炉中熔化的过程发生了化学反应
解析: 合金的熔点比各成分金属的熔点低。生铁是铁合金,铁的纯度越高,熔点越高。A项、B项错误,合金的熔化过程没有发生化学反应,D项错。
答案: C
金属材料的选用
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
解析: 镁铝合金强度高,制成的门窗、防护栏等坚硬牢固;密度小,同体积下比较轻,方便运输、搬运;不容易生锈,制成的装潢材料经久耐用。只有导电性好与这方面用途无关。
答案: B
[思考感悟] 选择金属材料用做装修应尽量做到:①外观美
②强度高 ③密度小 ④不易生锈 ⑤便于加工 ⑥经久耐用。
2.有资料显示,铝元素在人体内的残留积累量过多后对大脑发育有不良影响,建议多用不锈钢代替铝合金作为材料制作餐厨等日用品。下列说法中不正确的是(多选)( )
A.不锈钢中的主要元素是镍、铬
B.不锈钢属于铁合金
C.不锈钢是无腐蚀性的
D.不锈钢是绝对不能被腐蚀的
解析: 不锈钢是含有镍、铬元素的铁合金,主要成分还是铁。不锈钢本身无腐蚀性,耐腐蚀性也很强,但不锈钢也并不是绝对不能被腐蚀的。
答案: AD
热点实验 合金中各成分含量的测定
[探究举例] 用定量方法进行实验,测定某铁铝合金中铝的质量分数。实验操作过程如下:称取该合金试样1.0 g,放入烧杯中加足量盐酸,盖上玻璃片,使其充分反应。反应停止,经冷却向其中加入过量NaOH溶液,充分放置后过滤,过滤出的沉淀经洗涤在空气中加热灼烧至恒重,得到固体物1.2 g,试回答:
(1)实验中以玻璃片盖烧杯的原因是_________________________________;
(2)加入过量NaOH溶液的作用是
________________________________________________________________________;
(3)加入NaOH溶液后充分放置的作用是
________________________________________________________________________;
(4)在空气中将沉淀灼烧的目的是
_________________________________;
(5)合金中铝的质量分数为(写出计算式) _________________________________。
(6)想一想,还可用什么方法来测定Al的质量分数?
解析: 铁、铝合金中的铁和铝均与盐酸反应,产生的Fe2+、Al3+与过量的NaOH反应后,Fe2+先生成Fe(OH)2沉淀,放置后进一步转化成Fe(OH)3,而Fe(OH)3受热分解后得Fe2O3;Al3+转化为AlO,仍存在于溶液中。沉淀物为Fe(OH)3,1.2 g固体的成分为Fe2O3。
答案: (1)防止液体溅出,影响测定结果
(2)使Al完全反应进入溶液和Fe(OH)2分离
(3)使不稳定的Fe(OH)2完全转化为Fe(OH)3
(4)将Fe(OH)3转化为Fe2O3
1.下列关于合金的叙述正确的是( )
①具有金属的特性 ②通过熔合而成 ③含有两种或两种以上金属或金属和非金属 ④一般来说,合金的熔点比各组分的熔点低
A.仅①② B.仅③④
C.仅②③④ D.全部
解析: 合金是由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质,其熔点一般低于成分金属,硬度高于成分金属。
答案: D
2.下表中金属难与表中其他金属形成二元合金的是( )
A.Cu、Fe B.Fe、Au
C.Zn、W D.Cu、Ag
Fe Cu Zn Ag Au W
熔点/℃ 1 535 1 083 419.5 962 1 064 3 410
沸点/℃ 3 000 2 595 907 2 212 2 707 5 627
解析:合金是在熔化状态下形成的一种熔合物。熔点之间相差过大不易形成熔合物。Zn熔点较低,491.5 ℃时,其他金属还未熔化;其他金属熔化时,它已气化。W熔点过高,同样不易与表中其他金属形成合金。
答案: C
3.为验证全运金牌为纯金制造,而非合金,可选用下列哪种试剂进行鉴别( )
A.硫酸铜溶液 B.盐酸
C.稀硝酸 D.硝酸银溶液
解析: 硝酸能溶解除Au、Pt以外的其他金属,故取制造金牌的金属粉末加入硝酸,如能部分溶解则为合金,不溶则为纯金。
答案: C
4.日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是只有在高温下才能与其他物质反应
C.铝制品表面有一层致密
的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,
可以保护铝制品
解析: 铝很活泼,常温下能与氧气反应生成一层致密坚硬的氧化物薄膜,能阻止铝继续被氧化,故铝有一定的抗腐蚀能力。
答案: C
5.根据你的生活经验和下表所提供的信息,分析并回答下列问题。
物理性质 物理性质比较
导电性(以银的导电性为100作标准) 银 铜 金 铝 锌 铁 铅
100 99 74 61 27 17 7.9
密度g/cm3 金 铅 银 铜 铁 锌 钠
19.3 11.3 10.5 8.92 7.86 7.14 2.70
熔点℃ 钨 铁 铜 金 银 铝 锡
3 410 1 535 1 083 1 064 962 660 232
硬度(以金刚石的硬度为10作标准) 铬 铁 银 铜 金 铝 铅
9.4~9.5 2.5~4 2.5~3 2.5~3 2~2.9 1.5
(1)为什么菜刀、锤子等通常用铁制而不用铅制?
(2)银的导电性比铜好,为什么导线一般用铜制而不用银制?
(3)为什么灯泡里的灯丝用钨制而不用锡制?
解析:在确定金属的用途时,要考虑其硬度、熔点、导电性等多种性质,有时还要考虑价格、资源、是否便利、是否有毒、是否利于回收等因素。正确解答本题还要会读题,要充分利用题中所给信息。
答案:(1)因为铁的硬度比铅大,且铅有毒,故常用铁而不用铅制菜刀、锤子。
(2)银和铜导电性相近,但银比铜贵得多,且电线用量大,所以用铜不用银。
(3)因为钨的熔点高(3 410 ℃),而锡的熔点(232 ℃)太低,通电时锡就熔化了,所以用钨丝而不用锡丝作灯泡的灯丝。
第三节 用途广泛的金属材料
金属材料在生活中随处可见,常见的金属材料有哪些?如何正确的选择金属材料呢?
1.了解合金的定义及特性。
2.了解铜合金和钢的分类、组成及用途。
3.初步认识正确选择和合理使用金属材料的意义。
1.合金的定义
合金是指由两种或两种以上的_____ (或______ ______)熔合而成的具有金属特性的物质。
常见合金
金属
金属跟
非金属
2.合金的部分性质
(1)硬度:合金的硬度及机械加工性能一般 _____各成分金属。
(2)熔点:合金的熔点一般_____各成分金属。
高于
低于
3.常见的合金
(1)铜合金
(2)钢
常见合金的成分及其重要应用
1.铜合金
合金 主要成分 主要性能 主要用途
青铜 铜、锡 强度高、可塑性好、耐磨、耐腐蚀 机械零件,如轴承、齿轮等
黄铜 铜、锌 强度高、可塑性好、易加工、耐腐蚀 机械零件、仪表、日用品
白铜 铜、镍 光泽好、耐磨、耐腐蚀、易加工 钱币、代替银做饰品
2.合金钢
名称 主要合金元素 主要特性 主要用途
锰钢 锰 韧性好,硬度大 钢轨、轴承、钢模、挖掘机铲斗、坦克装甲
不锈钢 铬、镍 抗腐蚀性好 医疗器械、容器、反应釜、炊具
硅钢 硅 导磁性好 变压器、发电机和电动机中的铁芯
钨钢 钨 耐高温、硬度大 刀具
3.铝合金
4.钛合金
钛的合金具有密度小、强度高、耐腐蚀、耐高温等优点,主要用于飞机、火箭、导弹、人造卫星、宇宙飞船等领域。
成分元素 主要特性 主要用途
Al、Mg、Cu、Si等 密度小,强度大 用于汽车、飞机、火箭、船舶制造
[温馨提示] 合金的形成改变了金属的内部结构,对部分物理性质影响较大。同时对化学性质也有影响,如不锈钢的抗腐蚀能力比纯铁强的多。
1.合金相对纯金属制成的金属材料来说优点是( )
①合金的硬度一般比它的各成分金属的大 ②一般合金的熔点比它的各成分金属的更低 ③改变原料的配比,改变生成合金的条件,可得到具有不同性能的合金 ④合金比纯金属的导电性更强 ⑤合金比纯金属的应用范围更广泛
A.①②③⑤ B.②③④
C.①②④ D.①②④⑤
解析: 合金具有许多优良的物理、化学或机械性能,在许多方面优于各成分金属。例如,合金的硬度一般比各成分金属硬度大,多数合金的熔点一般比各成分金属的熔点低。
答案: A
1.金属材料的分类
金属材料
正确选用金属材料
2.金属材料的正确选用
在进行金属材料选择时,常常要考虑以下几 个方面:主要用途、____、____性质(密度、 硬度、强度、导电性)、化学性质(对水的作 用、耐____性)、价格、加工难度、日常维护 等方面。
外观
物理
腐蚀
正确选用金属材料
金属材料的用途广泛,涉及日常生活、工农业生产和科学研究等方面,它的选择不仅关系到生活质量、生产效益、经济成本等问题,还关系到环境保护、可持续发展等方面。选择金属材料时,一般从以下几个方面考虑:
1.主要用途:材料的用途与材料的性能有很密切的关系。
2.外观:不仅要材料本身外观美,还要使材料的外观与周边环境相协调。
3.物理性质:物理性质包括密度、硬度、强度、伸缩性、导电导热性、被水浸润性等。
4.化学性质:化学性质主要包括在空气、水、阳光、酸、碱、盐等的环境里的化学稳定性。这些性质会影响到材料的使用寿命。
5.价格:考虑价格时要把对材料的基本需求和材料的基本性能放在前面。
6.加工难度:考虑加工难度时要将材料的性质与加工的技术、设备相结合。
7.日常维护:金属材料耐腐蚀性相对较弱,在选金属材料时必须要考虑到使用后的日常维护问题。
8.对环境的影响:一是要考虑到在使用材料的过程中,它的反光性、放射性、产生的噪音等对环境的不利影响;二是要考虑到材料的废弃物对环境有哪些不利影响。要尽量做到避免有关的不利影响。
2.钛和钛的合金被誉为“21世纪最有发展前景的金属材料”,它们具有很多优良的性能,如熔点高、密度小、可塑性好、易于加工、耐腐蚀等,尤其是钛合金与人体器官具有很好的“生物相容性”。根据它们的主要性能,下列用途不切合实际的是( )
A.用来做保险丝
B.用于制造航天飞机
C.用来制造人造骨
D.用于家庭装修,做钛合金装饰门
解析: 由于钛和钛的合金密度小、可塑性好,因此可用于航天领域,B正确;由于钛和钛合金与人体器官具有很好的“生物相容性”,可与人体的组织相容,不引起排异反应,因此可以用来制造人造骨,C正确;由于其密度小、可塑性好、易于加工,因此可用于家庭装修,做钛合金装饰门,D正确;只有A错误,由于其熔点高,不适合做保险丝。
答案: A
铜是生命必要的元素,也是人类最早使用的金属之一,铜的生产和使用对国计民生各个方面产生了深远的影响。在化学反应中,铜元素可表现为0、+1、+2几种化合价。
合金的性质
(1)在西汉古籍中曾有记载:曾青得铁则化为铜[即曾青(CuSO4)跟铁反应生成铜],试写出该反应的离子方程式:_________________。
(2)虽然铜比铁稳定,但铜器表面经常会生成铜锈[即铜绿,化学式为Cu2(OH)2CO3],其中生成铜绿的反应物除铜外还有O2、CO2和H2O。试写出保护铜制品的方法:____________
__________________________________。
(3)铜钱在历史上曾经是一种广泛流通的货币,试从物理性质和化学性质的角度分析为什么铜常用于制造货币(铜的熔点是1 183.4 ℃,铁的熔点是1 534.8 ℃):________________
________________________________________________________。
思路点拨: 解答本题要注意以下两点:
(1)铜元素的主要性质及其单质的物理性质和化学性质。
(2)准确分析并应用题给信息。
解析: (1)铁跟硫酸铜发生置换反应;(2)铜生锈的反应物有好几种,缺一不可,所以保持空气干燥,可以减缓铜的锈蚀;(3)从物理性质上看,铜比铁熔点低,易于铸造,从化学性质看,铜排在金属活动性顺序中氢之后,比较稳定,不易锈蚀。
答案: (1)Fe+Cu2+===Fe2++Cu
(2)干燥空气中保存
(3)铜的化学性质比较稳定,不易被腐蚀;铜的熔点比较低,容易冶炼铸造成型
1.纯铁的熔点为1 535 ℃,而高炉中炼铁时生铁(含碳量较高的铁合金)在1 200 ℃左右就熔化了,这是因为( )
A.铁的纯度越高,熔点越低
B.合金的熔点比其成分物质的熔点高
C.形成了铁碳合金,所以熔点变低
D.在高炉中熔化的过程发生了化学反应
解析: 合金的熔点比各成分金属的熔点低。生铁是铁合金,铁的纯度越高,熔点越高。A项、B项错误,合金的熔化过程没有发生化学反应,D项错。
答案: C
金属材料的选用
铝镁合金因坚硬、轻巧、美观、洁净、易于加工而成为新型建筑装潢材料,主要用于制作窗框、卷帘门、防护栏等。下列与这些用途无关的性质是( )
A.不易生锈 B.导电性好
C.密度小 D.强度高
解析: 镁铝合金强度高,制成的门窗、防护栏等坚硬牢固;密度小,同体积下比较轻,方便运输、搬运;不容易生锈,制成的装潢材料经久耐用。只有导电性好与这方面用途无关。
答案: B
[思考感悟] 选择金属材料用做装修应尽量做到:①外观美
②强度高 ③密度小 ④不易生锈 ⑤便于加工 ⑥经久耐用。
2.有资料显示,铝元素在人体内的残留积累量过多后对大脑发育有不良影响,建议多用不锈钢代替铝合金作为材料制作餐厨等日用品。下列说法中不正确的是(多选)( )
A.不锈钢中的主要元素是镍、铬
B.不锈钢属于铁合金
C.不锈钢是无腐蚀性的
D.不锈钢是绝对不能被腐蚀的
解析: 不锈钢是含有镍、铬元素的铁合金,主要成分还是铁。不锈钢本身无腐蚀性,耐腐蚀性也很强,但不锈钢也并不是绝对不能被腐蚀的。
答案: AD
热点实验 合金中各成分含量的测定
[探究举例] 用定量方法进行实验,测定某铁铝合金中铝的质量分数。实验操作过程如下:称取该合金试样1.0 g,放入烧杯中加足量盐酸,盖上玻璃片,使其充分反应。反应停止,经冷却向其中加入过量NaOH溶液,充分放置后过滤,过滤出的沉淀经洗涤在空气中加热灼烧至恒重,得到固体物1.2 g,试回答:
(1)实验中以玻璃片盖烧杯的原因是_________________________________;
(2)加入过量NaOH溶液的作用是
________________________________________________________________________;
(3)加入NaOH溶液后充分放置的作用是
________________________________________________________________________;
(4)在空气中将沉淀灼烧的目的是
_________________________________;
(5)合金中铝的质量分数为(写出计算式) _________________________________。
(6)想一想,还可用什么方法来测定Al的质量分数?
解析: 铁、铝合金中的铁和铝均与盐酸反应,产生的Fe2+、Al3+与过量的NaOH反应后,Fe2+先生成Fe(OH)2沉淀,放置后进一步转化成Fe(OH)3,而Fe(OH)3受热分解后得Fe2O3;Al3+转化为AlO,仍存在于溶液中。沉淀物为Fe(OH)3,1.2 g固体的成分为Fe2O3。
答案: (1)防止液体溅出,影响测定结果
(2)使Al完全反应进入溶液和Fe(OH)2分离
(3)使不稳定的Fe(OH)2完全转化为Fe(OH)3
(4)将Fe(OH)3转化为Fe2O3
1.下列关于合金的叙述正确的是( )
①具有金属的特性 ②通过熔合而成 ③含有两种或两种以上金属或金属和非金属 ④一般来说,合金的熔点比各组分的熔点低
A.仅①② B.仅③④
C.仅②③④ D.全部
解析: 合金是由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质,其熔点一般低于成分金属,硬度高于成分金属。
答案: D
2.下表中金属难与表中其他金属形成二元合金的是( )
A.Cu、Fe B.Fe、Au
C.Zn、W D.Cu、Ag
Fe Cu Zn Ag Au W
熔点/℃ 1 535 1 083 419.5 962 1 064 3 410
沸点/℃ 3 000 2 595 907 2 212 2 707 5 627
解析:合金是在熔化状态下形成的一种熔合物。熔点之间相差过大不易形成熔合物。Zn熔点较低,491.5 ℃时,其他金属还未熔化;其他金属熔化时,它已气化。W熔点过高,同样不易与表中其他金属形成合金。
答案: C
3.为验证全运金牌为纯金制造,而非合金,可选用下列哪种试剂进行鉴别( )
A.硫酸铜溶液 B.盐酸
C.稀硝酸 D.硝酸银溶液
解析: 硝酸能溶解除Au、Pt以外的其他金属,故取制造金牌的金属粉末加入硝酸,如能部分溶解则为合金,不溶则为纯金。
答案: C
4.日常生活中常用铝制炊具,它质轻且坚固耐用,其中的原因是( )
A.铝很不活泼,不易与其他物质反应
B.铝虽然很活泼,但是只有在高温下才能与其他物质反应
C.铝制品表面有一层致密
的氧化物薄膜,起保护作用
D.铝制品表面镀有一层铜,
可以保护铝制品
解析: 铝很活泼,常温下能与氧气反应生成一层致密坚硬的氧化物薄膜,能阻止铝继续被氧化,故铝有一定的抗腐蚀能力。
答案: C
5.根据你的生活经验和下表所提供的信息,分析并回答下列问题。
物理性质 物理性质比较
导电性(以银的导电性为100作标准) 银 铜 金 铝 锌 铁 铅
100 99 74 61 27 17 7.9
密度g/cm3 金 铅 银 铜 铁 锌 钠
19.3 11.3 10.5 8.92 7.86 7.14 2.70
熔点℃ 钨 铁 铜 金 银 铝 锡
3 410 1 535 1 083 1 064 962 660 232
硬度(以金刚石的硬度为10作标准) 铬 铁 银 铜 金 铝 铅
9.4~9.5 2.5~4 2.5~3 2.5~3 2~2.9 1.5
(1)为什么菜刀、锤子等通常用铁制而不用铅制?
(2)银的导电性比铜好,为什么导线一般用铜制而不用银制?
(3)为什么灯泡里的灯丝用钨制而不用锡制?
解析:在确定金属的用途时,要考虑其硬度、熔点、导电性等多种性质,有时还要考虑价格、资源、是否便利、是否有毒、是否利于回收等因素。正确解答本题还要会读题,要充分利用题中所给信息。
答案:(1)因为铁的硬度比铅大,且铅有毒,故常用铁而不用铅制菜刀、锤子。
(2)银和铜导电性相近,但银比铜贵得多,且电线用量大,所以用铜不用银。
(3)因为钨的熔点高(3 410 ℃),而锡的熔点(232 ℃)太低,通电时锡就熔化了,所以用钨丝而不用锡丝作灯泡的灯丝。
