第三章 金属及其化合物 复习与测评3(人教版必修1)
文档属性
| 名称 | 第三章 金属及其化合物 复习与测评3(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 21:50:12 | ||
图片预览







文档简介
(共28张PPT)
1.突破点
(1)特殊颜色
①焰色反应:Na+(黄色)、K+(紫色)
金属及其化合物的推断
②有色溶液
③有色固体
红色:Cu、Fe2O3(红棕色)
红褐色:Fe(OH)3
含有的离子 Fe2+ Fe3+ Cu2+ MnO
颜色 浅绿色 黄色 蓝色 紫色
绿色:Cu2(OH)2CO3、FeSO4·7H2O
蓝色:Cu(OH)2、CuSO4·5H2O
黑色:CuO、FeO、MnO2、炭黑
浅黄色:Na2O2、AgBr
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、Al(OH)3、Mg(OH)2
(2)特殊性质
①在一定条件下能漂白有色物质的淡黄色固体只有Na2O2。
②遇SCN-显红色的只有Fe3+。
③常见的可溶于NaOH溶液的白色沉淀有Al(OH)3。
④不溶于水和稀HNO3(或HCl)的化合物:BaSO4(白色)、AgCl(白色)。
(3)特征反应
①能与强酸反应产生气体的物质:活泼金属,如Na、Al、Zn等;不稳定的弱酸盐,如碳酸盐、碳酸氢盐等。
②能与碱反应产生气体的物质:如Al等单质;铵盐等。
③既能与强酸、又能与强碱反应的物质:
金属单质,如Al;两性化合物,如Al2O3、Al(OH)3等;弱酸铵盐,如NH4HCO3、(NH4)2CO3等;弱酸的酸式盐,如NaHCO3、NaHS等。
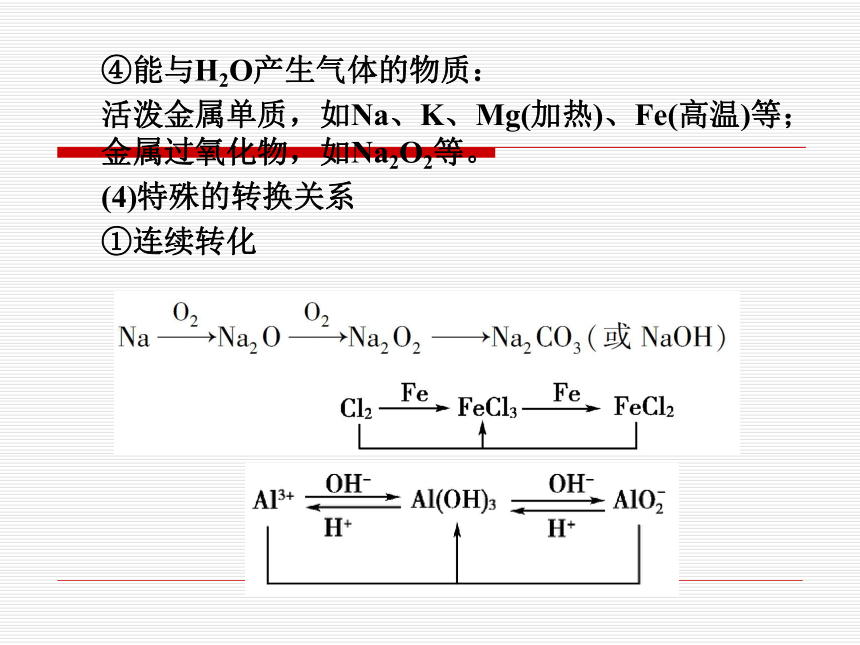
④能与H2O产生气体的物质:
活泼金属单质,如Na、K、Mg(加热)、Fe(高温)等;金属过氧化物,如Na2O2等。
(4)特殊的转换关系
①连续转化
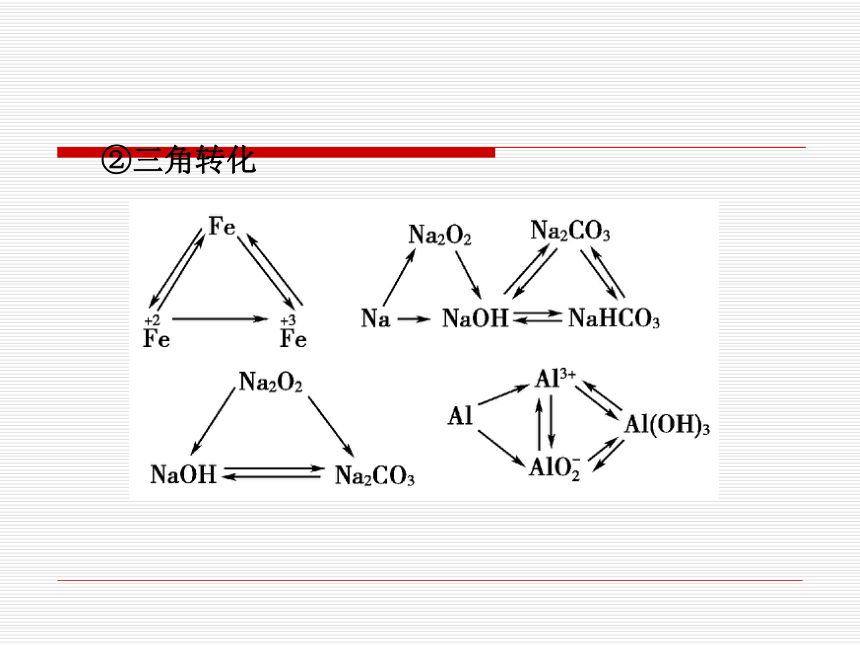
②三角转化
2.方法
按以下步骤分析题目,往往能迅速理清思路高效解题
审题→筛选信息→联系知识→寻找突破口→推理判断→得出结论→验证
1.已知有下图所示物质相互转换关系:
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式_________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式_________________________________;
向G溶液加入A的离子方程式__________________________。
解析: 由焰色反应K+(紫色)和不溶于稀硝酸的白色沉淀(AgCl)一些特征现象或反应,可知D是化合物KCl;由白色沉淀在空气中被氧化转化为红褐色的沉淀,知道F为Fe(OH)3,推出白色沉淀E为Fe(OH)2,那么G就为FeCl3;A与FeCl3反应得到B,A与盐酸反应得到B和气体,那么B一定是亚铁盐溶液FeCl2,A是Fe,气体是氢气;与B反应的C溶液就是KOH。
答案: (1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)Fe3++SCN-===[Fe(SCN)]2+
2Fe3++Fe===3Fe2+
2.(2010·贵港高一检测)有甲、乙、丙三种含钠元素的白色固体,均能溶于水,水溶液呈无色。甲与乙的溶液反应生成丙;加热乙时产生无色气体A,将A通入石灰水中有白色沉淀B生成;加热丙与甲均不产生气体;甲的水溶液有强腐蚀性;气体A与丙的水溶液反应可得到乙;过量甲与A反应可得到丙,甲不足时与A反应可得到乙。试判断
(1)甲、乙、丙、A、B各是什么物质?
甲________,乙________,丙________,A________,B________。
(2)写出下列反应的化学方程式(若是离子反应的只写离子方程式)
①甲+乙―→丙_______________________;
②乙A_______________________________;
③甲(不足)+A―→乙__________________。
解析: 因为甲、乙、丙均为含钠元素的白色固体,加热乙时产生无色气体A,所以乙为NaHCO3,A为CO2,据“甲能与乙发生反应”知甲为NaOH,发生反应为NaOH+NaHCO3===Na2CO3+H2O,故丙为Na2CO3,白色沉淀B为CaCO3,NaOH与CO2反应时,NaOH过量时反应为2NaOH+CO2===Na2CO3+H2O,NaOH不足时,反应为NaOH+CO2===NaHCO3。
化学计算中的常用方法
3.(1)Na2SO4和Al2(SO4)3两种盐溶液,若溶质的物质的量相等,分别与足量的BaCl2溶液反应,所得沉淀的物质的量之比为________,当产生沉淀的质量相等时,消耗的两种盐的物质的量之比为________。
(2)Na2CO3、NaHCO3的混合物90.6 g与1 L 1.3 mol·L-1的盐酸恰好完全反应,产生的气体通入到足量的澄清石灰水中,得到沉淀的质量为100 g,则混合物中Na2CO3和NaHCO3的物质的量各是________、________。
(3)把4.48 L CO2通过一定质量的固体Na2O2后,收集到3.36 L气体(气体均为标况),则3.36 L气体的质量是______。
解析:
(1)
(2)
(3)
答案: (1)1∶3 3∶1 (2)0.3 mol 0.7 mol (3)6.0 g
4.O2、CO、CO2的混合气体共18 mL,点燃爆炸后恢复到原来温度,体积减小了2 mL,再通过足量石灰水,气体体积又减小了10 mL,则原混合气体中O2、CO、CO2的体积比可能为多少?
解析: 根据混合气体间发生的反应分析反应前后的体积之差。本题要对反应物过量问题进行分析讨论。
设参加反应的CO、O2和生成的CO2的体积分别为a、b、c。
因为石灰水只与CO2反应,所以CO2总共10 mL,除去反应生成的4 mL,原有CO2的体积为(10-4) mL=6 mL,原CO、O2共(18-6) mL=12 mL,比参加反应的CO、O2总体积(4+2) mL多。说明CO、O2中必有一种气体剩余,剩余气体体积为(12-6) mL=6 mL。
讨论:
答案: O2、CO、CO2的体积比为1∶5∶3或4∶2∶3。
CO O2 CO2
CO剩余 (4+6) mL=10 mL 2 mL 6 mL
O2剩余 4 mL (2+6) mL=8 mL 6 mL
1.突破点
(1)特殊颜色
①焰色反应:Na+(黄色)、K+(紫色)
金属及其化合物的推断
②有色溶液
③有色固体
红色:Cu、Fe2O3(红棕色)
红褐色:Fe(OH)3
含有的离子 Fe2+ Fe3+ Cu2+ MnO
颜色 浅绿色 黄色 蓝色 紫色
绿色:Cu2(OH)2CO3、FeSO4·7H2O
蓝色:Cu(OH)2、CuSO4·5H2O
黑色:CuO、FeO、MnO2、炭黑
浅黄色:Na2O2、AgBr
白色:Fe(OH)2、CaCO3、BaSO4、AgCl、Al(OH)3、Mg(OH)2
(2)特殊性质
①在一定条件下能漂白有色物质的淡黄色固体只有Na2O2。
②遇SCN-显红色的只有Fe3+。
③常见的可溶于NaOH溶液的白色沉淀有Al(OH)3。
④不溶于水和稀HNO3(或HCl)的化合物:BaSO4(白色)、AgCl(白色)。
(3)特征反应
①能与强酸反应产生气体的物质:活泼金属,如Na、Al、Zn等;不稳定的弱酸盐,如碳酸盐、碳酸氢盐等。
②能与碱反应产生气体的物质:如Al等单质;铵盐等。
③既能与强酸、又能与强碱反应的物质:
金属单质,如Al;两性化合物,如Al2O3、Al(OH)3等;弱酸铵盐,如NH4HCO3、(NH4)2CO3等;弱酸的酸式盐,如NaHCO3、NaHS等。
④能与H2O产生气体的物质:
活泼金属单质,如Na、K、Mg(加热)、Fe(高温)等;金属过氧化物,如Na2O2等。
(4)特殊的转换关系
①连续转化
②三角转化
2.方法
按以下步骤分析题目,往往能迅速理清思路高效解题
审题→筛选信息→联系知识→寻找突破口→推理判断→得出结论→验证
1.已知有下图所示物质相互转换关系:
试回答:
(1)写出B的化学式________,D的化学式________。
(2)写出由E转变成F的化学方程式_________________________________。
(3)写出用KSCN鉴别G溶液的离子方程式_________________________________;
向G溶液加入A的离子方程式__________________________。
解析: 由焰色反应K+(紫色)和不溶于稀硝酸的白色沉淀(AgCl)一些特征现象或反应,可知D是化合物KCl;由白色沉淀在空气中被氧化转化为红褐色的沉淀,知道F为Fe(OH)3,推出白色沉淀E为Fe(OH)2,那么G就为FeCl3;A与FeCl3反应得到B,A与盐酸反应得到B和气体,那么B一定是亚铁盐溶液FeCl2,A是Fe,气体是氢气;与B反应的C溶液就是KOH。
答案: (1)FeCl2 KCl
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
(3)Fe3++SCN-===[Fe(SCN)]2+
2Fe3++Fe===3Fe2+
2.(2010·贵港高一检测)有甲、乙、丙三种含钠元素的白色固体,均能溶于水,水溶液呈无色。甲与乙的溶液反应生成丙;加热乙时产生无色气体A,将A通入石灰水中有白色沉淀B生成;加热丙与甲均不产生气体;甲的水溶液有强腐蚀性;气体A与丙的水溶液反应可得到乙;过量甲与A反应可得到丙,甲不足时与A反应可得到乙。试判断
(1)甲、乙、丙、A、B各是什么物质?
甲________,乙________,丙________,A________,B________。
(2)写出下列反应的化学方程式(若是离子反应的只写离子方程式)
①甲+乙―→丙_______________________;
②乙A_______________________________;
③甲(不足)+A―→乙__________________。
解析: 因为甲、乙、丙均为含钠元素的白色固体,加热乙时产生无色气体A,所以乙为NaHCO3,A为CO2,据“甲能与乙发生反应”知甲为NaOH,发生反应为NaOH+NaHCO3===Na2CO3+H2O,故丙为Na2CO3,白色沉淀B为CaCO3,NaOH与CO2反应时,NaOH过量时反应为2NaOH+CO2===Na2CO3+H2O,NaOH不足时,反应为NaOH+CO2===NaHCO3。
化学计算中的常用方法
3.(1)Na2SO4和Al2(SO4)3两种盐溶液,若溶质的物质的量相等,分别与足量的BaCl2溶液反应,所得沉淀的物质的量之比为________,当产生沉淀的质量相等时,消耗的两种盐的物质的量之比为________。
(2)Na2CO3、NaHCO3的混合物90.6 g与1 L 1.3 mol·L-1的盐酸恰好完全反应,产生的气体通入到足量的澄清石灰水中,得到沉淀的质量为100 g,则混合物中Na2CO3和NaHCO3的物质的量各是________、________。
(3)把4.48 L CO2通过一定质量的固体Na2O2后,收集到3.36 L气体(气体均为标况),则3.36 L气体的质量是______。
解析:
(1)
(2)
(3)
答案: (1)1∶3 3∶1 (2)0.3 mol 0.7 mol (3)6.0 g
4.O2、CO、CO2的混合气体共18 mL,点燃爆炸后恢复到原来温度,体积减小了2 mL,再通过足量石灰水,气体体积又减小了10 mL,则原混合气体中O2、CO、CO2的体积比可能为多少?
解析: 根据混合气体间发生的反应分析反应前后的体积之差。本题要对反应物过量问题进行分析讨论。
设参加反应的CO、O2和生成的CO2的体积分别为a、b、c。
因为石灰水只与CO2反应,所以CO2总共10 mL,除去反应生成的4 mL,原有CO2的体积为(10-4) mL=6 mL,原CO、O2共(18-6) mL=12 mL,比参加反应的CO、O2总体积(4+2) mL多。说明CO、O2中必有一种气体剩余,剩余气体体积为(12-6) mL=6 mL。
讨论:
答案: O2、CO、CO2的体积比为1∶5∶3或4∶2∶3。
CO O2 CO2
CO剩余 (4+6) mL=10 mL 2 mL 6 mL
O2剩余 4 mL (2+6) mL=8 mL 6 mL
