4.2 富集在海水中的元素——氯(人教版必修1)
文档属性
| 名称 | 4.2 富集在海水中的元素——氯(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 2.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 12:15:19 | ||
图片预览










文档简介
(共69张PPT)
第二节 富集在海水中的元素——氯
2008年5月18日,湖北省襄樊老河口市消防大队“119”火警调度中心接到群众报警:仙人渡镇自来水厂装有500公斤液氯的钢瓶发生泄漏,请求消防官兵前往处置。
险情就是命令,消防队领导和队员与自来水公司领导成立临时抢险指挥部,制定处置方案,在装备器材缺乏的情况下成功处置了这起氯气泄漏事故,未造成人员中毒和死亡。液氯是危险化学品,一旦泄漏这种阴森森的黄绿色气体会使人窒息、双目失明,甚至死亡。氯气为什么毒性这么大?它具有怎样的性质和用途呢?
1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解实验室制取Cl2的原理和实验装置。
3.掌握Cl-的检验方法。
1.氯的原子结构及存在
(1)原子结构
原子结构示意图为__________ 错误,氯原子 容易_____________而形成Cl-,表现为典型 的_______。
得到一个电子
氧化性
(2)存在
氯在自然界中以_____态存在,主要以______的 形式存在。
2.氯气的发现
1774年瑞典化学家舍勒发现了氯气,反应的 化学方程式为:
________________________________________。
化合
NaCl
3.物理性质
颜色 状态 气味 毒性 溶解性
_______ ____ ______
_____ _____ 1体积水
溶解
__体积
氯气
黄绿色
气体
刺激性
气味
有毒
2
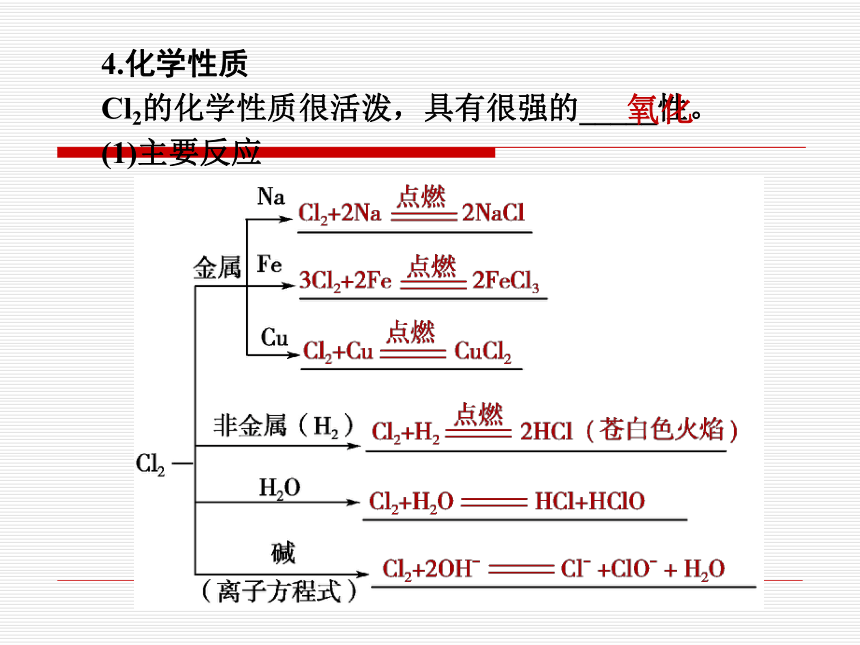
4.化学性质
Cl2的化学性质很活泼,具有很强的_____性。
(1)主要反应
氧化
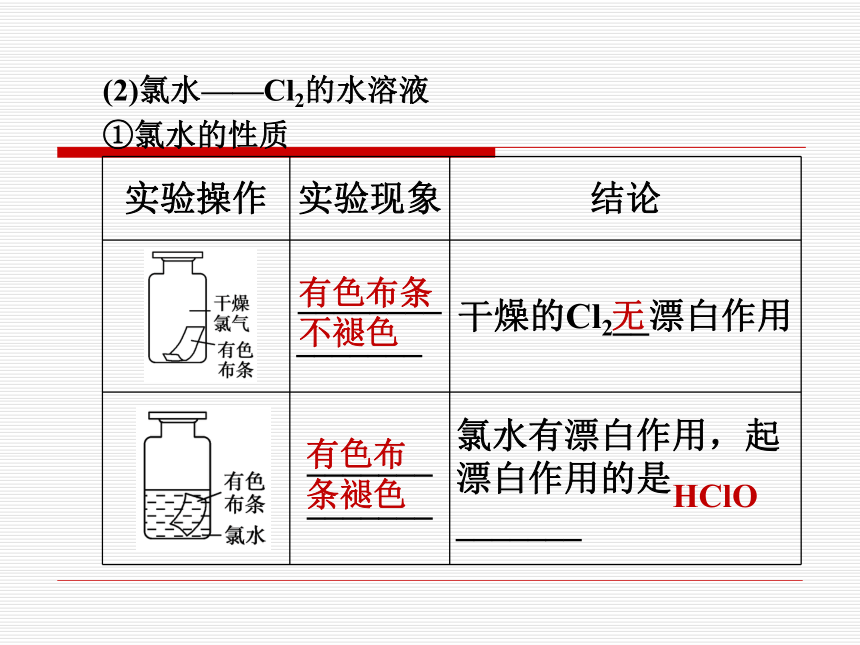
(2)氯水——Cl2的水溶液
①氯水的性质
实验操作 实验现象 结论
________
_______ 干燥的Cl2__漂白作用
_______ _______ 氯水有漂白作用,起 漂白作用的是_______
有色布条 不褪色
有色布 条褪色
无
HClO
②次氯酸的性质
(3)漂白剂的制取
①漂白液:反应的化学方程式为:_____________ _______________________,有效成分是_______。
②漂白粉:反应的化学方程式为: _________________________________________, 主要成分是_______________,有效成分是________。
Cl2+2NaOH
===NaCl+NaClO+H2O
NaClO
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO) 2
1.氯水及液氯的区别
液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、H2O
分类 纯净物 混合物 混合物
颜色 黄绿色 黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
保存 特制钢瓶 棕色瓶盛装,放阴凉处,一般现用现配
2.新制氯水的性质
在不同的反应中,氯水起作用的成分不同,现列表如下:
1.下列关于氯水的叙述,正确的是(多选)( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水在密封无色玻璃瓶中放置数天后酸性将增强
答案: BD
1.方法:先加__________,再加稀_______。
2.现象:产生__________,加HNO3,沉淀 _______。
3.原理:___________________。
4.加稀硝酸的目的:排除_____等离子的干扰。
AgNO3溶液
HNO3
白色沉淀
不溶解
Ag++Cl-===AgCl↓
1.卤素单质的性质
2.卤素单质的水溶液
溴和碘在不同溶剂中所得溶液(由稀至浓)的颜色变化:
水 汽油(苯) 四氯化碳
溴 黄至橙色 橙至橙红 橙至橙红
碘 黄至褐色 淡紫至紫红 紫至深紫
2.已知某溶液中Cl-、Br-、I-的离子数之比为1∶2∶3,要使溶液中Cl-、Br-、I-的离子数之比变为3∶2∶1,则通入Cl2的分子数与原溶液中I-离子数之比为( )
A.1∶2 B.1∶3
C.2∶1 D.3∶1
解析: 由溶液中Cl-、Br-、I-的离子数之比为1∶2∶3,变为溶液中Cl-、Br-、I-的离子数之比为3∶2∶1,及离子反应Cl2+2I-===2Cl-+I2看出,若原溶液含I-为3 mol,则通入Cl2 1 mol,氧化I- 2 mol后,符合题意,通入Cl2的分子数与原溶液中I-离子数之比为1∶3。
答案: B
(3)各装置的作用
①发生装置:A、B组成
②净化装置:C、D组成
③收集装置:E装置,利用向上排空气法收集。
④尾气处理装置:F装置,盛放NaOH溶液, 作用:吸收过量的Cl2,防止污染环境。
发生反应的离子方程式:Cl2+2OH-===Cl-+ClO-+H2O。
[温馨提示] (1)反应物中的盐酸一定要用浓盐酸,盐酸一旦变稀,反应将不再进行。
(2)氧化剂MnO2也可用其他氧化剂代替,如KMnO4、KClO3等。
解析: HCl中氯元素化合价升高,MnO2中锰元素化合价降低,所以HCl是还原剂,MnO2是氧化剂。生成Cl2时氯元素由-1价变成0价,所以生成1 mol Cl2,转移电子的物质的量为2 mol。从方程式可以看出,每消耗1 mol MnO2,同时消耗了4 mol HCl,其中只有2 mol的HCl起还原剂作用。由于浓盐酸易挥发,生成的Cl2中除含有水蒸气外,还含有HCl杂质。
答案: C
下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
解析: A中钠在氯气中燃烧,生成NaCl固体小颗粒,形成白烟,没有雾出现(雾为液态小液滴),A不正确。B中红热的铜丝在氯气中燃烧生成CuCl2固体小颗粒,生成棕黄色的烟,但没有雾,所以B也不正确。C中的说法完全符合实验事实,因此是正确答案。D中氯气用于漂白,这是对的,但起漂白作用的不是氯气本身,而是它与水反应后生成的次氯酸具有强氧化性,使有机色素氧化而褪色,D的说法不正确。
答案: C
[思考感悟] 氯元素是一种典型的非金属元素,其单质主要表现强氧化性,故氯气与金属或非金属单质反应时,常作氧化剂;但在与H2O或碱反应时,常表现为既具有氧化性又具有还原性。
1.下列说法不正确的是( )
A.氯气是黄绿色的有毒气体;氯离子是无色、无毒、比氯原子结构稳定的微粒
B.纯净的氢气可以在氯气中燃烧,产生苍白色火焰并在瓶口产生大量白烟
C.磷可以在氯气中燃烧产生大量白烟
D.铜和铁在氯气中燃烧都会生成棕黄色烟
解析: A、C、D都正确;B中在瓶口产生白雾。
答案: B
新制氯水与久置的氯水相比较,下列结论不正确的是( )
A.颜色不相同
B.都能使有色布条褪色
C.都含有H+
D.加AgNO3溶液都能生成白色沉淀
解析: 新制氯水中含Cl2、HCl和HClO,因为HClO不稳定,长久放置易分解生成HCl和O2,故久置氯水实际为HCl溶液,新制氯水为黄绿色,久置氯水无色,二者都呈酸性,都含有H+和Cl-,都能与AgNO3溶液反应生成AgCl白色沉淀,故A、C、D项正确;因久置氯水中不含HClO,不能使有色布条褪色,B项错。
答案: B
[思考感悟] 氯水的成分比较复杂,新制氯水中含有Cl2、HClO、H2O等分子,含有Cl-、H+、ClO-、OH-等离子,成分的多样性决定了性质的多样性。
2.氯气之所以长期用于自来水消毒,原因是
( )
①氯气有毒,可以毒死细菌、病毒 ②氯气具有刺激性气味,可以熏死细菌、病毒 ③氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 ④氯气用于自来水消毒的工艺简单、成熟,易于操作,且成本低
A.①③ B.②③
C.②④ D.③④
解析: 氯气有毒,之所以用其进行自来水消毒,不是用它毒死或熏死细菌、病毒,那样对人体也有害。因为氯气用于自来水消毒工艺简单,易于操作(只需将少量氯气通入水中即可)。溶于水的部分氯气会与水作用:Cl2+H2O===HCl+HClO,生成具有强氧化性的HClO会杀死细菌、病毒。
答案: D
试回答下列问题:
(1)反应氧化剂是________,还原剂是________。
(2)写出该反应的离子方程式________________________________________________________________________。
(3)小烧杯中盛放的是____________,其作用是______________________。
(4)一次实验中,用浓盐酸100 mL,其密度为1.19 g·cm-3。HCl的质量分数为36.5%,跟一定量MnO2反应,产生了5.6 L(标准状况)的氯气。那么浓盐酸的物质的量浓度为______,被氧化的HCl的物质的量为________。
解析: (1)根据反应原理可知该反应中氯元素的化合价由-1→0价,被氧化,HCl为还原剂;锰元素化合价由+4→+2价,被还原,MnO2为氧化剂。
(3)根据装置图可知,小烧杯为尾气吸收装置,吸收剩余Cl2,应装入NaOH溶液。
[思考感悟] 气体的制备装置一般包括反应装置、除杂装置、收集装置、尾气处理装置等。反应装置的选择要依据反应物的状态和反应的条件。收集方法的选择应考虑气体密度、溶解性及在空气中的稳定性。是否处理尾气,要取决于该气体是否有毒。一个装置的选择实际上与气体的性质密切相关。
3.在制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在圆底烧瓶中加入二氧化锰粉末 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中 ⑤将多余的Cl2用NaOH溶液吸收 ⑥用向上排空气法收集氯气
A.①②③④⑤⑥ B.③④②①⑥⑤
C.①④③②⑥⑤ D.①③④②⑥⑤
解析: 确定实验室制取气体的操作顺序要注意:①连接好装置后,要先检查气密性,后装药品;②装药品的顺序是先加固体,后加液体;③对于有毒的气体,一定要有尾气处理装置。
答案: D
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为__________________________________。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?
________(填“能”或“不能”,下同),理由是____________________________________
____________________。
(3)装置中能否省去盛浓硫酸的洗气瓶?________,理由是____________________。
(4)装置中能否省去盛冰水的烧杯?______,理由是______________________________
__________________________________。
答案: (1)Cl2+2OH-===Cl-+ClO-+H2O
(2)不能 氯气中混有的HCl气体进入大试管中也会和氢氧化钠溶液反应,降低了NaClO的产量和纯度
(3)能 少量水蒸气进入试管中不影响反应
(4)不能 氯气和水的反应是放热反应,反应时温度升高,可能引起副反应,生成NaClO3
1.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用排水集气法便可以收集到纯净的氯气
C.氯气有漂白性
D.自来水常用氯气来杀菌、消毒
解析: 氯气是有毒气体,闻氯气气味的时候,应该用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。用排水法收集Cl2会带出水蒸气,Cl2本身无漂白性,氯水漂白是HClO的作用。
答案: D
2.下列叙述正确的是( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.可以用氢氧化钙溶液吸收实验室制取氯气时多余的氯气
C.检验Cl2气体中是否混有HCl方法是将气体通入硝酸银溶液
D.除去Cl2气体中的HCl,可将气体通入饱和食盐水
解析: 氯气与氢气混合只有点燃或强光照射才会发生反应甚至爆炸,A项错误;由于氢氧化钙的溶解度比较小,所以实验室制取氯气时,多余的氯气不用氢氧化钙溶液吸收,而是用氢氧化钠溶液吸收,B项错误;Cl2溶于水也会产生Cl-,所以C项错误;HCl易溶于水,也易溶于饱和食盐水,而Cl2在饱和食盐水中的溶解度极小,D项正确。
答案: D
3.(2010·绍兴高一检测)用玻璃棒蘸取新制氯水点在pH试纸上,观察到的现象是( )
解析: 新制氯水中存在HCl(强酸)和HClO(弱酸),二者电离出H+使溶液显酸性,故试纸变为红色,后因HClO具有强氧化性又会使红色(中间部分)褪去,故B正确。
答案: B
4.有关漂白粉和漂白液的说法正确的是( )
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是Na2O2
解析: 漂白粉是将Cl2通入石灰乳中制得的混合物,反应方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,故其有效成分为Ca(ClO)2,漂白液的主要成分是NaClO,以上符合题意的只有B项。
答案: B
5.实验室制取氯气如下图,连接好实验装置。
(1)连接好装置后,先______________。
(2)向烧瓶里加入少量________粉末,分液漏斗中注入密度为1.19 g·cm-3的________,慢慢地将分液漏斗中的液体注入烧瓶。
(3)用________加热,氯气便能放出。
(4)A中盛放的是________________,其作用为________________________________________________________________________。
(5)B中盛放的是________,其作用为_________________________________。
(6)C的要求和作用是_________________________________。
(7)D中盛放的是____________,其作用为_________________________________。
(8)从中可以得出氯气的物理性质为_________________________________。
解析: 由制Cl2的反应特点确定气体发生装置,由杂质HCl、H2O的存在考虑用A、B净化装置,Cl2能溶于水,比空气重,确定了用长进短出排气法收集,而Cl2有毒应进行尾气处理。
答案: (1)检查气密性 (2)MnO2 浓盐酸 (3)酒精灯 (4)饱和NaCl溶液 吸收HCl (5)浓H2SO4 除水蒸气 (6)长进短出,收集Cl2 (7)NaOH溶液 吸收多余Cl2
(8)黄绿色气体,不溶于饱和NaCl溶液,比空气重
第二节 富集在海水中的元素——氯
2008年5月18日,湖北省襄樊老河口市消防大队“119”火警调度中心接到群众报警:仙人渡镇自来水厂装有500公斤液氯的钢瓶发生泄漏,请求消防官兵前往处置。
险情就是命令,消防队领导和队员与自来水公司领导成立临时抢险指挥部,制定处置方案,在装备器材缺乏的情况下成功处置了这起氯气泄漏事故,未造成人员中毒和死亡。液氯是危险化学品,一旦泄漏这种阴森森的黄绿色气体会使人窒息、双目失明,甚至死亡。氯气为什么毒性这么大?它具有怎样的性质和用途呢?
1.了解氯元素单质及其重要化合物的主要性质及应用。
2.了解实验室制取Cl2的原理和实验装置。
3.掌握Cl-的检验方法。
1.氯的原子结构及存在
(1)原子结构
原子结构示意图为__________ 错误,氯原子 容易_____________而形成Cl-,表现为典型 的_______。
得到一个电子
氧化性
(2)存在
氯在自然界中以_____态存在,主要以______的 形式存在。
2.氯气的发现
1774年瑞典化学家舍勒发现了氯气,反应的 化学方程式为:
________________________________________。
化合
NaCl
3.物理性质
颜色 状态 气味 毒性 溶解性
_______ ____ ______
_____ _____ 1体积水
溶解
__体积
氯气
黄绿色
气体
刺激性
气味
有毒
2
4.化学性质
Cl2的化学性质很活泼,具有很强的_____性。
(1)主要反应
氧化
(2)氯水——Cl2的水溶液
①氯水的性质
实验操作 实验现象 结论
________
_______ 干燥的Cl2__漂白作用
_______ _______ 氯水有漂白作用,起 漂白作用的是_______
有色布条 不褪色
有色布 条褪色
无
HClO
②次氯酸的性质
(3)漂白剂的制取
①漂白液:反应的化学方程式为:_____________ _______________________,有效成分是_______。
②漂白粉:反应的化学方程式为: _________________________________________, 主要成分是_______________,有效成分是________。
Cl2+2NaOH
===NaCl+NaClO+H2O
NaClO
2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O
CaCl2、Ca(ClO)2
Ca(ClO) 2
1.氯水及液氯的区别
液氯 新制氯水 久置氯水
成分 Cl2 Cl2、HClO、H2O、H+、Cl-、ClO-、OH- H+、Cl-、H2O
分类 纯净物 混合物 混合物
颜色 黄绿色 黄绿色 无色
性质 氧化性 酸性、氧化性、漂白性 酸性
保存 特制钢瓶 棕色瓶盛装,放阴凉处,一般现用现配
2.新制氯水的性质
在不同的反应中,氯水起作用的成分不同,现列表如下:
1.下列关于氯水的叙述,正确的是(多选)( )
A.新制氯水中只含Cl2和H2O分子
B.新制氯水可使蓝色石蕊试纸先变红后褪色
C.光照氯水有气泡逸出,该气体是Cl2
D.氯水在密封无色玻璃瓶中放置数天后酸性将增强
答案: BD
1.方法:先加__________,再加稀_______。
2.现象:产生__________,加HNO3,沉淀 _______。
3.原理:___________________。
4.加稀硝酸的目的:排除_____等离子的干扰。
AgNO3溶液
HNO3
白色沉淀
不溶解
Ag++Cl-===AgCl↓
1.卤素单质的性质
2.卤素单质的水溶液
溴和碘在不同溶剂中所得溶液(由稀至浓)的颜色变化:
水 汽油(苯) 四氯化碳
溴 黄至橙色 橙至橙红 橙至橙红
碘 黄至褐色 淡紫至紫红 紫至深紫
2.已知某溶液中Cl-、Br-、I-的离子数之比为1∶2∶3,要使溶液中Cl-、Br-、I-的离子数之比变为3∶2∶1,则通入Cl2的分子数与原溶液中I-离子数之比为( )
A.1∶2 B.1∶3
C.2∶1 D.3∶1
解析: 由溶液中Cl-、Br-、I-的离子数之比为1∶2∶3,变为溶液中Cl-、Br-、I-的离子数之比为3∶2∶1,及离子反应Cl2+2I-===2Cl-+I2看出,若原溶液含I-为3 mol,则通入Cl2 1 mol,氧化I- 2 mol后,符合题意,通入Cl2的分子数与原溶液中I-离子数之比为1∶3。
答案: B
(3)各装置的作用
①发生装置:A、B组成
②净化装置:C、D组成
③收集装置:E装置,利用向上排空气法收集。
④尾气处理装置:F装置,盛放NaOH溶液, 作用:吸收过量的Cl2,防止污染环境。
发生反应的离子方程式:Cl2+2OH-===Cl-+ClO-+H2O。
[温馨提示] (1)反应物中的盐酸一定要用浓盐酸,盐酸一旦变稀,反应将不再进行。
(2)氧化剂MnO2也可用其他氧化剂代替,如KMnO4、KClO3等。
解析: HCl中氯元素化合价升高,MnO2中锰元素化合价降低,所以HCl是还原剂,MnO2是氧化剂。生成Cl2时氯元素由-1价变成0价,所以生成1 mol Cl2,转移电子的物质的量为2 mol。从方程式可以看出,每消耗1 mol MnO2,同时消耗了4 mol HCl,其中只有2 mol的HCl起还原剂作用。由于浓盐酸易挥发,生成的Cl2中除含有水蒸气外,还含有HCl杂质。
答案: C
下列关于氯气的叙述正确的是( )
A.钠在氯气中燃烧产生白色烟雾
B.红热的铜丝可以在氯气中燃烧,产生棕黄色烟雾
C.纯净的氢气可以在氯气中安静地燃烧,发出苍白色火焰
D.氯气可用于漂白,这是氯气的漂白作用
解析: A中钠在氯气中燃烧,生成NaCl固体小颗粒,形成白烟,没有雾出现(雾为液态小液滴),A不正确。B中红热的铜丝在氯气中燃烧生成CuCl2固体小颗粒,生成棕黄色的烟,但没有雾,所以B也不正确。C中的说法完全符合实验事实,因此是正确答案。D中氯气用于漂白,这是对的,但起漂白作用的不是氯气本身,而是它与水反应后生成的次氯酸具有强氧化性,使有机色素氧化而褪色,D的说法不正确。
答案: C
[思考感悟] 氯元素是一种典型的非金属元素,其单质主要表现强氧化性,故氯气与金属或非金属单质反应时,常作氧化剂;但在与H2O或碱反应时,常表现为既具有氧化性又具有还原性。
1.下列说法不正确的是( )
A.氯气是黄绿色的有毒气体;氯离子是无色、无毒、比氯原子结构稳定的微粒
B.纯净的氢气可以在氯气中燃烧,产生苍白色火焰并在瓶口产生大量白烟
C.磷可以在氯气中燃烧产生大量白烟
D.铜和铁在氯气中燃烧都会生成棕黄色烟
解析: A、C、D都正确;B中在瓶口产生白雾。
答案: B
新制氯水与久置的氯水相比较,下列结论不正确的是( )
A.颜色不相同
B.都能使有色布条褪色
C.都含有H+
D.加AgNO3溶液都能生成白色沉淀
解析: 新制氯水中含Cl2、HCl和HClO,因为HClO不稳定,长久放置易分解生成HCl和O2,故久置氯水实际为HCl溶液,新制氯水为黄绿色,久置氯水无色,二者都呈酸性,都含有H+和Cl-,都能与AgNO3溶液反应生成AgCl白色沉淀,故A、C、D项正确;因久置氯水中不含HClO,不能使有色布条褪色,B项错。
答案: B
[思考感悟] 氯水的成分比较复杂,新制氯水中含有Cl2、HClO、H2O等分子,含有Cl-、H+、ClO-、OH-等离子,成分的多样性决定了性质的多样性。
2.氯气之所以长期用于自来水消毒,原因是
( )
①氯气有毒,可以毒死细菌、病毒 ②氯气具有刺激性气味,可以熏死细菌、病毒 ③氯气与水反应生成具有强氧化性的HClO,可以杀死细菌、病毒 ④氯气用于自来水消毒的工艺简单、成熟,易于操作,且成本低
A.①③ B.②③
C.②④ D.③④
解析: 氯气有毒,之所以用其进行自来水消毒,不是用它毒死或熏死细菌、病毒,那样对人体也有害。因为氯气用于自来水消毒工艺简单,易于操作(只需将少量氯气通入水中即可)。溶于水的部分氯气会与水作用:Cl2+H2O===HCl+HClO,生成具有强氧化性的HClO会杀死细菌、病毒。
答案: D
试回答下列问题:
(1)反应氧化剂是________,还原剂是________。
(2)写出该反应的离子方程式________________________________________________________________________。
(3)小烧杯中盛放的是____________,其作用是______________________。
(4)一次实验中,用浓盐酸100 mL,其密度为1.19 g·cm-3。HCl的质量分数为36.5%,跟一定量MnO2反应,产生了5.6 L(标准状况)的氯气。那么浓盐酸的物质的量浓度为______,被氧化的HCl的物质的量为________。
解析: (1)根据反应原理可知该反应中氯元素的化合价由-1→0价,被氧化,HCl为还原剂;锰元素化合价由+4→+2价,被还原,MnO2为氧化剂。
(3)根据装置图可知,小烧杯为尾气吸收装置,吸收剩余Cl2,应装入NaOH溶液。
[思考感悟] 气体的制备装置一般包括反应装置、除杂装置、收集装置、尾气处理装置等。反应装置的选择要依据反应物的状态和反应的条件。收集方法的选择应考虑气体密度、溶解性及在空气中的稳定性。是否处理尾气,要取决于该气体是否有毒。一个装置的选择实际上与气体的性质密切相关。
3.在制氯气时有如下操作,操作顺序正确的是( )
①连接好装置,检查气密性 ②缓缓加热,加快反应,使气体均匀逸出 ③在圆底烧瓶中加入二氧化锰粉末 ④从盛有浓盐酸的分液漏斗中将浓盐酸缓缓滴入烧瓶中 ⑤将多余的Cl2用NaOH溶液吸收 ⑥用向上排空气法收集氯气
A.①②③④⑤⑥ B.③④②①⑥⑤
C.①④③②⑥⑤ D.①③④②⑥⑤
解析: 确定实验室制取气体的操作顺序要注意:①连接好装置后,要先检查气密性,后装药品;②装药品的顺序是先加固体,后加液体;③对于有毒的气体,一定要有尾气处理装置。
答案: D
回答下列问题:
(1)装置中的大试管内发生反应的离子方程式为__________________________________。
(2)装置中能否省去盛饱和NaCl溶液的洗气瓶?
________(填“能”或“不能”,下同),理由是____________________________________
____________________。
(3)装置中能否省去盛浓硫酸的洗气瓶?________,理由是____________________。
(4)装置中能否省去盛冰水的烧杯?______,理由是______________________________
__________________________________。
答案: (1)Cl2+2OH-===Cl-+ClO-+H2O
(2)不能 氯气中混有的HCl气体进入大试管中也会和氢氧化钠溶液反应,降低了NaClO的产量和纯度
(3)能 少量水蒸气进入试管中不影响反应
(4)不能 氯气和水的反应是放热反应,反应时温度升高,可能引起副反应,生成NaClO3
1.下列说法中正确的是( )
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用排水集气法便可以收集到纯净的氯气
C.氯气有漂白性
D.自来水常用氯气来杀菌、消毒
解析: 氯气是有毒气体,闻氯气气味的时候,应该用手轻轻地在瓶口扇动,使极少量的氯气飘进鼻孔。用排水法收集Cl2会带出水蒸气,Cl2本身无漂白性,氯水漂白是HClO的作用。
答案: D
2.下列叙述正确的是( )
A.氯气的性质很活泼,它与氢气混合后立即发生爆炸
B.可以用氢氧化钙溶液吸收实验室制取氯气时多余的氯气
C.检验Cl2气体中是否混有HCl方法是将气体通入硝酸银溶液
D.除去Cl2气体中的HCl,可将气体通入饱和食盐水
解析: 氯气与氢气混合只有点燃或强光照射才会发生反应甚至爆炸,A项错误;由于氢氧化钙的溶解度比较小,所以实验室制取氯气时,多余的氯气不用氢氧化钙溶液吸收,而是用氢氧化钠溶液吸收,B项错误;Cl2溶于水也会产生Cl-,所以C项错误;HCl易溶于水,也易溶于饱和食盐水,而Cl2在饱和食盐水中的溶解度极小,D项正确。
答案: D
3.(2010·绍兴高一检测)用玻璃棒蘸取新制氯水点在pH试纸上,观察到的现象是( )
解析: 新制氯水中存在HCl(强酸)和HClO(弱酸),二者电离出H+使溶液显酸性,故试纸变为红色,后因HClO具有强氧化性又会使红色(中间部分)褪去,故B正确。
答案: B
4.有关漂白粉和漂白液的说法正确的是( )
A.漂白粉是纯净物,漂白液是混合物
B.漂白粉的有效成分是Ca(ClO)2
C.工业上将氯气通入澄清石灰水制取漂白粉
D.漂白液的有效成分是Na2O2
解析: 漂白粉是将Cl2通入石灰乳中制得的混合物,反应方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O,故其有效成分为Ca(ClO)2,漂白液的主要成分是NaClO,以上符合题意的只有B项。
答案: B
5.实验室制取氯气如下图,连接好实验装置。
(1)连接好装置后,先______________。
(2)向烧瓶里加入少量________粉末,分液漏斗中注入密度为1.19 g·cm-3的________,慢慢地将分液漏斗中的液体注入烧瓶。
(3)用________加热,氯气便能放出。
(4)A中盛放的是________________,其作用为________________________________________________________________________。
(5)B中盛放的是________,其作用为_________________________________。
(6)C的要求和作用是_________________________________。
(7)D中盛放的是____________,其作用为_________________________________。
(8)从中可以得出氯气的物理性质为_________________________________。
解析: 由制Cl2的反应特点确定气体发生装置,由杂质HCl、H2O的存在考虑用A、B净化装置,Cl2能溶于水,比空气重,确定了用长进短出排气法收集,而Cl2有毒应进行尾气处理。
答案: (1)检查气密性 (2)MnO2 浓盐酸 (3)酒精灯 (4)饱和NaCl溶液 吸收HCl (5)浓H2SO4 除水蒸气 (6)长进短出,收集Cl2 (7)NaOH溶液 吸收多余Cl2
(8)黄绿色气体,不溶于饱和NaCl溶液,比空气重
