4.4.2 硫酸和硝酸的氧化性(人教版必修1)
文档属性
| 名称 | 4.4.2 硫酸和硝酸的氧化性(人教版必修1) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 12:20:22 | ||
图片预览










文档简介
(共57张PPT)
第2课时 硫酸和硝酸的氧化性
老师说,浓硫酸、浓硝酸、浓盐酸就在这三瓶中,到底怎么区分啊?
1.了解浓硫酸的强氧化性。
2.了解浓、稀硝酸的氧化性。
3.了解硫酸和硝酸的重要用途。
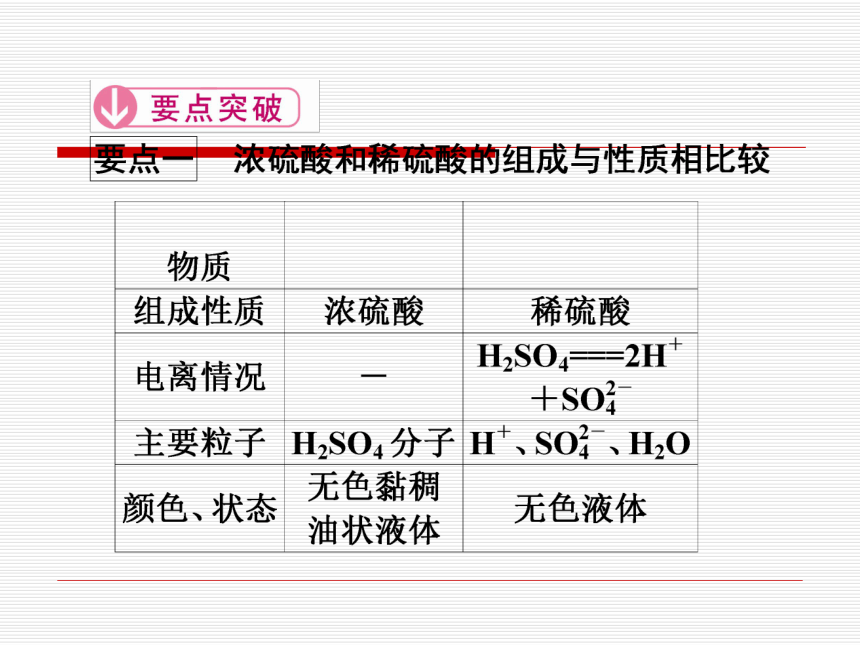
1.酸的通性
(1)电离方程式为:__________________。 (2)硫酸具有酸的通性可与__________作用, 也可与__________________________及某些盐 反应。
酸碱指示剂
H2SO4===2H++SO
活泼金属、碱、碱性氧化物
2.浓硫酸的特性
(1)吸水性:浓H2SO4能够吸收气体、液体中 的水分子及固体中的结晶水,故常用作______。
(2)脱水性:浓H2SO4能把有机物中的_______元 素按__________脱去,剩余黑色的炭。
(3)强氧化性
①与金属的反应:除_______以外的绝大多数金 属都能与浓H2SO4作用,如与铜反应。
干燥剂
氢、氧
水的组成比
Au、Pt
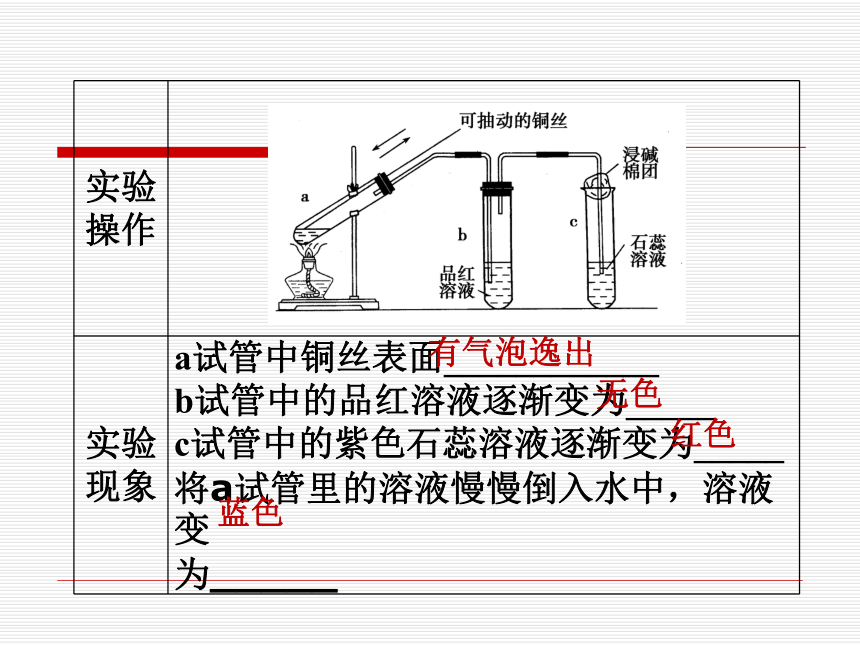
实验操作
实验现象 a试管中铜丝表面____________
b试管中的品红溶液逐渐变为_____
c试管中的紫色石蕊溶液逐渐变为_____
将a试管里的溶液慢慢倒入水中,溶液变 为_____
有气泡逸出
无色
红色
蓝色
实验结论 Cu和浓H2SO4反应的化学方程式为: __________________________________
②常温下,冷的浓H2SO4能使Fe、Al发生____。
③与非金属反应
加热时与木炭反应的化学方程式为: _____________________________________。
钝化
与Fe、Al的反应情况 常温下将Al、Fe钝化,加热时能继续氧化 发生置换反应
氧化性的强弱情况 氧化性强 氧化性弱
[温馨提示] 足量的活泼金属Zn与浓H2SO4反应时,开始阶段浓H2SO4体现其强氧化性,产生SO2气体,随着反应的进行浓硫酸变为稀H2SO4时,Zn与稀H2SO4反应产生H2。
1.鉴别稀硫酸和浓硫酸最简单的方法是
( )
A.加酚酞试液
B.与铜片反应
C.加BaCl2溶液和硝酸
D.用玻璃棒各蘸一点滴在纸上
解析: 稀硫酸和浓硫酸都不能使酚酞试液变色,与BaCl2溶液和硝酸反应都生成白色沉淀,故A、C两项不正确;稀硫酸与铜片不反应,浓硫酸与铜片加热时可反应,但不符合“简单”的要求,故B项也不正确;用玻璃棒各蘸一点滴在纸上,稀硫酸无明显变化,浓硫酸很快使纸变黑,该法最简单,故D项正确。
答案: D
1.硝酸
硝酸是一元强酸,具有酸的通性,但硝酸与 金属反应一般不产生___。
(1)强氧化性
①与金属的反应
浓HNO3与Cu反应的化学方程式为: ________________________________________。
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
H2
稀HNO3与Cu反应的化学方程式为: __________________________________________。
②与非金属反应
浓HNO3与木炭加热时的化学方程式为:
________________________________________。
③常温下,冷的浓硝酸能使_______钝化。
8HNO3(稀)+3Cu===3Cu(NO3)2+2NO2↑+2H2O
铁、铝
④王水是______和_______的混合物,体积比 为_____,能使不溶于硝酸的金、铂等溶解。
(2)不稳定性
浓硝酸在受热或光照条件下易分解,反应方 程式为:
_________________________________,
生成的____又溶于HNO3,使HNO3常显黄色。
浓硝酸
浓盐酸
1∶3
NO2
2.硫酸和硝酸的用途
(1)硫酸和硝酸都是重要的________,也是化 学实验室里必备的重要试剂。工业上可用于 制_________________、染料、盐类等。
(2)硫酸还用于精炼_____、金属加工前的酸洗 及制取各种_______酸,做干燥剂等。
化工原料
化肥、农药、炸药
石油
挥发性
硝酸具有强氧化性是由于HNO3中的+5价氮元素有很强的得电子能力,在硝酸参与的氧化还原反应中,几乎全部是+5价氮被还原。
1.表现
(1)浓硝酸能使紫色石蕊试液先变红,后褪色。
(2)与非金属单质C、S、P等在加热条件下反应,非金属元素生成酸性氧化物。
如浓HNO3与木炭加热时的化学方程式为:
(3)金属与HNO3反应一般不生成H2,浓HNO3一般被还原为NO2,稀HNO3一般被还原为NO,极稀HNO3可被还原成NH3,生成NH4NO3。
(4)在利用HNO3的酸性时,要注意考虑它的强氧化性。如FeO与稀硝酸反应时的方程式应是3FeO+10HNO3(稀)===3Fe(NO3)3+NO↑+5H2O,而不是发生复分解反应生成Fe(NO3)2。
(5)硝酸与铁反应时,产物符合以下规律
(6)浓HNO3与过量Cu反应的情况
可利用电子守恒和氮原子守恒求解有关Cu、HNO3和混合气体之间的量的关系。
2.规律
(1)温度越高,硝酸越浓,其氧化性越强。
(2)与硝酸反应时,还原剂一般被氧化成最高价态。
[温馨提示] HNO3的强氧化性是考查的重点和热点,在有些题目中隐蔽性较强,在遇到NO时,应联想到是否可能考查HNO3的氧化性,然后分析溶液中是否含大量H+,若含大量H+则表现强氧化性,若在中性或碱性环境中不用考虑HNO3的强氧化性。
2.关于硝酸的说法正确的是( )
A.硝酸与金属反应时,主要是+5价的氮得电子
B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水
C.硝酸电离出的H+能被Zn、Fe等金属还原成H2
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
答案: A
下列叙述正确的是( )
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
解析: 氨气能与浓H2SO4作用生成(NH4)2SO4,A错误;由S与浓H2SO4发生反应的方程式可知:浓H2SO4全部被还原为SO2,浓硫酸只表现出强氧化性,B错误;铜与浓H2SO4发生反应时,随着反应的进行,硫酸的浓度降低,而铜与稀H2SO4不发生反应,故产生的气体小于22.4 L,C错误。
答案: D
[思考感悟] 浓硫酸除具有酸的通性外,还具有“三大特性”:吸水性、脱水性和强氧化性。
解析: 判断某些酸在化学反应中是否表现了酸性,只要看该酸是否提供酸根离子生成了盐,如果生成了该酸对应的盐,则表现了酸性。而判断是否表现了强氧化性则需从中心原子的化合价是否降低的角度加以分析。A、B中硫元素的化合价不变,浓硫酸只表现出酸性;C中硫元素的化合价全部降低,浓硫酸只表现出强氧化性;而D中有一部分硫元素的化合价降低,一部分硫元素的化合价不变,所以浓硫酸在反应中既表现出酸性又表现出强氧化性。
答案: D
足量铜与一定浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
解析:
答案: A
[思考感悟] 金属与HNO3的反应运用“守恒法”求解,一般类型有:
(1)电子守恒
金属失电子数=生成气体时HNO3得电子数。
(2)物料守恒
消耗HNO3的量=盐中NO的量(表现酸性的HNO3)+气体中的N原子(被还原的HNO3)的量。
2.有某硫酸和硝酸的混合溶液20 mL,其中含有硫酸的浓度为2 mol·L-1,含有硝酸的浓度为1 mol·L-1,现向其中加入0.96 g 铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.89.6 mL B.112 mL
C.168 mL D.224 mL
解析: 铜粉溶解于稀硝酸的离子方程式为:
3Cu +8H++ 2NO===3Cu2++2NO↑+4H2O
0.015 mol 0.1 mol 0.02 mol
经比较可知Cu的量不足,所以可由Cu的量求得 生成NO为0.01 mol,即标准状况下气体的体积为 224 mL。
答案: D
热点实验 铜与浓硫酸的反应
[探究举例] 某化学兴趣小组为探究铜跟浓硫酸的反应,用图所示装置进行有关实验。请回答:
(1)装置A中发生反应的化学方程式为________________________________________________________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是________,其作用是________________________________________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是______________________________
__________________________。B中应放置的液体是________(填字母)。
a.水 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是____________________
________________________________。
1.(原创题)下列说法中,正确的是( )
A.浓硫酸稀释时,应将水沿器壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌
B.浓硫酸不分解,不挥发,所以可以敞口放置于空气中
C.浓硫酸具有氧化性,稀硫酸无氧化性
D.可以用铁罐或铝槽车来运输冷的浓硫酸
解析:A中,因浓硫酸稀释时放热,故应将浓硫酸向水中慢慢倒入并用玻璃棒不断搅拌;B中,浓硫酸易吸收空气中的水蒸气,导致浓度变稀;C中,稀硫酸可以电离出H+,而H+具有弱的氧化性,如Zn+H2SO4===ZnSO4+H2↑反应中,稀硫酸作氧化剂,D中,因Fe、Al遇冷的浓硫酸钝化,故D正确。
答案:D
2.下列关于硝酸的认识中,正确的是( )
A.浓硝酸和稀硝酸都具有氧化性
B.浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气
C.因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中
D.硝酸与金属反应时,只表现出氧化性
解析:浓、稀硝酸都有氧化性,可与除Au、Pt之外的所有金属反应,且不产生氢气;在与金属反应时,硝酸既表现氧化性又表现酸性;浓硝酸可盛放在铝制或铁制容器中,因为铝和铁在冷浓硝酸中钝化。
答案:A
3.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应生成气体的物质的量相等
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
解析: 由反应:Cu+4HNO3(浓)===Cu(NO3)2 +2NO2↑+2H2O 3Cu+8HNO3(稀)===3Cu(NO3)2 +2NO↑+4H2O可知:当铜质量相同,硝酸过量 时,生成气体的物质的量前者多,消耗n(HNO3) 前者多,反应中转移电子总数相等。
答案: B
答案: D
5.根据下图所示装置,回答下列问题。
(1)开始加热后,产生的现象是:a处______________;b处__________________。
(2)停止反应后,用酒精灯在b处微微加热,产生的现象是______________________________
_____________________________________。
(3)写出a处发生反应的化学方程式:_________________________________。
(4)蘸有Na2CO3溶液的棉花的作用是_________________________________。
解析:(1)浓H2SO4与铜片反应生成SO2气体,SO2能使品红褪色,生成的CuSO4使溶液变蓝色。
(2)被SO2漂白的品红试纸加热时会重新变红。
(4)SO2有毒,不能直接排放在空气中,用Na2CO3溶液可以吸收多余的SO2。
第2课时 硫酸和硝酸的氧化性
老师说,浓硫酸、浓硝酸、浓盐酸就在这三瓶中,到底怎么区分啊?
1.了解浓硫酸的强氧化性。
2.了解浓、稀硝酸的氧化性。
3.了解硫酸和硝酸的重要用途。
1.酸的通性
(1)电离方程式为:__________________。 (2)硫酸具有酸的通性可与__________作用, 也可与__________________________及某些盐 反应。
酸碱指示剂
H2SO4===2H++SO
活泼金属、碱、碱性氧化物
2.浓硫酸的特性
(1)吸水性:浓H2SO4能够吸收气体、液体中 的水分子及固体中的结晶水,故常用作______。
(2)脱水性:浓H2SO4能把有机物中的_______元 素按__________脱去,剩余黑色的炭。
(3)强氧化性
①与金属的反应:除_______以外的绝大多数金 属都能与浓H2SO4作用,如与铜反应。
干燥剂
氢、氧
水的组成比
Au、Pt
实验操作
实验现象 a试管中铜丝表面____________
b试管中的品红溶液逐渐变为_____
c试管中的紫色石蕊溶液逐渐变为_____
将a试管里的溶液慢慢倒入水中,溶液变 为_____
有气泡逸出
无色
红色
蓝色
实验结论 Cu和浓H2SO4反应的化学方程式为: __________________________________
②常温下,冷的浓H2SO4能使Fe、Al发生____。
③与非金属反应
加热时与木炭反应的化学方程式为: _____________________________________。
钝化
与Fe、Al的反应情况 常温下将Al、Fe钝化,加热时能继续氧化 发生置换反应
氧化性的强弱情况 氧化性强 氧化性弱
[温馨提示] 足量的活泼金属Zn与浓H2SO4反应时,开始阶段浓H2SO4体现其强氧化性,产生SO2气体,随着反应的进行浓硫酸变为稀H2SO4时,Zn与稀H2SO4反应产生H2。
1.鉴别稀硫酸和浓硫酸最简单的方法是
( )
A.加酚酞试液
B.与铜片反应
C.加BaCl2溶液和硝酸
D.用玻璃棒各蘸一点滴在纸上
解析: 稀硫酸和浓硫酸都不能使酚酞试液变色,与BaCl2溶液和硝酸反应都生成白色沉淀,故A、C两项不正确;稀硫酸与铜片不反应,浓硫酸与铜片加热时可反应,但不符合“简单”的要求,故B项也不正确;用玻璃棒各蘸一点滴在纸上,稀硫酸无明显变化,浓硫酸很快使纸变黑,该法最简单,故D项正确。
答案: D
1.硝酸
硝酸是一元强酸,具有酸的通性,但硝酸与 金属反应一般不产生___。
(1)强氧化性
①与金属的反应
浓HNO3与Cu反应的化学方程式为: ________________________________________。
4HNO3(浓)+Cu===Cu(NO3)2+2NO2↑+2H2O
H2
稀HNO3与Cu反应的化学方程式为: __________________________________________。
②与非金属反应
浓HNO3与木炭加热时的化学方程式为:
________________________________________。
③常温下,冷的浓硝酸能使_______钝化。
8HNO3(稀)+3Cu===3Cu(NO3)2+2NO2↑+2H2O
铁、铝
④王水是______和_______的混合物,体积比 为_____,能使不溶于硝酸的金、铂等溶解。
(2)不稳定性
浓硝酸在受热或光照条件下易分解,反应方 程式为:
_________________________________,
生成的____又溶于HNO3,使HNO3常显黄色。
浓硝酸
浓盐酸
1∶3
NO2
2.硫酸和硝酸的用途
(1)硫酸和硝酸都是重要的________,也是化 学实验室里必备的重要试剂。工业上可用于 制_________________、染料、盐类等。
(2)硫酸还用于精炼_____、金属加工前的酸洗 及制取各种_______酸,做干燥剂等。
化工原料
化肥、农药、炸药
石油
挥发性
硝酸具有强氧化性是由于HNO3中的+5价氮元素有很强的得电子能力,在硝酸参与的氧化还原反应中,几乎全部是+5价氮被还原。
1.表现
(1)浓硝酸能使紫色石蕊试液先变红,后褪色。
(2)与非金属单质C、S、P等在加热条件下反应,非金属元素生成酸性氧化物。
如浓HNO3与木炭加热时的化学方程式为:
(3)金属与HNO3反应一般不生成H2,浓HNO3一般被还原为NO2,稀HNO3一般被还原为NO,极稀HNO3可被还原成NH3,生成NH4NO3。
(4)在利用HNO3的酸性时,要注意考虑它的强氧化性。如FeO与稀硝酸反应时的方程式应是3FeO+10HNO3(稀)===3Fe(NO3)3+NO↑+5H2O,而不是发生复分解反应生成Fe(NO3)2。
(5)硝酸与铁反应时,产物符合以下规律
(6)浓HNO3与过量Cu反应的情况
可利用电子守恒和氮原子守恒求解有关Cu、HNO3和混合气体之间的量的关系。
2.规律
(1)温度越高,硝酸越浓,其氧化性越强。
(2)与硝酸反应时,还原剂一般被氧化成最高价态。
[温馨提示] HNO3的强氧化性是考查的重点和热点,在有些题目中隐蔽性较强,在遇到NO时,应联想到是否可能考查HNO3的氧化性,然后分析溶液中是否含大量H+,若含大量H+则表现强氧化性,若在中性或碱性环境中不用考虑HNO3的强氧化性。
2.关于硝酸的说法正确的是( )
A.硝酸与金属反应时,主要是+5价的氮得电子
B.浓HNO3与浓HCl按3∶1的体积比所得的混合物叫王水
C.硝酸电离出的H+能被Zn、Fe等金属还原成H2
D.常温下,向浓HNO3中投入Fe片,会产生大量的红棕色气体
答案: A
下列叙述正确的是( )
A.浓硫酸是一种干燥剂,能够干燥氢气、氧气、氨气等气体,但不能干燥有较强还原性的HI、H2S等气体
解析: 氨气能与浓H2SO4作用生成(NH4)2SO4,A错误;由S与浓H2SO4发生反应的方程式可知:浓H2SO4全部被还原为SO2,浓硫酸只表现出强氧化性,B错误;铜与浓H2SO4发生反应时,随着反应的进行,硫酸的浓度降低,而铜与稀H2SO4不发生反应,故产生的气体小于22.4 L,C错误。
答案: D
[思考感悟] 浓硫酸除具有酸的通性外,还具有“三大特性”:吸水性、脱水性和强氧化性。
解析: 判断某些酸在化学反应中是否表现了酸性,只要看该酸是否提供酸根离子生成了盐,如果生成了该酸对应的盐,则表现了酸性。而判断是否表现了强氧化性则需从中心原子的化合价是否降低的角度加以分析。A、B中硫元素的化合价不变,浓硫酸只表现出酸性;C中硫元素的化合价全部降低,浓硫酸只表现出强氧化性;而D中有一部分硫元素的化合价降低,一部分硫元素的化合价不变,所以浓硫酸在反应中既表现出酸性又表现出强氧化性。
答案: D
足量铜与一定浓硝酸反应,得到硝酸铜溶液和NO2、N2O4、NO的混合气体,这些气体与1.68 L O2(标准状况)混合后通入水中,所有气体完全被水吸收生成硝酸。若向所得硝酸铜溶液中加入5 mol·L-1NaOH溶液至Cu2+恰好完全沉淀,则消耗NaOH溶液的体积是( )
A.60 mL B.45 mL
C.30 mL D.15 mL
解析:
答案: A
[思考感悟] 金属与HNO3的反应运用“守恒法”求解,一般类型有:
(1)电子守恒
金属失电子数=生成气体时HNO3得电子数。
(2)物料守恒
消耗HNO3的量=盐中NO的量(表现酸性的HNO3)+气体中的N原子(被还原的HNO3)的量。
2.有某硫酸和硝酸的混合溶液20 mL,其中含有硫酸的浓度为2 mol·L-1,含有硝酸的浓度为1 mol·L-1,现向其中加入0.96 g 铜粉,充分反应后(假设只生成NO气体),最多可收集到标准状况下的气体的体积为( )
A.89.6 mL B.112 mL
C.168 mL D.224 mL
解析: 铜粉溶解于稀硝酸的离子方程式为:
3Cu +8H++ 2NO===3Cu2++2NO↑+4H2O
0.015 mol 0.1 mol 0.02 mol
经比较可知Cu的量不足,所以可由Cu的量求得 生成NO为0.01 mol,即标准状况下气体的体积为 224 mL。
答案: D
热点实验 铜与浓硫酸的反应
[探究举例] 某化学兴趣小组为探究铜跟浓硫酸的反应,用图所示装置进行有关实验。请回答:
(1)装置A中发生反应的化学方程式为________________________________________________________________________。
(2)装置D中试管口放置的棉花中应浸一种液体,这种液体是________,其作用是________________________________________________________________________。
(3)装置B的作用是贮存多余的气体。当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,此时B中现象是______________________________
__________________________。B中应放置的液体是________(填字母)。
a.水 b.酸性KMnO4溶液
c.浓溴水 d.饱和NaHSO3溶液
(4)实验中,取一定质量的铜片和一定体积18 mol·L-1浓硫酸放在圆底烧瓶中共热,直到反应完毕,发现烧瓶中还有铜片剩余,该小组学生根据所学的化学知识认为还有一定量的硫酸剩余,其原因是____________________
________________________________。
1.(原创题)下列说法中,正确的是( )
A.浓硫酸稀释时,应将水沿器壁慢慢倒入浓硫酸中,并不断用玻璃棒搅拌
B.浓硫酸不分解,不挥发,所以可以敞口放置于空气中
C.浓硫酸具有氧化性,稀硫酸无氧化性
D.可以用铁罐或铝槽车来运输冷的浓硫酸
解析:A中,因浓硫酸稀释时放热,故应将浓硫酸向水中慢慢倒入并用玻璃棒不断搅拌;B中,浓硫酸易吸收空气中的水蒸气,导致浓度变稀;C中,稀硫酸可以电离出H+,而H+具有弱的氧化性,如Zn+H2SO4===ZnSO4+H2↑反应中,稀硫酸作氧化剂,D中,因Fe、Al遇冷的浓硫酸钝化,故D正确。
答案:D
2.下列关于硝酸的认识中,正确的是( )
A.浓硝酸和稀硝酸都具有氧化性
B.浓硝酸与金属反应不产生氢气,而稀硝酸与金属反应可置换出氢气
C.因常温下铝和铁不与浓硝酸反应,所以浓硝酸可盛放在铝制或铁制容器中
D.硝酸与金属反应时,只表现出氧化性
解析:浓、稀硝酸都有氧化性,可与除Au、Pt之外的所有金属反应,且不产生氢气;在与金属反应时,硝酸既表现氧化性又表现酸性;浓硝酸可盛放在铝制或铁制容器中,因为铝和铁在冷浓硝酸中钝化。
答案:A
3.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述正确的是( )
A.反应生成气体的物质的量相等
B.消耗硝酸的物质的量:前者多,后者少
C.反应生成气体的颜色:前者浅,后者深
D.反应中转移的电子总数:前者多,后者少
解析: 由反应:Cu+4HNO3(浓)===Cu(NO3)2 +2NO2↑+2H2O 3Cu+8HNO3(稀)===3Cu(NO3)2 +2NO↑+4H2O可知:当铜质量相同,硝酸过量 时,生成气体的物质的量前者多,消耗n(HNO3) 前者多,反应中转移电子总数相等。
答案: B
答案: D
5.根据下图所示装置,回答下列问题。
(1)开始加热后,产生的现象是:a处______________;b处__________________。
(2)停止反应后,用酒精灯在b处微微加热,产生的现象是______________________________
_____________________________________。
(3)写出a处发生反应的化学方程式:_________________________________。
(4)蘸有Na2CO3溶液的棉花的作用是_________________________________。
解析:(1)浓H2SO4与铜片反应生成SO2气体,SO2能使品红褪色,生成的CuSO4使溶液变蓝色。
(2)被SO2漂白的品红试纸加热时会重新变红。
(4)SO2有毒,不能直接排放在空气中,用Na2CO3溶液可以吸收多余的SO2。
