2020-2021学年苏教版(2019)高一化学必修第二册9.1金属的冶炼方法 课时作业 (含解析)
文档属性
| 名称 | 2020-2021学年苏教版(2019)高一化学必修第二册9.1金属的冶炼方法 课时作业 (含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 310.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-30 08:16:00 | ||
图片预览




文档简介
专题9 金属与人类文明
课时作业 金属的冶炼方法
1.高温还原法冶炼金属的反应一定是( )
A.氧化还原反应 B.置换反应
C.复分解反应 D.分解反应
2.下列金属冶炼原理错误的是( )
A.2NaCl(熔融)2Na+Cl2↑
B.MgO+H2Mg+H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
3.工业上用电解熔融氧化铝的方法冶炼铝,而不用还原剂还原氧化铝的方法冶炼铝。下列相关说法正确的是( )
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
4.下列说法错误的是( )
A.对废旧金属的最好处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.高温还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等
5.工业上由含钒、铬和锰的矿物冶炼难熔的金属钒、铬和锰,通常采用的方法是( )
A.碳还原法
B.铝热法还原
C.直接加热法
D.盐的水溶液与活泼金属置换法
6.下列说法不正确的是( )
A.有些活泼金属,如铝可作高温还原法的还原剂
B.工业上在850 ℃下用金属钠与熔融的KCl来制取金属钾发生的是置换反应
C.可用氢气或一氧化碳还原氧化铝的方法来冶炼铝
D.分别用氢气和金属作还原剂冶炼金属,用氢气作还原剂时所得金属的纯度高
7.铝的活泼性较强,直到十八世纪人类才开始将Al从它的化合物中冶炼出来。当时铝价格十分昂贵,拿破仑的头盔就是用铝制作的,现在还保存在大英博物馆中,下列冶炼铝的方法正确的是( )
8.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是( )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO和Fe2O3
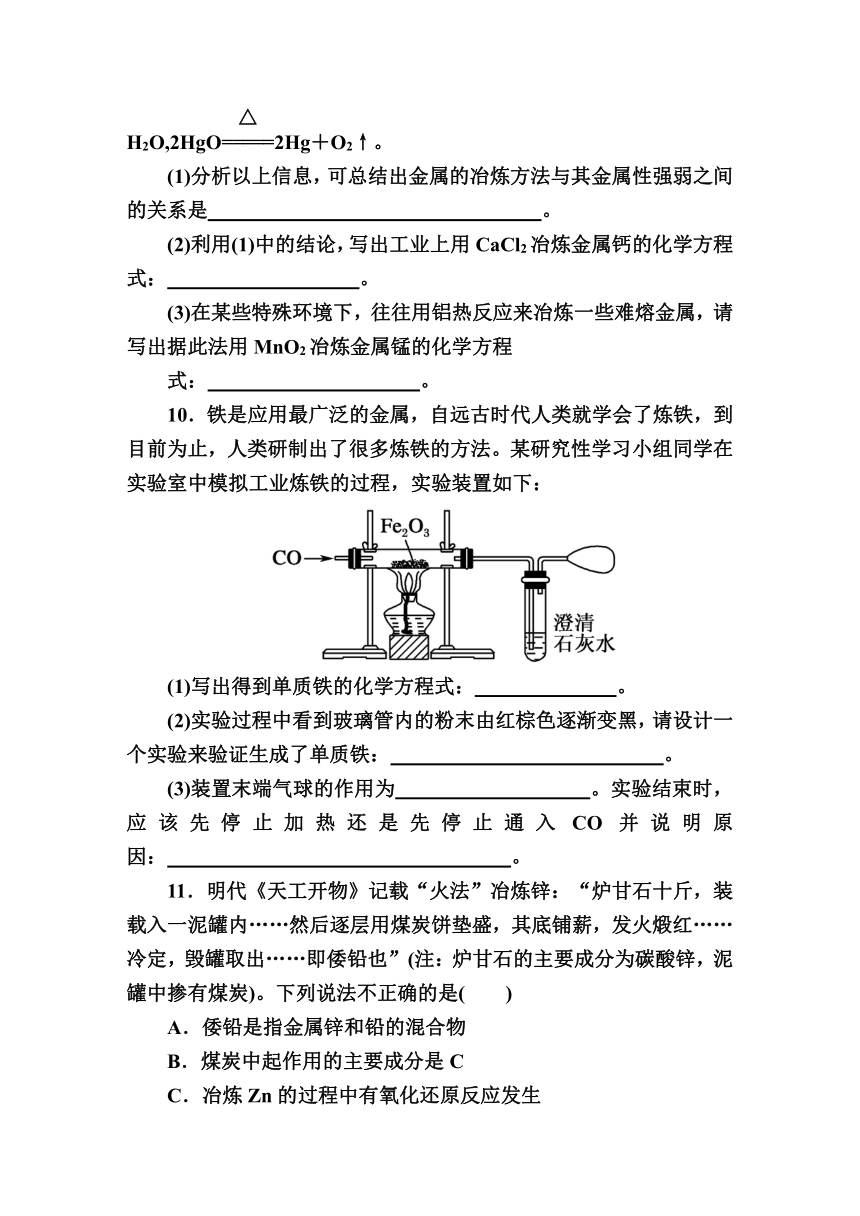
9.已知Al、Cu、Hg三种金属分别用如下方法冶炼:
2Al2O3(熔融)4Al+3O2↑,H2+CuOCu+
H2O,2HgO2Hg+O2↑。
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是 。
(2)利用(1)中的结论,写出工业上用CaCl2冶炼金属钙的化学方程式: 。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程
式: 。
10.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
(1)写出得到单质铁的化学方程式: 。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁: 。
(3)装置末端气球的作用为 。实验结束时,应该先停止加热还是先停止通入CO并说明原因: 。
11.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.冶炼Zn的过程中有氧化还原反应发生
D.该冶炼锌的方法属于高温还原法
12.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
C.由于钠、镁、铝等金属化学性质活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
13.下列说法正确的是( )
A.工业上通过电解氯化钠溶液制备金属钠和氯气
B.金属冶炼的本质是金属阳离子得到电子变成金属原子
C.工业上电解熔融状态的Al2O3制备Al不涉及氧化还原反应
D.MgCl2(aq)Mg(OH)2MgOMg
14.金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点/℃ 63.65 97.8 770 801
沸点/℃ 774 882.9 1 500(升华) 1 431
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1431~1 500 ℃
15.把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( )
A.3?8 B.8?3
C.3?4 D.4?3
16.用一定量的铁与足量的稀硫酸及足量的CuO制成单质铜,有人设计以下两种方案:
①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是( )
A.①多 B.②多
C.相等 D.无法判断
17.(双选)工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝。
下列说法正确的是( )
A.过程ⅰ说明氧化铝具有酸性氧化物的性质
B.过程ⅱ说明碳酸的酸性比氢氧化铝的酸性强
C.过程ⅲ发生的反应类型属于氧化还原反应
D.过程ⅳ也可以用加热法代替电解法冶炼铝
18.(双选)以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法不正确的是( )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中只作还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
19.电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,某研究性学习小组设计了如下提取流程图:
(1)固体Ⅱ的化学式为 。
(2)在实际工业生产流程⑤中需加入冰晶石,目的是 。
(3)写出流程③的离子方程式: 。
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应 。
(5)以上从铝土矿中提取铝的过程不涉及的化学反应类型是 (填字母)。
A.复分解反应 B.氧化还原反应
C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有 。
专题9 金属与人类文明
课时作业17 金属的冶炼方法
1.高温还原法冶炼金属的反应一定是( A )
A.氧化还原反应 B.置换反应
C.复分解反应 D.分解反应
解析:高温还原法冶炼金属的反应一定不是复分解反应,也一定不是分解反应,不一定是置换反应,如3CO+Fe2O32Fe+3CO2,但一定是氧化还原反应。
2.下列金属冶炼原理错误的是( B )
A.2NaCl(熔融)2Na+Cl2↑
B.MgO+H2Mg+H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
解析:Na、Mg通常用电解法制取,Fe用还原剂法制取,Hg可用加热其化合物的方法制取。Mg的活动性比H2强,H2不能置换出Mg,B项错误。
3.工业上用电解熔融氧化铝的方法冶炼铝,而不用还原剂还原氧化铝的方法冶炼铝。下列相关说法正确的是( C )
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
解析:氧化铝中铝元素为+3价,是其最高价,故只有氧化性,无还原性,A错误;Al3+氧化性弱,较难用还原剂还原氧化铝得到铝,B、D错误。
4.下列说法错误的是( C )
A.对废旧金属的最好处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.高温还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等
解析:活泼金属的冶炼是电解其熔融盐(如MgCl2、NaCl等)或熔融氧化物(如Al2O3等)制得的,电解AlCl3溶液得不到金属Al,C错误。
5.工业上由含钒、铬和锰的矿物冶炼难熔的金属钒、铬和锰,通常采用的方法是( B )
A.碳还原法
B.铝热法还原
C.直接加热法
D.盐的水溶液与活泼金属置换法
解析:冶炼难熔金属通常用铝热法。
6.下列说法不正确的是( C )
A.有些活泼金属,如铝可作高温还原法的还原剂
B.工业上在850 ℃下用金属钠与熔融的KCl来制取金属钾发生的是置换反应
C.可用氢气或一氧化碳还原氧化铝的方法来冶炼铝
D.分别用氢气和金属作还原剂冶炼金属,用氢气作还原剂时所得金属的纯度高
解析:铝可以作还原剂冶炼一些高熔点的金属,如Fe2O3+2AlAl2O3+2Fe,A项正确;工业上冶炼金属钾的反应为Na(l)+KCl(l)NaCl(l)+K(g),属于置换反应,B项正确;铝是活泼金属,很难用还原剂把它还原出来,应该用电解熔融Al2O3的方法制取,C项错;用还原法冶炼金属,还原剂可以是金属,也可以是H2、CO等还原性气体,二者比较而言,利用H2、CO等冶炼金属,只要充分反应就能得到较纯净的金属,D项正确。
7.铝的活泼性较强,直到十八世纪人类才开始将Al从它的化合物中冶炼出来。当时铝价格十分昂贵,拿破仑的头盔就是用铝制作的,现在还保存在大英博物馆中,下列冶炼铝的方法正确的是( A )
解析:H2、CO、C等皆不能将Al2O3或Al(OH)3还原为Al,C、D不正确。AlCl3是共价化合物,熔融后不导电,B不正确。
8.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是( B )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO和Fe2O3
解析:CO和铁的氧化物反应时,氧化物中的一个O原子对应一个CO2分子,每一个CO2分子对应一个CaCO3,所以有下列的关系式,假设0.4 g该氧化物中含x g O。
O ~ CO2 ~ CaCO3
16 100
x g 0.75 g
解得x=0.12
N(Fe)?N(O)=?=2?3。
9.已知Al、Cu、Hg三种金属分别用如下方法冶炼:
2Al2O3(熔融)4Al+3O2↑,H2+CuOCu+
H2O,2HgO2Hg+O2↑。
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是非常活泼的金属一般采用电解法冶炼,中等活泼的金属一般采用高温还原法冶炼,不活泼的金属一般采用热分解法冶炼。
(2)利用(1)中的结论,写出工业上用CaCl2冶炼金属钙的化学方程式:CaCl2(熔融)Ca+Cl2↑。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程
式:4Al+3MnO22Al2O3+3Mn。
解析:(1)金属的冶炼方法与金属在自然界中的存在状态、金属活泼性有关。一般来说,非常活泼的金属一般采用电解法冶炼(如K、Ca、Na、Mg、Al等),中等活泼的金属一般用高温还原法冶炼(如Zn、Fe、Sn、Pb、Cu等),不活泼的金属一般用热分解法冶炼(如Hg、Ag等)。(2)Ca是非常活泼的金属,工业上用电解熔融CaCl2的方法冶炼。(3)金属铝和MnO2发生置换反应生成单质锰和氧化铝。
10.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
(1)写出得到单质铁的化学方程式:Fe2O3+3CO2Fe+3CO2。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:取少量粉末放于试管中,加少量盐酸,若产生无色无味气体,则证明生成了单质铁。
(3)装置末端气球的作用为收集未反应的CO,防止污染空气。实验结束时,应该先停止加热还是先停止通入CO并说明原因:先停止加热,防止生成的铁再次被氧化。
解析:检验是否生成单质铁,在反应结束后,待玻璃管内的固体冷却,取少量放于试管中,加少量盐酸,若产生无色无味气体(H2),则证明生成了单质铁;反应结束后,得到的铁还是赤热的,若先停止通入CO,会导致铁又被氧化,所以,应该先停止加热,待玻璃管内的固体冷却后,再停止通入CO。
11.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( A )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.冶炼Zn的过程中有氧化还原反应发生
D.该冶炼锌的方法属于高温还原法
解析:A项,由题意可知,倭铅是指金属锌,不是混合物,错误;B项,反应中C作还原剂,则煤炭中起作用的主要成分是C,正确;C项,碳酸锌与碳在高温下反应生成锌和一氧化碳,有氧化还原反应发生,正确;D项,该反应是利用碳还原碳酸锌生成锌单质,属于高温还原法,正确。
12.不同的金属在冶炼方法上也有所不同,下列说法正确的是( D )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
C.由于钠、镁、铝等金属化学性质活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
解析:A项,铁用CO还原法炼制,错误;B项,因为Al有良好的性能,才被广泛使用,错误;C项,氯化铝是共价化合物,熔融时不导电,工业上用电解氧化铝的方法制取铝,错误;D项,高炉炼铁中焦炭的作用为与氧气反应产生热量和制造还原剂一氧化碳,正确。
13.下列说法正确的是( B )
A.工业上通过电解氯化钠溶液制备金属钠和氯气
B.金属冶炼的本质是金属阳离子得到电子变成金属原子
C.工业上电解熔融状态的Al2O3制备Al不涉及氧化还原反应
D.MgCl2(aq)Mg(OH)2MgOMg
解析:电解NaCl溶液生成NaOH、H2和Cl2,得不到单质钠,A错误;电解熔融Al2O3发生的是氧化还原反应,C错误;工业上冶炼镁是电解熔融MgCl2而不是MgO,D错误。
14.金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点/℃ 63.65 97.8 770 801
沸点/℃ 774 882.9 1 500(升华) 1 431
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( C )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1431~1 500 ℃
解析:在金属活动性顺序表中,Na排在K的后面,似乎不能从K的熔融盐中置换出K。但将Na与KCl共熔,其共熔体中Na+、K+、Cl-和e-自由移动,如果继续加热,则Na、K、NaCl和KCl先沸腾者先逸出。工业上,就是采用这种原理用Na还原K的,因为K的沸点比Na、NaCl、KCl的沸点都低,且低于NaCl的熔点。
15.把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( C )
A.3?8 B.8?3
C.3?4 D.4?3
解析:铝热剂分成两等份后,第一份在高温下恰好完全反应,8Al+3Fe3O49Fe+4Al2O3,然后将生成物与足量盐酸充分反应,只有Fe与盐酸反应产生气体,Fe+2HCl===FeCl2+H2↑,即关系式为8Al~9Fe~9H2;第二份直接加入足量的NaOH溶液使之充分反应,发生反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,则8Al~12H2,则前后两种情况下生成的气体在相同状况下的体积比为9?12=3?4。
16.用一定量的铁与足量的稀硫酸及足量的CuO制成单质铜,有人设计以下两种方案:
①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是( B )
A.①多 B.②多
C.相等 D.无法判断
解析:①中在H2还原CuO之前应先通入一段时间的H2,故②中制得的单质铜较多。
17.(双选)工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝。
下列说法正确的是( AB )
A.过程ⅰ说明氧化铝具有酸性氧化物的性质
B.过程ⅱ说明碳酸的酸性比氢氧化铝的酸性强
C.过程ⅲ发生的反应类型属于氧化还原反应
D.过程ⅳ也可以用加热法代替电解法冶炼铝
解析:Al2O3与NaOH(碱)反应生成NaAlO2(盐)与水,具有酸性氧化物的性质,A正确;过量CO2与NaAlO2生成Al(OH)3固体,所以H2CO3的酸性强于Al(OH)3,B正确;Al(OH)3分解生成Al2O3和水,是非氧化还原反应,C错误;适合用电解法冶炼的金属为活泼金属,常见的有Na、Mg、Al等,Al是活泼金属不能用加热法,D错误。
18.(双选)以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法不正确的是( BC )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中只作还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
解析:分析反应中化合价的变化:2+22+2,反应过程中Cu、S、O三种元素的化合价均发生改变,A正确;Cu2S中Cu元素化合价降低,S元素化合价升高,因此Cu2S既是氧化剂又是还原剂,B错误;根据S元素化合价的改变可知,当1 mol O2参加反应时,共转移电子6 mol,C错误;SO2催化氧化可得SO3,SO3被水吸收可得H2SO4,D正确。
19.电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,某研究性学习小组设计了如下提取流程图:
(1)固体Ⅱ的化学式为Fe2O3。
(2)在实际工业生产流程⑤中需加入冰晶石,目的是降低Al2O3的熔化温度,减少能量消耗。
(3)写出流程③的离子方程式:AlO+CO2+2H2O===Al(OH)3↓+HCO。
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应放出大量的热量。
(5)以上从铝土矿中提取铝的过程不涉及的化学反应类型是C(填字母)。
A.复分解反应 B.氧化还原反应
C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有CO2、CaO。
课时作业 金属的冶炼方法
1.高温还原法冶炼金属的反应一定是( )
A.氧化还原反应 B.置换反应
C.复分解反应 D.分解反应
2.下列金属冶炼原理错误的是( )
A.2NaCl(熔融)2Na+Cl2↑
B.MgO+H2Mg+H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
3.工业上用电解熔融氧化铝的方法冶炼铝,而不用还原剂还原氧化铝的方法冶炼铝。下列相关说法正确的是( )
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
4.下列说法错误的是( )
A.对废旧金属的最好处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.高温还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等
5.工业上由含钒、铬和锰的矿物冶炼难熔的金属钒、铬和锰,通常采用的方法是( )
A.碳还原法
B.铝热法还原
C.直接加热法
D.盐的水溶液与活泼金属置换法
6.下列说法不正确的是( )
A.有些活泼金属,如铝可作高温还原法的还原剂
B.工业上在850 ℃下用金属钠与熔融的KCl来制取金属钾发生的是置换反应
C.可用氢气或一氧化碳还原氧化铝的方法来冶炼铝
D.分别用氢气和金属作还原剂冶炼金属,用氢气作还原剂时所得金属的纯度高
7.铝的活泼性较强,直到十八世纪人类才开始将Al从它的化合物中冶炼出来。当时铝价格十分昂贵,拿破仑的头盔就是用铝制作的,现在还保存在大英博物馆中,下列冶炼铝的方法正确的是( )
8.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是( )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO和Fe2O3
9.已知Al、Cu、Hg三种金属分别用如下方法冶炼:
2Al2O3(熔融)4Al+3O2↑,H2+CuOCu+
H2O,2HgO2Hg+O2↑。
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是 。
(2)利用(1)中的结论,写出工业上用CaCl2冶炼金属钙的化学方程式: 。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程
式: 。
10.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
(1)写出得到单质铁的化学方程式: 。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁: 。
(3)装置末端气球的作用为 。实验结束时,应该先停止加热还是先停止通入CO并说明原因: 。
11.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.冶炼Zn的过程中有氧化还原反应发生
D.该冶炼锌的方法属于高温还原法
12.不同的金属在冶炼方法上也有所不同,下列说法正确的是( )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
C.由于钠、镁、铝等金属化学性质活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
13.下列说法正确的是( )
A.工业上通过电解氯化钠溶液制备金属钠和氯气
B.金属冶炼的本质是金属阳离子得到电子变成金属原子
C.工业上电解熔融状态的Al2O3制备Al不涉及氧化还原反应
D.MgCl2(aq)Mg(OH)2MgOMg
14.金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点/℃ 63.65 97.8 770 801
沸点/℃ 774 882.9 1 500(升华) 1 431
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1431~1 500 ℃
15.把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( )
A.3?8 B.8?3
C.3?4 D.4?3
16.用一定量的铁与足量的稀硫酸及足量的CuO制成单质铜,有人设计以下两种方案:
①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是( )
A.①多 B.②多
C.相等 D.无法判断
17.(双选)工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝。
下列说法正确的是( )
A.过程ⅰ说明氧化铝具有酸性氧化物的性质
B.过程ⅱ说明碳酸的酸性比氢氧化铝的酸性强
C.过程ⅲ发生的反应类型属于氧化还原反应
D.过程ⅳ也可以用加热法代替电解法冶炼铝
18.(双选)以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法不正确的是( )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中只作还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
19.电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,某研究性学习小组设计了如下提取流程图:
(1)固体Ⅱ的化学式为 。
(2)在实际工业生产流程⑤中需加入冰晶石,目的是 。
(3)写出流程③的离子方程式: 。
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应 。
(5)以上从铝土矿中提取铝的过程不涉及的化学反应类型是 (填字母)。
A.复分解反应 B.氧化还原反应
C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有 。
专题9 金属与人类文明
课时作业17 金属的冶炼方法
1.高温还原法冶炼金属的反应一定是( A )
A.氧化还原反应 B.置换反应
C.复分解反应 D.分解反应
解析:高温还原法冶炼金属的反应一定不是复分解反应,也一定不是分解反应,不一定是置换反应,如3CO+Fe2O32Fe+3CO2,但一定是氧化还原反应。
2.下列金属冶炼原理错误的是( B )
A.2NaCl(熔融)2Na+Cl2↑
B.MgO+H2Mg+H2O
C.Fe3O4+4CO3Fe+4CO2
D.2HgO2Hg+O2↑
解析:Na、Mg通常用电解法制取,Fe用还原剂法制取,Hg可用加热其化合物的方法制取。Mg的活动性比H2强,H2不能置换出Mg,B项错误。
3.工业上用电解熔融氧化铝的方法冶炼铝,而不用还原剂还原氧化铝的方法冶炼铝。下列相关说法正确的是( C )
A.氧化铝中的铝元素为+3价,只有还原性,没有氧化性
B.加入冰晶石降低氧化铝的熔点,在熔融状态下易被还原
C.铝单质的还原性强,较难用还原剂还原氧化铝得到铝
D.铝离子的氧化性强,较难用还原剂还原氧化铝得到铝
解析:氧化铝中铝元素为+3价,是其最高价,故只有氧化性,无还原性,A错误;Al3+氧化性弱,较难用还原剂还原氧化铝得到铝,B、D错误。
4.下列说法错误的是( C )
A.对废旧金属的最好处理方法是回收、再利用
B.提炼金属要经过矿石的富集、冶炼、精炼三步
C.活泼金属的冶炼都是通过电解其盐溶液
D.高温还原法中还原剂有焦炭、一氧化碳、氢气和活泼金属等
解析:活泼金属的冶炼是电解其熔融盐(如MgCl2、NaCl等)或熔融氧化物(如Al2O3等)制得的,电解AlCl3溶液得不到金属Al,C错误。
5.工业上由含钒、铬和锰的矿物冶炼难熔的金属钒、铬和锰,通常采用的方法是( B )
A.碳还原法
B.铝热法还原
C.直接加热法
D.盐的水溶液与活泼金属置换法
解析:冶炼难熔金属通常用铝热法。
6.下列说法不正确的是( C )
A.有些活泼金属,如铝可作高温还原法的还原剂
B.工业上在850 ℃下用金属钠与熔融的KCl来制取金属钾发生的是置换反应
C.可用氢气或一氧化碳还原氧化铝的方法来冶炼铝
D.分别用氢气和金属作还原剂冶炼金属,用氢气作还原剂时所得金属的纯度高
解析:铝可以作还原剂冶炼一些高熔点的金属,如Fe2O3+2AlAl2O3+2Fe,A项正确;工业上冶炼金属钾的反应为Na(l)+KCl(l)NaCl(l)+K(g),属于置换反应,B项正确;铝是活泼金属,很难用还原剂把它还原出来,应该用电解熔融Al2O3的方法制取,C项错;用还原法冶炼金属,还原剂可以是金属,也可以是H2、CO等还原性气体,二者比较而言,利用H2、CO等冶炼金属,只要充分反应就能得到较纯净的金属,D项正确。
7.铝的活泼性较强,直到十八世纪人类才开始将Al从它的化合物中冶炼出来。当时铝价格十分昂贵,拿破仑的头盔就是用铝制作的,现在还保存在大英博物馆中,下列冶炼铝的方法正确的是( A )
解析:H2、CO、C等皆不能将Al2O3或Al(OH)3还原为Al,C、D不正确。AlCl3是共价化合物,熔融后不导电,B不正确。
8.有0.4 g铁的氧化物,用足量的CO在高温下将其还原,把生成的CO2全部通入足量澄清石灰水中,得到0.75 g沉淀。这种铁的氧化物的化学式是( B )
A.FeO B.Fe2O3
C.Fe3O4 D.FeO和Fe2O3
解析:CO和铁的氧化物反应时,氧化物中的一个O原子对应一个CO2分子,每一个CO2分子对应一个CaCO3,所以有下列的关系式,假设0.4 g该氧化物中含x g O。
O ~ CO2 ~ CaCO3
16 100
x g 0.75 g
解得x=0.12
N(Fe)?N(O)=?=2?3。
9.已知Al、Cu、Hg三种金属分别用如下方法冶炼:
2Al2O3(熔融)4Al+3O2↑,H2+CuOCu+
H2O,2HgO2Hg+O2↑。
(1)分析以上信息,可总结出金属的冶炼方法与其金属性强弱之间的关系是非常活泼的金属一般采用电解法冶炼,中等活泼的金属一般采用高温还原法冶炼,不活泼的金属一般采用热分解法冶炼。
(2)利用(1)中的结论,写出工业上用CaCl2冶炼金属钙的化学方程式:CaCl2(熔融)Ca+Cl2↑。
(3)在某些特殊环境下,往往用铝热反应来冶炼一些难熔金属,请写出据此法用MnO2冶炼金属锰的化学方程
式:4Al+3MnO22Al2O3+3Mn。
解析:(1)金属的冶炼方法与金属在自然界中的存在状态、金属活泼性有关。一般来说,非常活泼的金属一般采用电解法冶炼(如K、Ca、Na、Mg、Al等),中等活泼的金属一般用高温还原法冶炼(如Zn、Fe、Sn、Pb、Cu等),不活泼的金属一般用热分解法冶炼(如Hg、Ag等)。(2)Ca是非常活泼的金属,工业上用电解熔融CaCl2的方法冶炼。(3)金属铝和MnO2发生置换反应生成单质锰和氧化铝。
10.铁是应用最广泛的金属,自远古时代人类就学会了炼铁,到目前为止,人类研制出了很多炼铁的方法。某研究性学习小组同学在实验室中模拟工业炼铁的过程,实验装置如下:
(1)写出得到单质铁的化学方程式:Fe2O3+3CO2Fe+3CO2。
(2)实验过程中看到玻璃管内的粉末由红棕色逐渐变黑,请设计一个实验来验证生成了单质铁:取少量粉末放于试管中,加少量盐酸,若产生无色无味气体,则证明生成了单质铁。
(3)装置末端气球的作用为收集未反应的CO,防止污染空气。实验结束时,应该先停止加热还是先停止通入CO并说明原因:先停止加热,防止生成的铁再次被氧化。
解析:检验是否生成单质铁,在反应结束后,待玻璃管内的固体冷却,取少量放于试管中,加少量盐酸,若产生无色无味气体(H2),则证明生成了单质铁;反应结束后,得到的铁还是赤热的,若先停止通入CO,会导致铁又被氧化,所以,应该先停止加热,待玻璃管内的固体冷却后,再停止通入CO。
11.明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内……然后逐层用煤炭饼垫盛,其底铺薪,发火煅红……冷定,毁罐取出……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是( A )
A.倭铅是指金属锌和铅的混合物
B.煤炭中起作用的主要成分是C
C.冶炼Zn的过程中有氧化还原反应发生
D.该冶炼锌的方法属于高温还原法
解析:A项,由题意可知,倭铅是指金属锌,不是混合物,错误;B项,反应中C作还原剂,则煤炭中起作用的主要成分是C,正确;C项,碳酸锌与碳在高温下反应生成锌和一氧化碳,有氧化还原反应发生,正确;D项,该反应是利用碳还原碳酸锌生成锌单质,属于高温还原法,正确。
12.不同的金属在冶炼方法上也有所不同,下列说法正确的是( D )
A.钒、铬、锰、铁等难熔金属通常采用铝热法炼制
B.铝及其合金是电气、工业、家庭广泛使用的材料,是因为铝的冶炼方法比较简单
C.由于钠、镁、铝等金属化学性质活泼,人们通常采用电解熔融状态下的氯化物的方式来获取它们的单质
D.炼铁时加入的焦炭除了提供热量外,还用来制造还原剂一氧化碳
解析:A项,铁用CO还原法炼制,错误;B项,因为Al有良好的性能,才被广泛使用,错误;C项,氯化铝是共价化合物,熔融时不导电,工业上用电解氧化铝的方法制取铝,错误;D项,高炉炼铁中焦炭的作用为与氧气反应产生热量和制造还原剂一氧化碳,正确。
13.下列说法正确的是( B )
A.工业上通过电解氯化钠溶液制备金属钠和氯气
B.金属冶炼的本质是金属阳离子得到电子变成金属原子
C.工业上电解熔融状态的Al2O3制备Al不涉及氧化还原反应
D.MgCl2(aq)Mg(OH)2MgOMg
解析:电解NaCl溶液生成NaOH、H2和Cl2,得不到单质钠,A错误;电解熔融Al2O3发生的是氧化还原反应,C错误;工业上冶炼镁是电解熔融MgCl2而不是MgO,D错误。
14.金属K与Na金属性相近,用K与钠盐共熔时,很难将Na从混合物中分离。若调整温度到一定程度,则可用Na与KCl反应制取金属K。已知四种物质的熔、沸点如下:
K Na KCl NaCl
熔点/℃ 63.65 97.8 770 801
沸点/℃ 774 882.9 1 500(升华) 1 431
根据平衡移动原理可推知,用Na与KCl反应制K的适宜温度是( C )
A.97.8~770 ℃ B.770~774 ℃
C.774~882.9 ℃ D.1431~1 500 ℃
解析:在金属活动性顺序表中,Na排在K的后面,似乎不能从K的熔融盐中置换出K。但将Na与KCl共熔,其共熔体中Na+、K+、Cl-和e-自由移动,如果继续加热,则Na、K、NaCl和KCl先沸腾者先逸出。工业上,就是采用这种原理用Na还原K的,因为K的沸点比Na、NaCl、KCl的沸点都低,且低于NaCl的熔点。
15.把铝粉和Fe3O4粉末配成铝热剂并分成两等份,第一份在高温下恰好完全反应,然后将生成物与足量盐酸充分反应,第二份直接加入足量的氢氧化钠溶液使之充分反应,前后两种情况下生成的气体在相同状况下的体积比是( C )
A.3?8 B.8?3
C.3?4 D.4?3
解析:铝热剂分成两等份后,第一份在高温下恰好完全反应,8Al+3Fe3O49Fe+4Al2O3,然后将生成物与足量盐酸充分反应,只有Fe与盐酸反应产生气体,Fe+2HCl===FeCl2+H2↑,即关系式为8Al~9Fe~9H2;第二份直接加入足量的NaOH溶液使之充分反应,发生反应为2Al+2NaOH+2H2O===2NaAlO2+3H2↑,则8Al~12H2,则前后两种情况下生成的气体在相同状况下的体积比为9?12=3?4。
16.用一定量的铁与足量的稀硫酸及足量的CuO制成单质铜,有人设计以下两种方案:
①FeH2Cu ②CuOCuSO4Cu
若按实验原则进行操作,则两者制得单质铜的量的比较中,正确的是( B )
A.①多 B.②多
C.相等 D.无法判断
解析:①中在H2还原CuO之前应先通入一段时间的H2,故②中制得的单质铜较多。
17.(双选)工业上以铝土矿(主要成分Al2O3·3H2O)为原料生产铝,主要包括下列过程:
ⅰ.将粉碎、筛选、湿磨后的铝土矿浸泡在氢氧化钠溶液中,过滤;
ⅱ.通入过量二氧化碳使ⅰ所得滤液中析出氢氧化铝固体,过滤;
ⅲ.使ⅱ中所得氢氧化铝脱水生成氧化铝;
ⅳ.电解熔融氧化铝生成铝。
下列说法正确的是( AB )
A.过程ⅰ说明氧化铝具有酸性氧化物的性质
B.过程ⅱ说明碳酸的酸性比氢氧化铝的酸性强
C.过程ⅲ发生的反应类型属于氧化还原反应
D.过程ⅳ也可以用加热法代替电解法冶炼铝
解析:Al2O3与NaOH(碱)反应生成NaAlO2(盐)与水,具有酸性氧化物的性质,A正确;过量CO2与NaAlO2生成Al(OH)3固体,所以H2CO3的酸性强于Al(OH)3,B正确;Al(OH)3分解生成Al2O3和水,是非氧化还原反应,C错误;适合用电解法冶炼的金属为活泼金属,常见的有Na、Mg、Al等,Al是活泼金属不能用加热法,D错误。
18.(双选)以辉铜矿(Cu2S)为原料冶炼铜,其反应原理可表示为Cu2S+O22Cu+SO2。下列说法不正确的是( BC )
A.化合价发生变化的元素有3种
B.Cu2S在该反应中只作还原剂
C.1 mol O2参加反应时,上述反应转移电子总物质的量为4 mol
D.SO2被分离、回收后氧化生成SO3,作为制取硫酸的原料
解析:分析反应中化合价的变化:2+22+2,反应过程中Cu、S、O三种元素的化合价均发生改变,A正确;Cu2S中Cu元素化合价降低,S元素化合价升高,因此Cu2S既是氧化剂又是还原剂,B错误;根据S元素化合价的改变可知,当1 mol O2参加反应时,共转移电子6 mol,C错误;SO2催化氧化可得SO3,SO3被水吸收可得H2SO4,D正确。
19.电解铝技术的出现与成熟让铝从皇家珍品变成汽车、轮船、航天航空制造、化工生产等行业的重要材料。工业上用铝土矿(主要成分为Al2O3、Fe2O3、SiO2等)提取纯Al2O3作冶炼铝的原料,某研究性学习小组设计了如下提取流程图:
(1)固体Ⅱ的化学式为Fe2O3。
(2)在实际工业生产流程⑤中需加入冰晶石,目的是降低Al2O3的熔化温度,减少能量消耗。
(3)写出流程③的离子方程式:AlO+CO2+2H2O===Al(OH)3↓+HCO。
(4)铝粉与氧化铁粉末在引燃条件下常用来焊接钢轨,主要是利用该反应放出大量的热量。
(5)以上从铝土矿中提取铝的过程不涉及的化学反应类型是C(填字母)。
A.复分解反应 B.氧化还原反应
C.置换反应 D.分解反应
(6)生产过程中除NaOH、H2O可以循环使用外,还可以循环使用的物质有CO2、CaO。
