微粒之间的相互作用力,离子键 共价键(课件)
文档属性
| 名称 | 微粒之间的相互作用力,离子键 共价键(课件) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 18:05:23 | ||
图片预览





文档简介
(共18张PPT)
第一课时
第二单元.
微粒之间的相互作用力
化学键
物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
化学键
离子键
共价键
金属键
认真观察实验现象思考以下几个问题
实验:钠在氯气中的燃烧
现象:钠剧烈燃烧并产生白烟
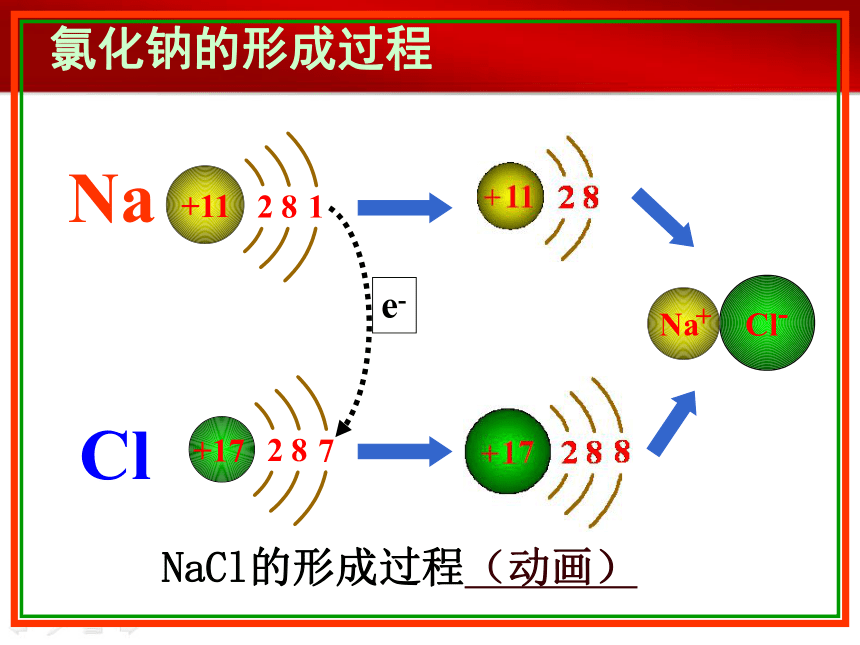
氯化钠的形成过程
NaCl的形成过程(动画)
e-
Na
Cl
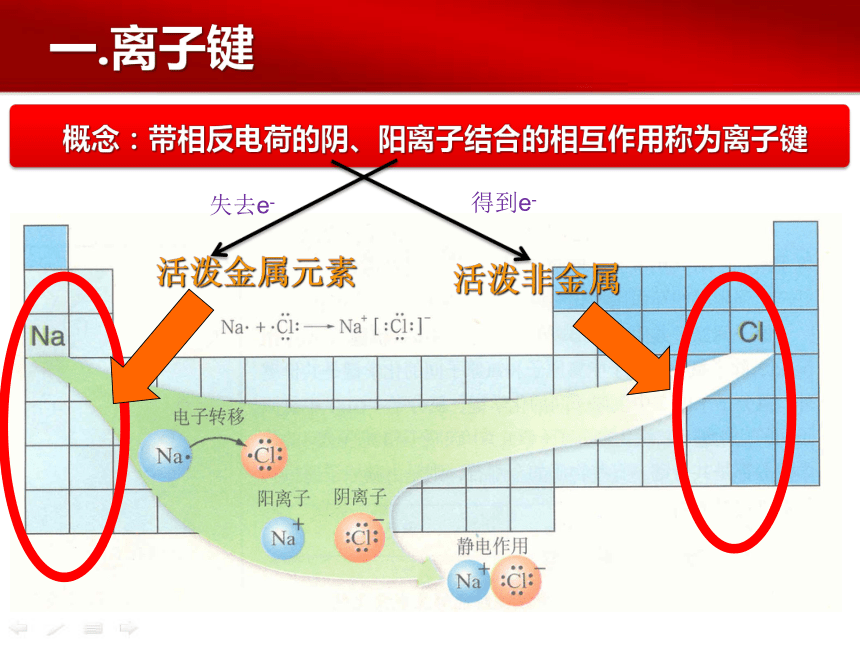
一.离子键
活泼金属元素
活泼非金属
失去e-
得到e-
概念要点
阴、阳离子
活泼金属(IA IIA) 与 非金属(VIA VIIA)
静电作用(静电引力和静电斥力)
练习:判断下列化合物哪些含有离子键
K2O CaO NaBr H2O Na2O2
练一练
练一练
补充:
活泼的金属元素和酸根离子形成的盐
铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。
D
如:KCl、Na2O、MgCl2等
金属离子:Na+、Mg2+、Ca2 +
铵根离子:NH4 +
常见阳离子
常见阴离子
Cl-、S2- 、 OH-
CO32- 、 SO42- 、 NO3-
二.共价键
H2分子形成过程
HCl分子形成过程
Cl2分子形成过程
概念要点
原子
同种或不同种非金属元素(一般)
共用电子对
二.电子式
定义:在元素符号周围用小点(或×)来表示原 子的最外层电子,这种式子叫电子式
1、 原子的电子式:
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
2、离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
阴离子:
阳离子:
书写离子化合物电子式
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同的离子不得合并。
AB型
NaCl
A2B型
Na2S
Na2O
AB2型
MgCl2
书写共价化合物电子式
共价化合物的电子式:由原子的电子式组成,
A2型
Cl2
AnBm型
HCl
Cl ·
··
··
·
Cl ·
··
··
··
·
H
Cl
··
··
··
··
练习
写出下列粒子的电子式:
硫原子, 溴离子, 钾离子
·S·
··
··
[ Br ]-
··
··
:
:
K+
氯化钠
氟化镁
Na+
[ Cl ]-
··
··
:
:
[ F ]-
··
··
:
:
Mg2+
[ F ]-
··
··
:
:
硫化钾
溴化钙
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
判断题
1、离子化合物都含有金属离子。
2、所有金属与非金属形成的化合物都是离子化合物。
3、阴、阳离子只通过静电吸引形成离子键。
4、熔融状态下可以导电的化合物为离子化合物
阴离子
阳离子
用电子式表示
离子化合物
失去电子
得到电子
静电作用
离子键
课堂小结
第一课时
第二单元.
微粒之间的相互作用力
化学键
物质中直接相邻的原子或离子之间存在的强烈的相互作用叫做化学键。
化学键
离子键
共价键
金属键
认真观察实验现象思考以下几个问题
实验:钠在氯气中的燃烧
现象:钠剧烈燃烧并产生白烟
氯化钠的形成过程
NaCl的形成过程(动画)
e-
Na
Cl
一.离子键
活泼金属元素
活泼非金属
失去e-
得到e-
概念要点
阴、阳离子
活泼金属(IA IIA) 与 非金属(VIA VIIA)
静电作用(静电引力和静电斥力)
练习:判断下列化合物哪些含有离子键
K2O CaO NaBr H2O Na2O2
练一练
练一练
补充:
活泼的金属元素和酸根离子形成的盐
铵根离子和酸根离子(或活泼非金属元素离子)形成的盐。
D
如:KCl、Na2O、MgCl2等
金属离子:Na+、Mg2+、Ca2 +
铵根离子:NH4 +
常见阳离子
常见阴离子
Cl-、S2- 、 OH-
CO32- 、 SO42- 、 NO3-
二.共价键
H2分子形成过程
HCl分子形成过程
Cl2分子形成过程
概念要点
原子
同种或不同种非金属元素(一般)
共用电子对
二.电子式
定义:在元素符号周围用小点(或×)来表示原 子的最外层电子,这种式子叫电子式
1、 原子的电子式:
H ·
Na ·
·Mg ·
·Ca ·
·O·
··
··
Cl ·
··
··
··
2、离子的电子式:
H+
Na+
Mg2+
Ca2+
[ O ]2-
··
··
:
:
[ Cl ]-
··
··
:
:
阴离子:
阳离子:
书写离子化合物电子式
离子化合物的电子式:由阴、阳离子的电子式组成,但对相同的离子不得合并。
AB型
NaCl
A2B型
Na2S
Na2O
AB2型
MgCl2
书写共价化合物电子式
共价化合物的电子式:由原子的电子式组成,
A2型
Cl2
AnBm型
HCl
Cl ·
··
··
·
Cl ·
··
··
··
·
H
Cl
··
··
··
··
练习
写出下列粒子的电子式:
硫原子, 溴离子, 钾离子
·S·
··
··
[ Br ]-
··
··
:
:
K+
氯化钠
氟化镁
Na+
[ Cl ]-
··
··
:
:
[ F ]-
··
··
:
:
Mg2+
[ F ]-
··
··
:
:
硫化钾
溴化钙
Ca2+
[ Br ]-
··
··
:
:
[ Br ]-
··
··
:
:
判断题
1、离子化合物都含有金属离子。
2、所有金属与非金属形成的化合物都是离子化合物。
3、阴、阳离子只通过静电吸引形成离子键。
4、熔融状态下可以导电的化合物为离子化合物
阴离子
阳离子
用电子式表示
离子化合物
失去电子
得到电子
静电作用
离子键
课堂小结
