广东省开平一中化学选修四《1.1.1 焓变 反应热》课件
文档属性
| 名称 | 广东省开平一中化学选修四《1.1.1 焓变 反应热》课件 |  | |
| 格式 | zip | ||
| 文件大小 | 134.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-16 21:14:21 | ||
图片预览





文档简介
(共13张PPT)
思考:
1、你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗?
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应
2、你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结吗?
多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳
反应物具有的总能量 生成物具有的总能量
<
第一章 化学反应与能量
第一节 化学反应与能量的变化
第一课时 焓变 反应热
开平市第一中学 高二化学备课组
*
化学反应过程中为什么会有能量的变化?
化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子的过程。
旧键断裂需要吸收能量,
新键形成需要放出能量。
而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中都会有能量的变化。
一、反应热
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
(焓变)
PS:
1、符号:△H 单位: kJ/mol 或 kJ·mol-1
2、反应热描述的是化学反应前后的热量变化
3、反应热描述的是一定温度下的热量变化
4、任何化学反应都有反应热,表现为吸热反应或者放热反应
一、反应热
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
(焓变)
PS:
ΔH=生成物能量-反应物能量
放热反应:ΔH<0或 ΔH为“-”
吸热反应:ΔH>0 或ΔH为“+”
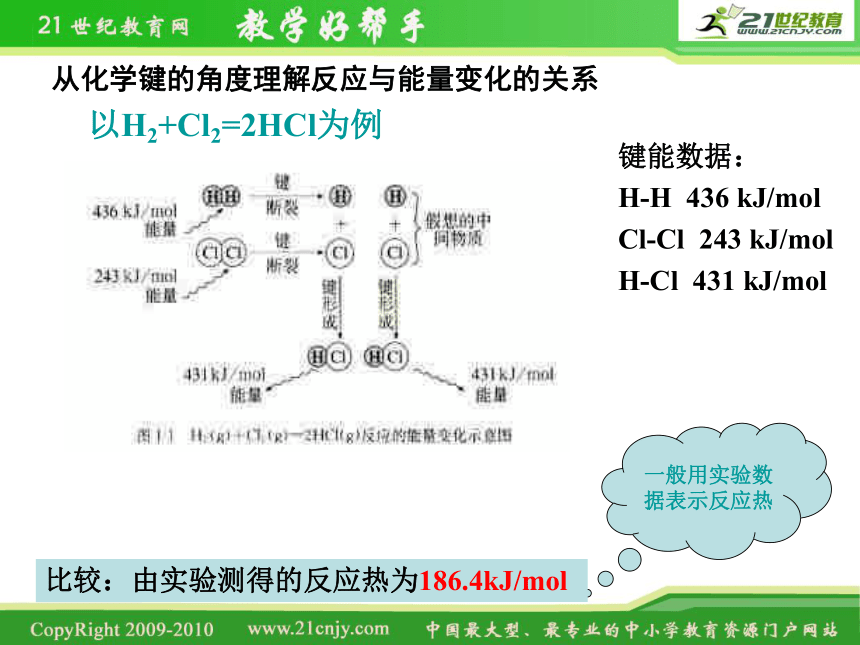
从化学键的角度理解反应与能量变化的关系
以H2+Cl2=2HCl为例
键能数据:
H-H 436 kJ/mol
Cl-Cl 243 kJ/mol
H-Cl 431 kJ/mol
一般用实验数据表示反应热
比较:由实验测得的反应热为186.4kJ/mol
小试一下:
上述反应的反应热表示为: ΔH=-184.6kJ/mol,下面的反应该如何表示它的反应热呢?
例1:1molC与1mol水蒸气反应生成1molCO和1molH2,需要吸收131.5kJ的热量。
ΔH=+131.5kJ/mol
例 2:拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kj,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
-92KJ/mol
-30.6KJ/mol
反应热与物质的量的关系:
质量守恒
能量守恒
某一反应中,质量和能量成正比关系
热量用Q表示
①体系向环境做正功,Q>0,释放能量→放热反应
②体系向环境做负功,Q<0,得到能量→吸热反应
★判断一个反应是吸热反应还是放热反应的方法:
Ⅰ: △H=E2 - E1 > 0为吸热反应
E1不能通过实验测得,∴没有实际的计算意义
Ⅱ:反应物分子断键时吸收的总能量Σ反与生成物分子形成新化学键时释放的能量Σ生的相对大小
△H= Σ反- Σ生
若: △H > 0 则为吸热反应 △H为“+” , Q<0
△H < 0 则为放热反应 △H为“-” , Q>0
Ⅲ:通过实验直接测得→掌握中和热的测定
阅读P3《资料●体系与环境》
键能:
破坏1 mol 共价键吸收的能量或形成1 mol 共价键放出的能量
键能恒取正值
放热反应 吸热反应
表现
行式 △H﹤0或△H为“—” △H﹥0或△H为“+”
形成原因
与化学键强弱的关系
联系 键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定。
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
生成物释放的总能量大于反应物吸收的总能量
生成物释放的总能量小于反应物吸收的总能量
1、下列叙述正确的是 ( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
2、已知:H + H ═ H2;△H=-436KJ/mol,则下列叙述正确的是 ( )
A.2个H原子的能量高于1个H2的能量
B.2个H原子的能量低于1个H2的能量
C. H原子比H2分子稳定
D.H2分子比H原子稳定
A C
A D
课堂练习
3、下列变化过程中会放出热量的是 ( )
①硝酸铵溶于水②物质的燃烧③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③
C.仅②④ D.②③④
D
4、下列变化中,属于放热反应的是 ( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化钠溶于水
B
小 结
一、反应热、焓变
从反应热角度看:
ΔH=生成物能量-反应物能量
从键能角度看:
ΔH=反应物总键能-生成物总键能
放热反应:
吸热反应:
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
思考:
1、你所知道的化学反应中有哪些是放热反应?能作一个简单的总结吗?
活泼金属与水或酸的反应、酸碱中和反应、燃烧反应、多数化合反应
2、你所知道的化学反应中有哪些是吸热反应?能作一个简单的总结吗?
多数的分解反应、氯化铵固体与氢氧化钡晶体的反应、水煤气的生成反应、炭与二氧化碳生成一氧化碳
反应物具有的总能量 生成物具有的总能量
<
第一章 化学反应与能量
第一节 化学反应与能量的变化
第一课时 焓变 反应热
开平市第一中学 高二化学备课组
*
化学反应过程中为什么会有能量的变化?
化学反应的实质就是反应物分子中化学键断裂,形成新的化学键,重新组合成生成物的分子的过程。
旧键断裂需要吸收能量,
新键形成需要放出能量。
而一般化学反应中,旧键的断裂所吸收的总能量与新键形成所放出的总能量是不相等的,而这个差值就是反应中能量的变化。所以化学反应过程中都会有能量的变化。
一、反应热
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
(焓变)
PS:
1、符号:△H 单位: kJ/mol 或 kJ·mol-1
2、反应热描述的是化学反应前后的热量变化
3、反应热描述的是一定温度下的热量变化
4、任何化学反应都有反应热,表现为吸热反应或者放热反应
一、反应热
化学反应过程中所释放或吸收的能量,都可以用热量(或换算成相应的热量)来表述,叫做反应热,在恒压条件下又称为焓变。
(焓变)
PS:
ΔH=生成物能量-反应物能量
放热反应:ΔH<0或 ΔH为“-”
吸热反应:ΔH>0 或ΔH为“+”
从化学键的角度理解反应与能量变化的关系
以H2+Cl2=2HCl为例
键能数据:
H-H 436 kJ/mol
Cl-Cl 243 kJ/mol
H-Cl 431 kJ/mol
一般用实验数据表示反应热
比较:由实验测得的反应热为186.4kJ/mol
小试一下:
上述反应的反应热表示为: ΔH=-184.6kJ/mol,下面的反应该如何表示它的反应热呢?
例1:1molC与1mol水蒸气反应生成1molCO和1molH2,需要吸收131.5kJ的热量。
ΔH=+131.5kJ/mol
例 2:拆开 lmol H—H键、lmol N-H键、lmolN≡N键分别需要的能量是436kJ、391kJ、946kj,则1mol N2生成NH3的反应热为 ,1mol H2生成NH3的反应热为 。
-92KJ/mol
-30.6KJ/mol
反应热与物质的量的关系:
质量守恒
能量守恒
某一反应中,质量和能量成正比关系
热量用Q表示
①体系向环境做正功,Q>0,释放能量→放热反应
②体系向环境做负功,Q<0,得到能量→吸热反应
★判断一个反应是吸热反应还是放热反应的方法:
Ⅰ: △H=E2 - E1 > 0为吸热反应
E1不能通过实验测得,∴没有实际的计算意义
Ⅱ:反应物分子断键时吸收的总能量Σ反与生成物分子形成新化学键时释放的能量Σ生的相对大小
△H= Σ反- Σ生
若: △H > 0 则为吸热反应 △H为“+” , Q<0
△H < 0 则为放热反应 △H为“-” , Q>0
Ⅲ:通过实验直接测得→掌握中和热的测定
阅读P3《资料●体系与环境》
键能:
破坏1 mol 共价键吸收的能量或形成1 mol 共价键放出的能量
键能恒取正值
放热反应 吸热反应
表现
行式 △H﹤0或△H为“—” △H﹥0或△H为“+”
形成原因
与化学键强弱的关系
联系 键能越大,物质能量越低,越稳定,反之键能越小,物质能量越高,越不稳定。
反应物具有的总能量大于生成物具有的总能量
反应物具有的总能量小于生成物具有的总能量
生成物释放的总能量大于反应物吸收的总能量
生成物释放的总能量小于反应物吸收的总能量
1、下列叙述正确的是 ( )
A.化学反应一定伴随热量的变化
B.凡是吸热或放热过程中热量的变化均称为反应热
C.若△H<0,则反应物的能量高于生成物的能量
D.若△H>0,则反应物的能量高于生成物的能量
2、已知:H + H ═ H2;△H=-436KJ/mol,则下列叙述正确的是 ( )
A.2个H原子的能量高于1个H2的能量
B.2个H原子的能量低于1个H2的能量
C. H原子比H2分子稳定
D.H2分子比H原子稳定
A C
A D
课堂练习
3、下列变化过程中会放出热量的是 ( )
①硝酸铵溶于水②物质的燃烧③苛性钠溶于水
④生石灰放入水中 ⑤醋酸的电离
A.仅①⑤ B.仅②③
C.仅②④ D.②③④
D
4、下列变化中,属于放热反应的是 ( )
A.Ba(OH)2·8H2O与NH4Cl的反应
B.点燃的镁条在二氧化碳中继续燃烧
C.灼热的碳与二氧化碳的反应
D.氯化钠溶于水
B
小 结
一、反应热、焓变
从反应热角度看:
ΔH=生成物能量-反应物能量
从键能角度看:
ΔH=反应物总键能-生成物总键能
放热反应:
吸热反应:
ΔH<0或 ΔH为“-”
ΔH>0 或ΔH为“+”
