6.2 二氧化碳制取的研究-2020-2021学年九年级化学上册同步优质课件(共15张PPT)
文档属性
| 名称 | 6.2 二氧化碳制取的研究-2020-2021学年九年级化学上册同步优质课件(共15张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-06-30 00:00:00 | ||
图片预览



文档简介
(共15张PPT)
第六单元
碳和碳的化合物
Carbon
and
it’s
compounds
课题2
二氧化碳制取的研究
学
习
目
标
Learning
aims
1.
了解实验室制取二氧化碳的反应原理
2.
探究实验室制取二氧化碳的制取装置
3.
了解检验和验满二氧化碳的方法
4.
了解实验室制取气体的思路和方法
3.工业制法:(高温煅烧石灰石)
1.实验室制法:_______与
___________________________
2.反应原理:_________________________________
稀盐酸
大理石/石灰石(主要成分CaCO3)
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
不能用浓盐酸:浓盐酸具有______性,使制得的气体中混有______气体。
挥发
HCl
一、反应原理
CaCO3
CaO
+
CO2↑
制
取
装
置
发生装置
收集装置
反应物状态
反应条件
气体密度
是否溶于水,是否与水反应
比空气___
固体+液体
常温
大
能溶于水,且能与水反应
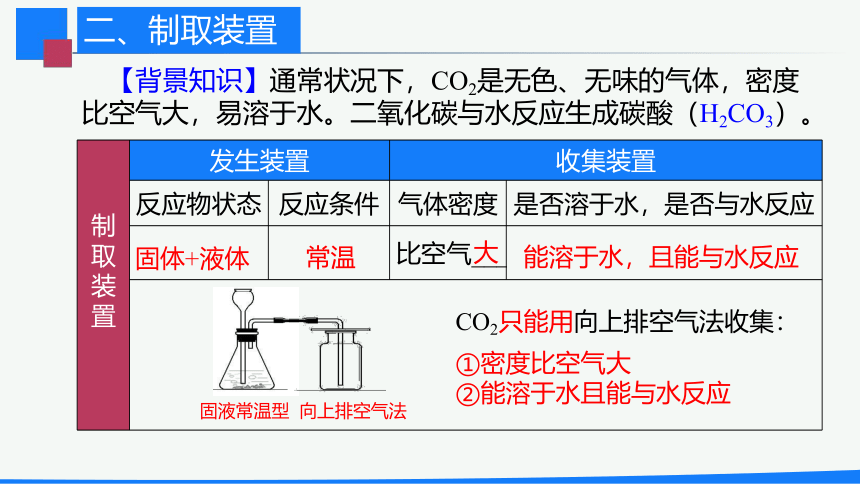
【背景知识】通常状况下,CO2是无色、无味的气体,密度比空气大,易溶于水。二氧化碳与水反应生成碳酸(H2CO3)。
固液常温型
向上排空气法
CO2只能用向上排空气法收集:
①密度比空气大
②能溶于水且能与水反应
二、制取装置
1.通过比较气体_____________比较气体密度
2.空气的平均相对分子质量为_____
相对分子质量
29
【练习】比较下列气体密度的大小(C-12
O-16
N-14
H-1)
ρ(CO2)_____
ρ空气
ρ(NH3)_____
ρ空气
>
<
如何比较气体的密度大小(P114)
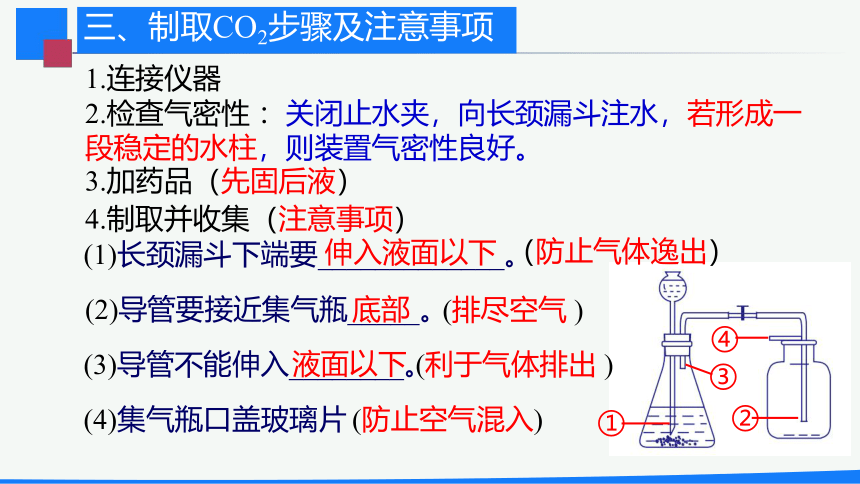
1.连接仪器
3.加药品(先固后液)
4.制取并收集(注意事项)
(防止气体逸出)
(排尽空气
)
(利于气体排出
)
①
③
④
②
(1)长颈漏斗下端要_____________。
(2)导管要接近集气瓶_____。
(3)导管不能伸入________。
(4)集气瓶口盖玻璃片
(防止空气混入)
2.检查气密性
:关闭止水夹,向长颈漏斗注水,若形成一段稳定的水柱,则装置气密性良好。
伸入液面以下
底部
液面以下
三、制取CO2步骤及注意事项
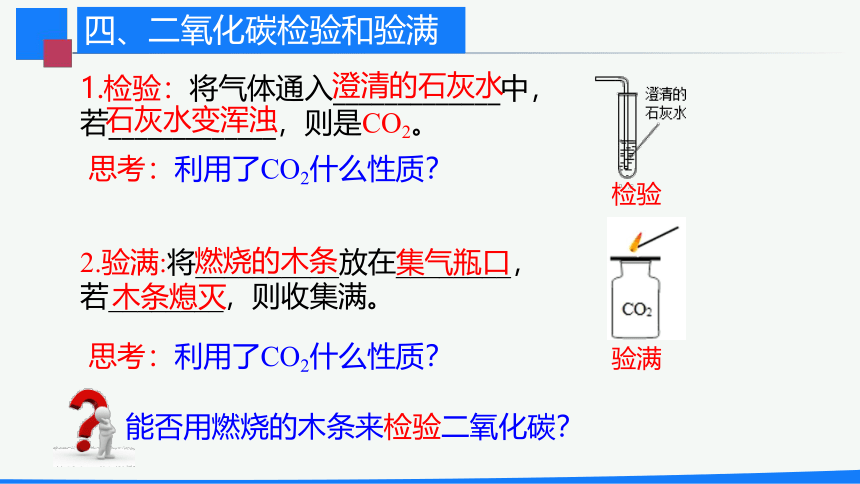
1.检验:将气体通入_____________中,若_____________,则是CO2。
2.验满:将__________放在________,若________,则收集满。
燃烧的木条
集气瓶口
木条熄灭
澄清的石灰水
石灰水变浑浊
能否用燃烧的木条来检验二氧化碳?
思考:利用了CO2什么性质?
思考:利用了CO2什么性质?
四、二氧化碳检验和验满
检验
验满
收集满的CO2,应该_____(正/倒)放在桌面上。
原因:
CO2的密度比空气大。
正
CO2
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
思考:利用下列反应原理和装置制取的CO2中可能混有______和________杂质。
除去HCl
洗气要点:
1.长进短出;
2.先除杂再干燥
气体的净化(除杂)
HCl
水蒸气
除去H2O
CO2(HCl、H2O)
浓盐酸
和石灰石
实验室制取气体的一般思路和方法:
(1)确定制取气体的__________;
(2)选择制取装置,包括__________和__________;
(3)验满和检验
(4)气体的净化
反应原理
发生装置
收集装置
1.(2020·东莞月考)鉴别空气、氧气、二氧化碳三种气体最简单的方法是(
)
A.向瓶内倒人澄清的石灰水振荡
B.试验三种气体的溶解性
C.用燃着的木条伸入集气瓶内
D.测三种气体的密度
C
2.(2020·广东模拟)下图是实验室依次制备、收集、验证、验满CO2的装置,其中正确的是(
)
A.
B.
C.
D.
D
3.如图是康康做的有关二氧化碳制取的有关实验。
(1)甲中发生反应的化学方程式为
。
(2)乙和丙的实验目的分别是
。
2HC1+CaCO3=CaCl2+CO2↑+H2O
检验二氧化碳、收集并验满二氧化碳
1.课本P116:练习与应用1、2、3、5、6
2.基训P68:
课堂练习
第六单元
碳和碳的化合物
Carbon
and
it’s
compounds
课题2
二氧化碳制取的研究
学
习
目
标
Learning
aims
1.
了解实验室制取二氧化碳的反应原理
2.
探究实验室制取二氧化碳的制取装置
3.
了解检验和验满二氧化碳的方法
4.
了解实验室制取气体的思路和方法
3.工业制法:(高温煅烧石灰石)
1.实验室制法:_______与
___________________________
2.反应原理:_________________________________
稀盐酸
大理石/石灰石(主要成分CaCO3)
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
不能用浓盐酸:浓盐酸具有______性,使制得的气体中混有______气体。
挥发
HCl
一、反应原理
CaCO3
CaO
+
CO2↑
制
取
装
置
发生装置
收集装置
反应物状态
反应条件
气体密度
是否溶于水,是否与水反应
比空气___
固体+液体
常温
大
能溶于水,且能与水反应
【背景知识】通常状况下,CO2是无色、无味的气体,密度比空气大,易溶于水。二氧化碳与水反应生成碳酸(H2CO3)。
固液常温型
向上排空气法
CO2只能用向上排空气法收集:
①密度比空气大
②能溶于水且能与水反应
二、制取装置
1.通过比较气体_____________比较气体密度
2.空气的平均相对分子质量为_____
相对分子质量
29
【练习】比较下列气体密度的大小(C-12
O-16
N-14
H-1)
ρ(CO2)_____
ρ空气
ρ(NH3)_____
ρ空气
>
<
如何比较气体的密度大小(P114)
1.连接仪器
3.加药品(先固后液)
4.制取并收集(注意事项)
(防止气体逸出)
(排尽空气
)
(利于气体排出
)
①
③
④
②
(1)长颈漏斗下端要_____________。
(2)导管要接近集气瓶_____。
(3)导管不能伸入________。
(4)集气瓶口盖玻璃片
(防止空气混入)
2.检查气密性
:关闭止水夹,向长颈漏斗注水,若形成一段稳定的水柱,则装置气密性良好。
伸入液面以下
底部
液面以下
三、制取CO2步骤及注意事项
1.检验:将气体通入_____________中,若_____________,则是CO2。
2.验满:将__________放在________,若________,则收集满。
燃烧的木条
集气瓶口
木条熄灭
澄清的石灰水
石灰水变浑浊
能否用燃烧的木条来检验二氧化碳?
思考:利用了CO2什么性质?
思考:利用了CO2什么性质?
四、二氧化碳检验和验满
检验
验满
收集满的CO2,应该_____(正/倒)放在桌面上。
原因:
CO2的密度比空气大。
正
CO2
CaCO3
+
2HCl
=
CaCl2
+
H2O
+
CO2↑
思考:利用下列反应原理和装置制取的CO2中可能混有______和________杂质。
除去HCl
洗气要点:
1.长进短出;
2.先除杂再干燥
气体的净化(除杂)
HCl
水蒸气
除去H2O
CO2(HCl、H2O)
浓盐酸
和石灰石
实验室制取气体的一般思路和方法:
(1)确定制取气体的__________;
(2)选择制取装置,包括__________和__________;
(3)验满和检验
(4)气体的净化
反应原理
发生装置
收集装置
1.(2020·东莞月考)鉴别空气、氧气、二氧化碳三种气体最简单的方法是(
)
A.向瓶内倒人澄清的石灰水振荡
B.试验三种气体的溶解性
C.用燃着的木条伸入集气瓶内
D.测三种气体的密度
C
2.(2020·广东模拟)下图是实验室依次制备、收集、验证、验满CO2的装置,其中正确的是(
)
A.
B.
C.
D.
D
3.如图是康康做的有关二氧化碳制取的有关实验。
(1)甲中发生反应的化学方程式为
。
(2)乙和丙的实验目的分别是
。
2HC1+CaCO3=CaCl2+CO2↑+H2O
检验二氧化碳、收集并验满二氧化碳
1.课本P116:练习与应用1、2、3、5、6
2.基训P68:
课堂练习
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
