人教版(2019)高中化学必修一 同步课件 1.2.1 电解质及其电离(30张ppt)
文档属性
| 名称 | 人教版(2019)高中化学必修一 同步课件 1.2.1 电解质及其电离(30张ppt) |
|
|
| 格式 | ppt | ||
| 文件大小 | 2.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-09 00:00:00 | ||
图片预览









文档简介
(共30张PPT)
必修第一册
人教版
高一上
第一章
物质及其变化
第一节
物质的分类及转化
第三节
氧化还原反应
第二节
离子反应
CONTENTS
本节内容
强弱电解质
二
电解质与非电解质
一
电解质的电离
三
新知导入
【回顾】下列物质可导电的是________________
①盐酸
②NaOH溶液
③NaCl固体
④石墨
⑤NaCl溶液
⑥蔗糖溶液
⑦熔融NaCl
⑧酒精溶液
⑨Cu
【思考1】物质导电的条件是什么?
【思考2】能否根据化合物在一定条件下是否导电来进行分类?
①②④⑤⑦⑨
有自由移动的离子或电子
新知讲解
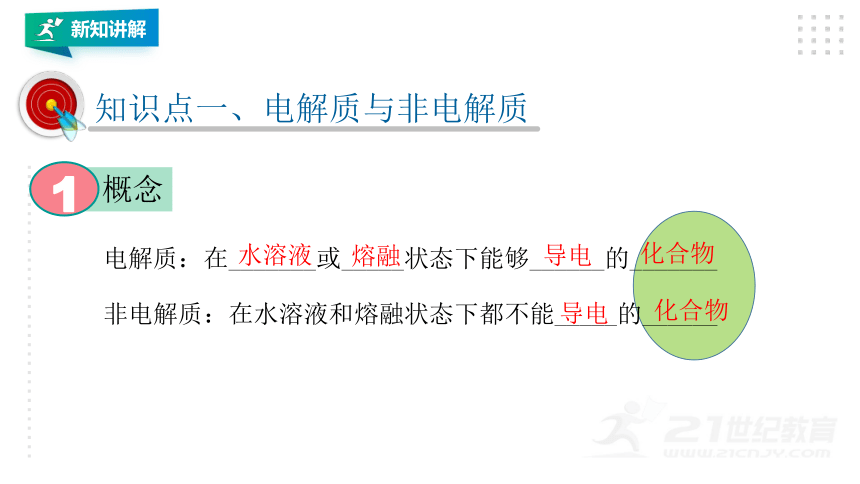
知识点一、电解质与非电解质
概念
1
电解质:在_______或_____状态下能够______的_______
水溶液
熔融
导电
非电解质:在水溶液和熔融状态下都不能_____的______
导电
化合物
化合物
新知讲解
常见的电解质和非电解质
2
(1)常见的电解质
①酸:HCl、H2SO4、HNO3、H2CO3等
②碱:KOH、NaOH、NH3·H2O、Mg(OH)2、Al(OH)3等
③大多数盐:KCl、Na2SO4、Mg(NO3)2等
④水和少数有机物,如CH3COOH
⑤活泼金属氧化物:Na2O、CaO等
新知讲解
(2)常见的非电解质
①多数非金属氧化物:CO2、SO2、SO3、P2O5等
②非酸性气态氢化物:如NH3
③大多数有机物:蔗糖、酒精、CH4等
新知讲解
特别提醒
能导电的物质________是电解质,如金属、石墨、盐酸等
(电解质_______是化合物)
电解质_______能导电,如NaCl
固体,电解质需要在水溶液或熔融状态下才能导电
溶于水能导电的化合物________是电解质,如CO2、SO2、SO3、NH3的水溶液能导电,但不是电解质
不一定
一定
不一定
不一定
①SO2+H2O=H2SO3
③CO2+H2O=H2CO3
②SO3+H2O=H2SO4
④NH3+H2O=NH3·H2O
课堂练习
特别提醒
CaCO3、BaSO4等难溶电解质,其水溶液几乎不导电,但它们在熔融状态下能导电,所以是电解质
HCl是电解质,但液态HCl_______导电。熔融状态下,碱、盐和金属氧化物才能导电
不能
课堂练习
【例1】判断正误(正确的打“√”,错误的打“×”)。
(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质(
)
(2)NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质(
)
(3)硫酸钡水溶液几乎不导电,故硫酸钡是非电解质(
)
(4)NaCl晶体不能导电,是由于其中不含离子(
)
(5)某一物质不是电解质就是非电解质(
)
×
×
×
×
×
课堂练习
【例2】下列说法正确的是( )
A.液态氯化氢、固体氯化钠均不导电,所以HCl、NaCl均是非电解质
B.NH3的水溶液能导电,所以NH3是电解质
C.蔗糖、酒精在水溶液中和熔化时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
【例3】有下列物质:①氢氧化钠固体,②铜丝,③氯化氢气体,④稀硫酸,⑤二氧化碳气体,⑥氨水,⑦碳酸钠粉末,⑧蔗糖晶体,⑨熔融氯化钠,⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是__________。
(2)属于电解质的是______________。
(3)属于非电解质的是__________。
(4)上述状态下的电解质不能导电的是____________。
②④⑥⑨
①③⑦⑨⑩
⑤⑧
①③⑦⑩
课堂练习
新知讲解
知识点二、强弱电解质
分类
强电解质
弱电解质
概念
所含物质类型
能______电离的电解质
只能______电离的电解质
全部
①强酸:__________________
__________________
②强碱:__________________________
③大多数盐:______________________
④大多数金属氧化物
部分
H2SO4、HNO3、HCl、
①弱酸:______________
②弱碱:______________
③水
④少数盐
HBr、HI、HClO4
KOH、NaOH、Ba(OH)2、Ca(OH)2
CH3COOH、H2CO3
NH3·H2O、Fe(OH)3
Al2(SO4)3、CaCO3、CH3COONa
分类
强电解质
弱电解质
相同点
不同点
都能电离,都属于电解质,都属于化合物
电离程度不同,溶质存在形式不同,强电解质溶液中只有电离出的阴、阳离子,无电解质分子(浓硫酸特殊);弱电解质溶液中既有电离出的阴、阳离子,又有电解质分子
【例4】下列说法中正确的是(
)
A.NH3·H2O和CH3COOH都是弱电解质,CH3COONH4是强电解质
B.有机物都属于弱电解质或非电解质
C.强电解质溶液中只有离子没有分子,弱电解质溶液中既有离子也有分子
D.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A
课堂练习
【例5】在醋酸溶液中存在下列哪些物质___________
①H2O分子
②CH3COO-
③CH3COOH分子
④H+
①②③④
【例6】下列属于强电解质的是________
①HClO
②H2SO3
③KClO3
④Ba(OH)2
⑤硫酸钡
⑥食盐水
③④⑤
课堂练习
【例7】对下列物质进行分类:①H2SO4,②Cu,③NaOH,④BaSO4,⑤氨水,⑥SO2,⑦醋酸,⑧C2H5OH。
(1)弱电解质:___________
(2)强电解质:________________
(3)非电解质____________
(4)能导电的物质:___________
⑦
⑥⑧
①③④
②⑤
课堂练习
新知讲解
知识点三、电解质的电离
概念
1
电解质在水溶液里或熔融状态下离解成自由移动离子的过程
NaCl固体加入水中时,在水分子作用下,Na+和Cl-脱离固体表面进入水中,形成能够自由移动的水合钠离子和水合氯离子
新知讲解
NaCl固体受热融化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生自由移动的Na+和Cl-,因而NaCl在熔融状态下也能导电
表示方法——电离方程式
2
左边为电解质的化学式,中间用“=”或者“?”连接,右边为电离生成的离子
(1)强电解质在水溶液中全部电离,用“=”连接,如:
H2SO4=
2H++SO42-
(2)弱电解质在水溶液中部分电离用“?”连接,如:
CH3COOH?CH3COO-
+H+
Ba(OH)2=Ba2++2OH-
Na2SO4=2Na++SO42-
【特别提醒】NaHSO4在水溶液中电离产生Na+、H+和SO42-,但在熔融状态下电离产生Na+和HSO4-
新知讲解
从电离的角度认识酸、碱、盐
3
(1)H2SO4=
2H++SO42-
(2)HCl
=
H++Cl-
(3)Ba(OH)2=Ba2++2OH-
(4)NaOH=Na++OH-
(5)NaCl=Na++Cl-
(6)Al2(SO4)3=2
Al3++3SO42-
新知讲解
电解质的导电能力
4
电解质溶液的导电能力与溶液中自由移动离子浓度及离子所带电荷多少有关
离子浓度越大,导电能力______
离子所带电荷越多,导电能力______
【特别提醒】
强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
越强
越强
新知讲解
【例8】下列物质的电离方程式错误的是( )
A.NaOH=Na++OH-
B.CuCl2=Cu2++2Cl-
C.Fe2(SO4)3=Fe22++(SO4)32-
D.Ba(NO3)2=Ba2++2NO3-
C
课堂练习
D
【例10】(1)以下为中学化学中常见的几种物质:
①Cu
②NaCl
③NaHSO4
④CO2
⑤H2SO4
⑥酒精
⑦CaCO3
⑧BaSO4
⑨NaOH
属于电解质的是______________(填序号)。
②③⑤⑦⑧⑨
课堂练习
(2)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:______________________。
②KHSO4:_______________________。
③Fe2(SO4)3:_____________________。
④一水合氨:_____________________。
⑤醋酸钠:_________________________。
⑥KMnO4:_________________________。
Ba(OH)2=Ba2++2OH-
KHSO4=
K++H++SO42-
Fe2(SO4)3=2Fe3++3SO42-
NH3·H2O?NH4++OH-
CH3COONa=
CH3COO-
+Na+
KMnO4=
K++MnO4-
课堂练习
【例11】下列关于酸、碱、盐元素组成的说法中,正确的是(
)
A.酸、碱一定含氢,盐一定不含氢
B.碱、盐可能含氧,酸一定含氧
C.酸、碱、盐可能都不含金属元素
D.盐一定含金属元素,酸、碱不一定含金属元素
C
课堂练习
【例12】在连有稀硫酸和灯泡(已亮)的闭合回路中,向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2至过量,能观察到(
)
A.灯泡逐渐变暗
B.灯泡保持光亮
C.灯泡先变暗,后变亮
D.先产生白色沉淀,然后溶解
C
课堂练习
课堂总结
https://www.21cnjy.com/help/help_extract.php
必修第一册
人教版
高一上
第一章
物质及其变化
第一节
物质的分类及转化
第三节
氧化还原反应
第二节
离子反应
CONTENTS
本节内容
强弱电解质
二
电解质与非电解质
一
电解质的电离
三
新知导入
【回顾】下列物质可导电的是________________
①盐酸
②NaOH溶液
③NaCl固体
④石墨
⑤NaCl溶液
⑥蔗糖溶液
⑦熔融NaCl
⑧酒精溶液
⑨Cu
【思考1】物质导电的条件是什么?
【思考2】能否根据化合物在一定条件下是否导电来进行分类?
①②④⑤⑦⑨
有自由移动的离子或电子
新知讲解
知识点一、电解质与非电解质
概念
1
电解质:在_______或_____状态下能够______的_______
水溶液
熔融
导电
非电解质:在水溶液和熔融状态下都不能_____的______
导电
化合物
化合物
新知讲解
常见的电解质和非电解质
2
(1)常见的电解质
①酸:HCl、H2SO4、HNO3、H2CO3等
②碱:KOH、NaOH、NH3·H2O、Mg(OH)2、Al(OH)3等
③大多数盐:KCl、Na2SO4、Mg(NO3)2等
④水和少数有机物,如CH3COOH
⑤活泼金属氧化物:Na2O、CaO等
新知讲解
(2)常见的非电解质
①多数非金属氧化物:CO2、SO2、SO3、P2O5等
②非酸性气态氢化物:如NH3
③大多数有机物:蔗糖、酒精、CH4等
新知讲解
特别提醒
能导电的物质________是电解质,如金属、石墨、盐酸等
(电解质_______是化合物)
电解质_______能导电,如NaCl
固体,电解质需要在水溶液或熔融状态下才能导电
溶于水能导电的化合物________是电解质,如CO2、SO2、SO3、NH3的水溶液能导电,但不是电解质
不一定
一定
不一定
不一定
①SO2+H2O=H2SO3
③CO2+H2O=H2CO3
②SO3+H2O=H2SO4
④NH3+H2O=NH3·H2O
课堂练习
特别提醒
CaCO3、BaSO4等难溶电解质,其水溶液几乎不导电,但它们在熔融状态下能导电,所以是电解质
HCl是电解质,但液态HCl_______导电。熔融状态下,碱、盐和金属氧化物才能导电
不能
课堂练习
【例1】判断正误(正确的打“√”,错误的打“×”)。
(1)铁丝、NaCl溶液和盐酸都能导电,所以三者都是电解质(
)
(2)NH3、CO2的水溶液均能导电,所以NH3、CO2均是电解质(
)
(3)硫酸钡水溶液几乎不导电,故硫酸钡是非电解质(
)
(4)NaCl晶体不能导电,是由于其中不含离子(
)
(5)某一物质不是电解质就是非电解质(
)
×
×
×
×
×
课堂练习
【例2】下列说法正确的是( )
A.液态氯化氢、固体氯化钠均不导电,所以HCl、NaCl均是非电解质
B.NH3的水溶液能导电,所以NH3是电解质
C.蔗糖、酒精在水溶液中和熔化时均不导电,所以它们是非电解质
D.铜、石墨均导电,所以它们是电解质
C
【例3】有下列物质:①氢氧化钠固体,②铜丝,③氯化氢气体,④稀硫酸,⑤二氧化碳气体,⑥氨水,⑦碳酸钠粉末,⑧蔗糖晶体,⑨熔融氯化钠,⑩CuSO4·5H2O晶体。请用序号填空:
(1)上述状态下可导电的是__________。
(2)属于电解质的是______________。
(3)属于非电解质的是__________。
(4)上述状态下的电解质不能导电的是____________。
②④⑥⑨
①③⑦⑨⑩
⑤⑧
①③⑦⑩
课堂练习
新知讲解
知识点二、强弱电解质
分类
强电解质
弱电解质
概念
所含物质类型
能______电离的电解质
只能______电离的电解质
全部
①强酸:__________________
__________________
②强碱:__________________________
③大多数盐:______________________
④大多数金属氧化物
部分
H2SO4、HNO3、HCl、
①弱酸:______________
②弱碱:______________
③水
④少数盐
HBr、HI、HClO4
KOH、NaOH、Ba(OH)2、Ca(OH)2
CH3COOH、H2CO3
NH3·H2O、Fe(OH)3
Al2(SO4)3、CaCO3、CH3COONa
分类
强电解质
弱电解质
相同点
不同点
都能电离,都属于电解质,都属于化合物
电离程度不同,溶质存在形式不同,强电解质溶液中只有电离出的阴、阳离子,无电解质分子(浓硫酸特殊);弱电解质溶液中既有电离出的阴、阳离子,又有电解质分子
【例4】下列说法中正确的是(
)
A.NH3·H2O和CH3COOH都是弱电解质,CH3COONH4是强电解质
B.有机物都属于弱电解质或非电解质
C.强电解质溶液中只有离子没有分子,弱电解质溶液中既有离子也有分子
D.强电解质溶液的导电能力一定比弱电解质溶液的导电能力强
A
课堂练习
【例5】在醋酸溶液中存在下列哪些物质___________
①H2O分子
②CH3COO-
③CH3COOH分子
④H+
①②③④
【例6】下列属于强电解质的是________
①HClO
②H2SO3
③KClO3
④Ba(OH)2
⑤硫酸钡
⑥食盐水
③④⑤
课堂练习
【例7】对下列物质进行分类:①H2SO4,②Cu,③NaOH,④BaSO4,⑤氨水,⑥SO2,⑦醋酸,⑧C2H5OH。
(1)弱电解质:___________
(2)强电解质:________________
(3)非电解质____________
(4)能导电的物质:___________
⑦
⑥⑧
①③④
②⑤
课堂练习
新知讲解
知识点三、电解质的电离
概念
1
电解质在水溶液里或熔融状态下离解成自由移动离子的过程
NaCl固体加入水中时,在水分子作用下,Na+和Cl-脱离固体表面进入水中,形成能够自由移动的水合钠离子和水合氯离子
新知讲解
NaCl固体受热融化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生自由移动的Na+和Cl-,因而NaCl在熔融状态下也能导电
表示方法——电离方程式
2
左边为电解质的化学式,中间用“=”或者“?”连接,右边为电离生成的离子
(1)强电解质在水溶液中全部电离,用“=”连接,如:
H2SO4=
2H++SO42-
(2)弱电解质在水溶液中部分电离用“?”连接,如:
CH3COOH?CH3COO-
+H+
Ba(OH)2=Ba2++2OH-
Na2SO4=2Na++SO42-
【特别提醒】NaHSO4在水溶液中电离产生Na+、H+和SO42-,但在熔融状态下电离产生Na+和HSO4-
新知讲解
从电离的角度认识酸、碱、盐
3
(1)H2SO4=
2H++SO42-
(2)HCl
=
H++Cl-
(3)Ba(OH)2=Ba2++2OH-
(4)NaOH=Na++OH-
(5)NaCl=Na++Cl-
(6)Al2(SO4)3=2
Al3++3SO42-
新知讲解
电解质的导电能力
4
电解质溶液的导电能力与溶液中自由移动离子浓度及离子所带电荷多少有关
离子浓度越大,导电能力______
离子所带电荷越多,导电能力______
【特别提醒】
强电解质溶液的导电能力不一定比弱电解质溶液的导电能力强
越强
越强
新知讲解
【例8】下列物质的电离方程式错误的是( )
A.NaOH=Na++OH-
B.CuCl2=Cu2++2Cl-
C.Fe2(SO4)3=Fe22++(SO4)32-
D.Ba(NO3)2=Ba2++2NO3-
C
课堂练习
D
【例10】(1)以下为中学化学中常见的几种物质:
①Cu
②NaCl
③NaHSO4
④CO2
⑤H2SO4
⑥酒精
⑦CaCO3
⑧BaSO4
⑨NaOH
属于电解质的是______________(填序号)。
②③⑤⑦⑧⑨
课堂练习
(2)写出下列物质在水溶液中的电离方程式:
①Ba(OH)2:______________________。
②KHSO4:_______________________。
③Fe2(SO4)3:_____________________。
④一水合氨:_____________________。
⑤醋酸钠:_________________________。
⑥KMnO4:_________________________。
Ba(OH)2=Ba2++2OH-
KHSO4=
K++H++SO42-
Fe2(SO4)3=2Fe3++3SO42-
NH3·H2O?NH4++OH-
CH3COONa=
CH3COO-
+Na+
KMnO4=
K++MnO4-
课堂练习
【例11】下列关于酸、碱、盐元素组成的说法中,正确的是(
)
A.酸、碱一定含氢,盐一定不含氢
B.碱、盐可能含氧,酸一定含氧
C.酸、碱、盐可能都不含金属元素
D.盐一定含金属元素,酸、碱不一定含金属元素
C
课堂练习
【例12】在连有稀硫酸和灯泡(已亮)的闭合回路中,向盛有稀硫酸的烧杯中逐滴加入Ba(OH)2至过量,能观察到(
)
A.灯泡逐渐变暗
B.灯泡保持光亮
C.灯泡先变暗,后变亮
D.先产生白色沉淀,然后溶解
C
课堂练习
课堂总结
https://www.21cnjy.com/help/help_extract.php
