人教版(2019)化学必修一 同步课件 1.3.3氧化还原反应方程式的配平(22张ppt)
文档属性
| 名称 | 人教版(2019)化学必修一 同步课件 1.3.3氧化还原反应方程式的配平(22张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-01 00:00:00 | ||
图片预览





文档简介
(共22张PPT)
必修第一册
人教版
高一上
第二章
化学物质及其变化
第一节
物质的分类
第三节
氧化还原反应
第二节
离子反应
CONTENTS
本节内容
方程式的配平
二
电子转移的表示方法
一
一、电子转移的表示方法
新知讲解
双线桥法
1
(1)含义
表明氧化还原反应前后同一种元素原子或离子间的电子转移情况
(2)步骤
①标变价
②连双线
将不同价态的同种元素用桥线相连,箭头从________指向_______
(注意:箭头的起止对准元素)
CuO+H2
?
Cu+H2O
+2
0
0
+1
反应物
生成物
新知讲解
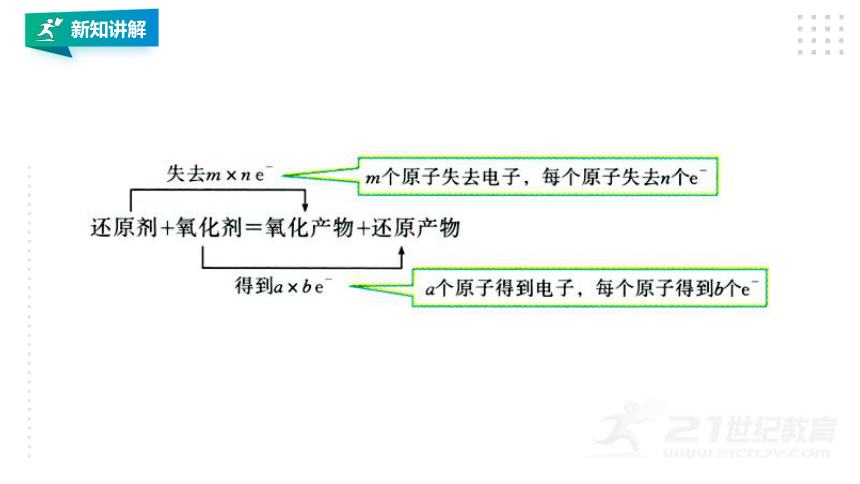
③写得失:在桥线上标出得失电子数,格式为“得到(失去)a×b
e-”
其中a表示发生氧化还原反应的原子个数,b表示每个原子得到或失去的电子数(看化合价的变化),当a=1或b=1时,将1省略。也可直接用转移电子的总数表示a×b。
④查守恒:检查得失电子是否守恒
CuO+H2
?
Cu+H2O
+2
0
0
+1
得到2e-
失去2×e-
新知讲解
新知讲解
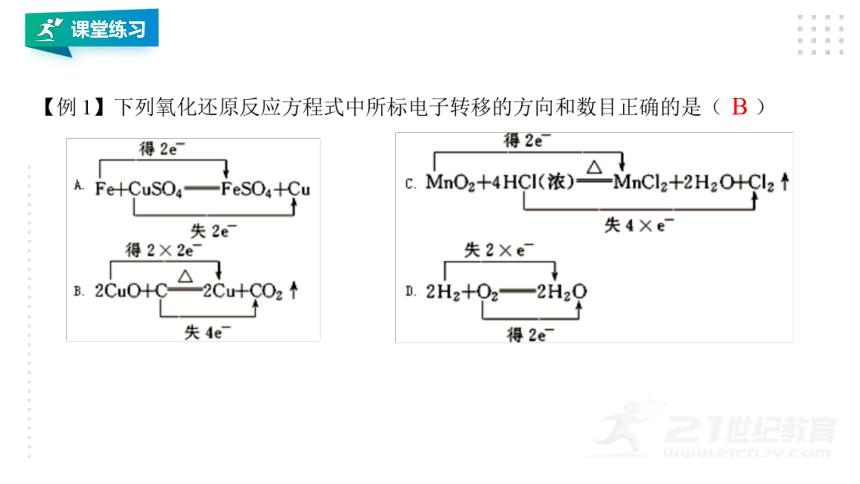
B
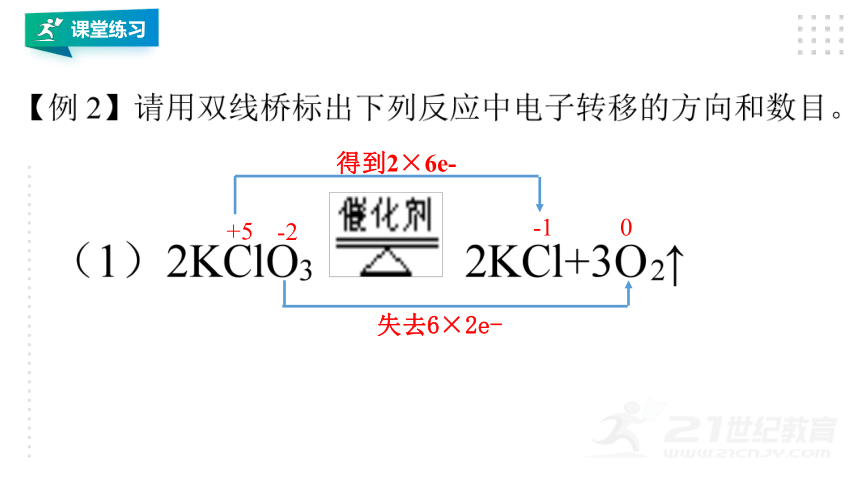
课堂练习
+5
0
-2
-1
得到2×6e-
失去6×2e-
课堂练习
课堂练习
单线桥法
2
(1)含义
表明反应前后氧化剂和还原剂之间的电子转移情况
新知讲解
(2)步骤
①标变价
②连单线
箭头从化合价______的元素指向化合价_________的元素
③写数目
在桥线上标出电子转移总数(注:_____得失,只写“ne-”)
CuO+H2
?
Cu+H2O
+2
0
0
+1
升高
降低
2e-
不写
新知讲解
4e-
6e-
-2
0
0
+4
+4
+3
+2
课堂练习
4e-
5e-
课堂练习
B
课堂练习
B
课堂练习
二、方程式的配平
新知讲解
方法
1
利用双线桥法配平
步骤
2
(1)标变价
(2)连双线
___Cu+___HNO3(浓)=___Cu(NO3)2+___NO2↑+__H2O
+5
+2
0
+4
(3)写得失(注意下标)
(4)定数目:通过最小公倍数使___________守恒
(5)查收恒:再根据原子守恒和电荷守恒(适用于离子方程式)配平剩余不变价的物质,最后检查
___Cu+___HNO3(浓)=___Cu(NO3)2+___NO2↑+__H2O
+5
+2
0
+4
失去2e-
得到e-
得失电子
×2
2
2
1
1
4
2
新知讲解
【例6】配平下列反应方程式
(1)____Cu+____HNO3=_____Cu(NO3)2+_____NO↑+_____H2O
(2)____Cl2
+
____NH3
=
____NH4Cl
+
____N2
(3)____P4+____KOH+____H2O=____K3PO4+____PH3
(4)____KI+____KIO3+____H2SO4
=____I2+____K2SO4+____H2O
3
8
3
2
4
3
8
6
1
2
9
3
3
5
5
1
3
3
3
3
课堂练习
(5)____MnO4-+____H++____Cl-=____Mn2++____Cl2↑+____H2O
(6)___ClO-+___Fe(OH)3+_______=___Cl-+____FeO42-+____H2O
(7)____ClO3-+_____Fe2++_______
=
_____Cl-+_____Fe3++________
2
16
10
2
5
8
3
2
3
2
4OH-
5
1
6
1
6
6H+
3H2O
课堂练习
https://www.21cnjy.com/help/help_extract.php
必修第一册
人教版
高一上
第二章
化学物质及其变化
第一节
物质的分类
第三节
氧化还原反应
第二节
离子反应
CONTENTS
本节内容
方程式的配平
二
电子转移的表示方法
一
一、电子转移的表示方法
新知讲解
双线桥法
1
(1)含义
表明氧化还原反应前后同一种元素原子或离子间的电子转移情况
(2)步骤
①标变价
②连双线
将不同价态的同种元素用桥线相连,箭头从________指向_______
(注意:箭头的起止对准元素)
CuO+H2
?
Cu+H2O
+2
0
0
+1
反应物
生成物
新知讲解
③写得失:在桥线上标出得失电子数,格式为“得到(失去)a×b
e-”
其中a表示发生氧化还原反应的原子个数,b表示每个原子得到或失去的电子数(看化合价的变化),当a=1或b=1时,将1省略。也可直接用转移电子的总数表示a×b。
④查守恒:检查得失电子是否守恒
CuO+H2
?
Cu+H2O
+2
0
0
+1
得到2e-
失去2×e-
新知讲解
新知讲解
B
课堂练习
+5
0
-2
-1
得到2×6e-
失去6×2e-
课堂练习
课堂练习
单线桥法
2
(1)含义
表明反应前后氧化剂和还原剂之间的电子转移情况
新知讲解
(2)步骤
①标变价
②连单线
箭头从化合价______的元素指向化合价_________的元素
③写数目
在桥线上标出电子转移总数(注:_____得失,只写“ne-”)
CuO+H2
?
Cu+H2O
+2
0
0
+1
升高
降低
2e-
不写
新知讲解
4e-
6e-
-2
0
0
+4
+4
+3
+2
课堂练习
4e-
5e-
课堂练习
B
课堂练习
B
课堂练习
二、方程式的配平
新知讲解
方法
1
利用双线桥法配平
步骤
2
(1)标变价
(2)连双线
___Cu+___HNO3(浓)=___Cu(NO3)2+___NO2↑+__H2O
+5
+2
0
+4
(3)写得失(注意下标)
(4)定数目:通过最小公倍数使___________守恒
(5)查收恒:再根据原子守恒和电荷守恒(适用于离子方程式)配平剩余不变价的物质,最后检查
___Cu+___HNO3(浓)=___Cu(NO3)2+___NO2↑+__H2O
+5
+2
0
+4
失去2e-
得到e-
得失电子
×2
2
2
1
1
4
2
新知讲解
【例6】配平下列反应方程式
(1)____Cu+____HNO3=_____Cu(NO3)2+_____NO↑+_____H2O
(2)____Cl2
+
____NH3
=
____NH4Cl
+
____N2
(3)____P4+____KOH+____H2O=____K3PO4+____PH3
(4)____KI+____KIO3+____H2SO4
=____I2+____K2SO4+____H2O
3
8
3
2
4
3
8
6
1
2
9
3
3
5
5
1
3
3
3
3
课堂练习
(5)____MnO4-+____H++____Cl-=____Mn2++____Cl2↑+____H2O
(6)___ClO-+___Fe(OH)3+_______=___Cl-+____FeO42-+____H2O
(7)____ClO3-+_____Fe2++_______
=
_____Cl-+_____Fe3++________
2
16
10
2
5
8
3
2
3
2
4OH-
5
1
6
1
6
6H+
3H2O
课堂练习
https://www.21cnjy.com/help/help_extract.php
