2020-2021学年高二化学人教版(2019)选择性必修1第二章 第一节 第二课时 影响化学反应速率的因素课件(32张ppt)
文档属性
| 名称 | 2020-2021学年高二化学人教版(2019)选择性必修1第二章 第一节 第二课时 影响化学反应速率的因素课件(32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 439.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-01 18:38:06 | ||
图片预览










文档简介
(共32张PPT)
第二章
化学反应速率和化学平衡
第一章
第二节
影响化学反应速率的因素
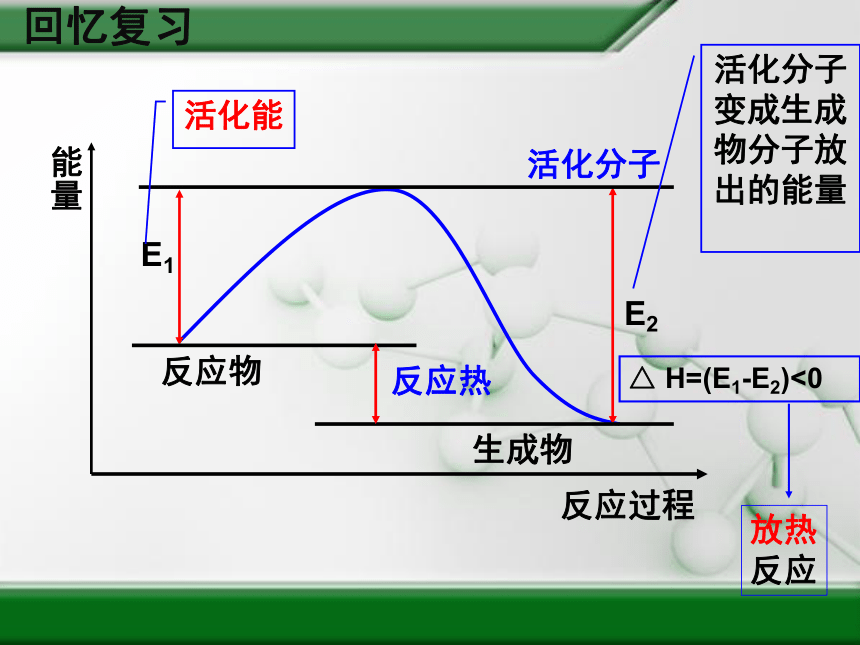
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
△
H=(E1-E2)<0
放热
反应
回忆复习
影响化学反应速率的因素
1、内因:
由物质结构和性质决定,非人为因素所能左右!
2、外因:
浓度
温度
压强
催化剂
其他条件:
固体颗粒物的大小、溶剂的性质等
Why?
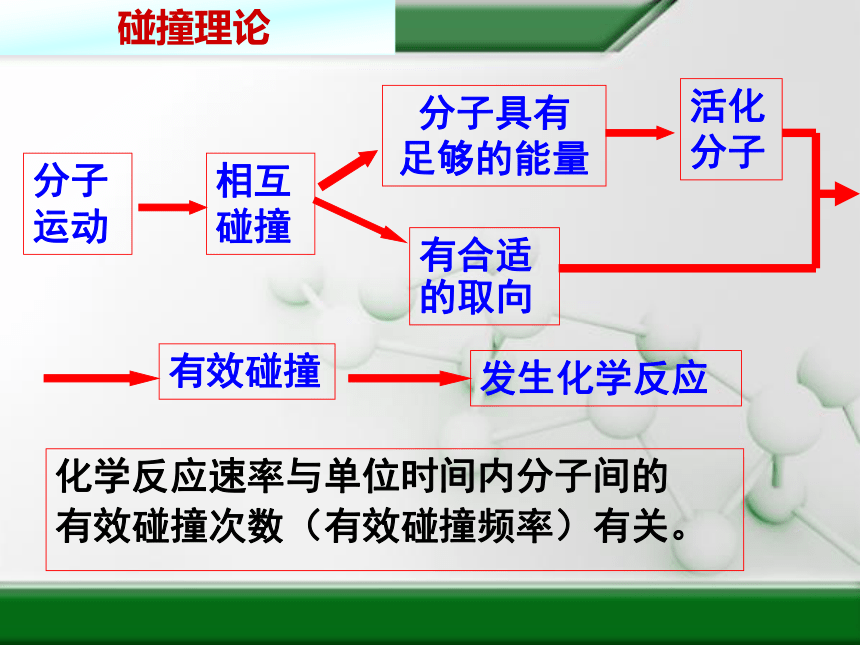
分子运动
相互碰撞
分子具有
足够的能量
活化分子
有合适
的取向
有效碰撞
发生化学反应
化学反应速率与单位时间内分子间的
有效碰撞次数(有效碰撞频率)有关。
碰撞理论
1.活化分子与有效碰撞的关系
能够发生有效碰撞的一定是活化分子,但是活化分子不一定发生有效碰撞。并不是反应物分子之间的任何一次直接碰撞都能发生反应,只有那些能量相当高的分子之间的直接碰撞才能发生反应。
2.单位体积内的活化分子数与活化分子百分数
单位体积内的活化分子数就是指单位体积内能量达到一定要求的分子的总数;而活化分子百分数是活化分子数/总分子数的比值,总分子数包含:活化分子数以及普通分子的个数。
活化分子数
=反应物总分子数X活化分子百分数
4、活化分子数
3.活化能与化学反应速率的关系
活化能小→普通分子容易变成活化分子→活化分子百分数大→单位体积内活化分子数多→单位时间、单位体积内有效碰撞次数多→化学反应速率大(内因对化学反应速率的影响)。
化学反应发生必须满足的条件:
1、分子间必须碰撞;
2、属于活化分子;
3、分子碰撞的取向合适。
【解析】 有效碰撞指活化分子之间发生合适取向的碰撞。
2.下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应;②普通分子间的碰撞有时也能发生化学反应;③反应物活化能越大,反应越快;④化学反应的实质是原子的重新组合;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程;⑥化学反应的实质是活化分子有合适取向时的有效碰撞。
A.①③④⑤
B.②③⑥
C.④⑤⑥
D.②④⑤
C
浓度对化学反应速率的影响
其他条件相同时,增大反应物浓度反应速率加快,反之减慢
试验中发生了如下反应:
2KMnO4
+
5H2C2O4
+
3H2SO4
==
K2SO4
+
2MnSO4
+
10CO2↑+
8H2O
实验现象:
加入较浓的草酸溶液的试管溶液褪色更快些。
实验结论∶
适用条件:
有气体和溶液参加的反应
1.浓度对反应速率影响的理解
(1)固体或纯液体的浓度为常数,所以增加其用量时,化学反应速率不变。
(2)增大固体的表面积或将固体溶于一定溶剂,能增大化学反应速率。
(3)增大反应物浓度,即增大了单位体积内活化分子的数目,但活化分子的
百分数没有增大。
2021/7/1
江西省鹰潭市第一中学
桂耀荣
14
一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的
(
)
A.
Na2CO3晶体
B.
NaOH晶体
C.
水
D.
CuSO4晶体
巩固练习
C
影响化学反应速率的因素
压强对化学反应速率的影响
其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快。
(Ⅰ)
(
Ⅱ
)
压强增大
V2=1/2V1
C1
V1
n1
C2
V2
n2
C1=n1/V1
C2=n2/V2=n1/(1/2)V1=2C1
压强增大
→浓度增大
→单位体积内n活↑
→有效碰撞↑
对于有气体参加的反应,在其他条件不变时,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,气体体积增大,浓度减小,反应速率减慢。
压强
增大
体积减小
其他条件不变
→V↑
→C增大
①P增大→C成比例增大,P减小→C成比例减小。
②压强只对于有气体参加的反应的速率有影响。
【结论】
【规律】
【注意】
对无气体参加的化学反应,改变压强时,化学反应速率基本不变。如MgO+2HCl===MgCl2+H2O。
例题.增大压强(缩小反应容器体积)对下列反应的反应速率几乎无影响的是( )
A.2H2O+O2===2H2O2
B.NH3+HCl===NH4Cl
C.AgNO3+NaCl===AgCl↓+NaNO3
D.3Fe+4H2O(g)
Fe3O4+4H2
C【解析】 增大压强对有气体参加反应的反应速率有影响。
2021/7/1
18
注意
恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。
压强的“真变”与“假变”
压强对速率的影响是通过改变气体的浓度来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。
影响化学反应速率的因素
压强
浓度
V↑
体积
①恒温
②恒温恒容
a.充入反应物气体
C↑
压强
b.充入惰性气体
V↑
V不变
③恒温恒压
a.充入反应物气体
C不变
V
b.充入惰性气体
V不变
P不变
C反不变
压强
V
P不变
C反
V
2021/7/1
20
在C(固)+CO2(气)=2CO(气)
的反应中。
现采取下列措施:
(1)增大压强
;(2)增加碳的量
(3)通入CO2;
(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
巩固练习
影响化学反应速率的因素
温度对化学反应速率的影响
【实验2-3】
试验中发生了如下反应:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
实验现象:
温度高的溶液先出现浑浊。
实验结论∶
1.其他条件不变,温度升高,反应速率加快。
【规律】
2、一般说来,温度每升高10℃,反应速率
增加2-4倍。
催化剂对化学反应速率的影响
【实验2-4】
实验现象:
加入MnO2化学反应速率加快
实验结论∶
加入催化剂可以加快反应的速率
1.催化剂的定义:
——能改变化学反应速率而自身的化学的组成和质量在反应前后保持不变的物质。
正催化剂:
负催化剂:
2.催化剂的分类:
加快化学反应速率。
减慢化学反应速率。
理论分析
能量
反应过程
E1
E2
反应物
生成物
活化分子
反应热
没加催化剂
加催化剂
催化反应与无催化反应过程中的能量关系图
加入催化剂
→降低反应的活化能
→
→单位体积内活%↑
→v↑
n活↑
→单位时间有效碰撞次数增加
理论分析
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
加了催化剂
没加
催化剂
E3
活化能降低
△
H=(E1-E2)<0
放热
反应
①使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
②没特别指明一般指正催化剂
。
③催化剂只能催化可能发生的反应,对不发生的反应无作用。
④催化剂一定的具有选择性
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
【注意事项】
总结
活化分子数
=反应物总分子数X活化分子百分数
活化分子数:
要增大反应速率就要增大活化分子数
增大活化分子数的方法
①增大反应物总分子数:增大反应物的浓度
(增大压强、加入反应物)
②增大活化分子百分数:升高温度、加催化剂
外界条件
变化情况
单位体积内分子数
活化分子百分率
单位体积内活化分子数
单位时间单位体积内有效碰撞数
化学反应速率
浓度
温度
外界条件对化学反应速率影响结果的原因
增大
增大
增加
加快
减小
减小
减慢
升高
不变
增加
增加
降低
减少
减慢
不变
不变
不变
增加
增加
减少
减少
减少
减少
加快
外界条件
变化情况
单位体积内分子数
活化分子百分率
单位体积内活化分子数
单位时间单位体积内有效碰撞数
化学反应速率
压强
催化剂
增大
增加
不变
增加
加快
减小
减少
不变
减慢
减慢
正催化剂
负催化剂
不变
不变
减小
加快
增加
增加
增加
增加
减少
减少
减少
减少
压强
浓度
V↑
体积
①恒温
②恒温恒容
a.充入反应物气体
C↑
压强
b.充入惰性气体
V↑
V不变
③恒温恒压
a.充入反应物气体
C不变
V
b.充入惰性气体
V不变
P不变
C反不变
压强
V
P不变
C反
V
第二章
化学反应速率和化学平衡
第一章
第二节
影响化学反应速率的因素
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
△
H=(E1-E2)<0
放热
反应
回忆复习
影响化学反应速率的因素
1、内因:
由物质结构和性质决定,非人为因素所能左右!
2、外因:
浓度
温度
压强
催化剂
其他条件:
固体颗粒物的大小、溶剂的性质等
Why?
分子运动
相互碰撞
分子具有
足够的能量
活化分子
有合适
的取向
有效碰撞
发生化学反应
化学反应速率与单位时间内分子间的
有效碰撞次数(有效碰撞频率)有关。
碰撞理论
1.活化分子与有效碰撞的关系
能够发生有效碰撞的一定是活化分子,但是活化分子不一定发生有效碰撞。并不是反应物分子之间的任何一次直接碰撞都能发生反应,只有那些能量相当高的分子之间的直接碰撞才能发生反应。
2.单位体积内的活化分子数与活化分子百分数
单位体积内的活化分子数就是指单位体积内能量达到一定要求的分子的总数;而活化分子百分数是活化分子数/总分子数的比值,总分子数包含:活化分子数以及普通分子的个数。
活化分子数
=反应物总分子数X活化分子百分数
4、活化分子数
3.活化能与化学反应速率的关系
活化能小→普通分子容易变成活化分子→活化分子百分数大→单位体积内活化分子数多→单位时间、单位体积内有效碰撞次数多→化学反应速率大(内因对化学反应速率的影响)。
化学反应发生必须满足的条件:
1、分子间必须碰撞;
2、属于活化分子;
3、分子碰撞的取向合适。
【解析】 有效碰撞指活化分子之间发生合适取向的碰撞。
2.下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应;②普通分子间的碰撞有时也能发生化学反应;③反应物活化能越大,反应越快;④化学反应的实质是原子的重新组合;⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程;⑥化学反应的实质是活化分子有合适取向时的有效碰撞。
A.①③④⑤
B.②③⑥
C.④⑤⑥
D.②④⑤
C
浓度对化学反应速率的影响
其他条件相同时,增大反应物浓度反应速率加快,反之减慢
试验中发生了如下反应:
2KMnO4
+
5H2C2O4
+
3H2SO4
==
K2SO4
+
2MnSO4
+
10CO2↑+
8H2O
实验现象:
加入较浓的草酸溶液的试管溶液褪色更快些。
实验结论∶
适用条件:
有气体和溶液参加的反应
1.浓度对反应速率影响的理解
(1)固体或纯液体的浓度为常数,所以增加其用量时,化学反应速率不变。
(2)增大固体的表面积或将固体溶于一定溶剂,能增大化学反应速率。
(3)增大反应物浓度,即增大了单位体积内活化分子的数目,但活化分子的
百分数没有增大。
2021/7/1
江西省鹰潭市第一中学
桂耀荣
14
一定量的盐酸跟过量的铁粉反应时,为了减慢反应速率,而不影响生成H2的总量,可向其中加入适量的
(
)
A.
Na2CO3晶体
B.
NaOH晶体
C.
水
D.
CuSO4晶体
巩固练习
C
影响化学反应速率的因素
压强对化学反应速率的影响
其他条件不变,增大压强,气体体积缩小,浓度增大,反应速率加快。
(Ⅰ)
(
Ⅱ
)
压强增大
V2=1/2V1
C1
V1
n1
C2
V2
n2
C1=n1/V1
C2=n2/V2=n1/(1/2)V1=2C1
压强增大
→浓度增大
→单位体积内n活↑
→有效碰撞↑
对于有气体参加的反应,在其他条件不变时,增大压强,气体体积缩小,浓度增大,反应速率加快;减小压强,气体体积增大,浓度减小,反应速率减慢。
压强
增大
体积减小
其他条件不变
→V↑
→C增大
①P增大→C成比例增大,P减小→C成比例减小。
②压强只对于有气体参加的反应的速率有影响。
【结论】
【规律】
【注意】
对无气体参加的化学反应,改变压强时,化学反应速率基本不变。如MgO+2HCl===MgCl2+H2O。
例题.增大压强(缩小反应容器体积)对下列反应的反应速率几乎无影响的是( )
A.2H2O+O2===2H2O2
B.NH3+HCl===NH4Cl
C.AgNO3+NaCl===AgCl↓+NaNO3
D.3Fe+4H2O(g)
Fe3O4+4H2
C【解析】 增大压强对有气体参加反应的反应速率有影响。
2021/7/1
18
注意
恒容时加入稀有气体使压强增大,反应物和生成
物的浓度都没有变化,所以化学反应速率不变。
恒压时加入稀有气体使体积增大,反应物和生成
物的浓度都减小,所以化学反应速率减小。
压强的“真变”与“假变”
压强对速率的影响是通过改变气体的浓度来改变的;若压强变化之后,气体的浓度未变,其化学反应速率不变。
影响化学反应速率的因素
压强
浓度
V↑
体积
①恒温
②恒温恒容
a.充入反应物气体
C↑
压强
b.充入惰性气体
V↑
V不变
③恒温恒压
a.充入反应物气体
C不变
V
b.充入惰性气体
V不变
P不变
C反不变
压强
V
P不变
C反
V
2021/7/1
20
在C(固)+CO2(气)=2CO(气)
的反应中。
现采取下列措施:
(1)增大压强
;(2)增加碳的量
(3)通入CO2;
(4)恒容下充入N2;
(5)恒压下充入N2
哪些措施能够使反应速率增大?为什么?
答案:(1)(3)
巩固练习
影响化学反应速率的因素
温度对化学反应速率的影响
【实验2-3】
试验中发生了如下反应:
Na2S2O3+H2SO4=Na2SO4+SO2+S↓+H2O
实验现象:
温度高的溶液先出现浑浊。
实验结论∶
1.其他条件不变,温度升高,反应速率加快。
【规律】
2、一般说来,温度每升高10℃,反应速率
增加2-4倍。
催化剂对化学反应速率的影响
【实验2-4】
实验现象:
加入MnO2化学反应速率加快
实验结论∶
加入催化剂可以加快反应的速率
1.催化剂的定义:
——能改变化学反应速率而自身的化学的组成和质量在反应前后保持不变的物质。
正催化剂:
负催化剂:
2.催化剂的分类:
加快化学反应速率。
减慢化学反应速率。
理论分析
能量
反应过程
E1
E2
反应物
生成物
活化分子
反应热
没加催化剂
加催化剂
催化反应与无催化反应过程中的能量关系图
加入催化剂
→降低反应的活化能
→
→单位体积内活%↑
→v↑
n活↑
→单位时间有效碰撞次数增加
理论分析
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
活化分子变成生成物分子放出的能量
反应热
加了催化剂
没加
催化剂
E3
活化能降低
△
H=(E1-E2)<0
放热
反应
①使用催化剂同等程度的增大(减慢)正逆反应速率,从而改变反应到达平衡所需时间。
②没特别指明一般指正催化剂
。
③催化剂只能催化可能发生的反应,对不发生的反应无作用。
④催化剂一定的具有选择性
⑤催化剂中毒:催化剂的活性因接触少量的杂质而明显下降甚至遭到破坏,这种现象叫催化剂中毒。
【注意事项】
总结
活化分子数
=反应物总分子数X活化分子百分数
活化分子数:
要增大反应速率就要增大活化分子数
增大活化分子数的方法
①增大反应物总分子数:增大反应物的浓度
(增大压强、加入反应物)
②增大活化分子百分数:升高温度、加催化剂
外界条件
变化情况
单位体积内分子数
活化分子百分率
单位体积内活化分子数
单位时间单位体积内有效碰撞数
化学反应速率
浓度
温度
外界条件对化学反应速率影响结果的原因
增大
增大
增加
加快
减小
减小
减慢
升高
不变
增加
增加
降低
减少
减慢
不变
不变
不变
增加
增加
减少
减少
减少
减少
加快
外界条件
变化情况
单位体积内分子数
活化分子百分率
单位体积内活化分子数
单位时间单位体积内有效碰撞数
化学反应速率
压强
催化剂
增大
增加
不变
增加
加快
减小
减少
不变
减慢
减慢
正催化剂
负催化剂
不变
不变
减小
加快
增加
增加
增加
增加
减少
减少
减少
减少
压强
浓度
V↑
体积
①恒温
②恒温恒容
a.充入反应物气体
C↑
压强
b.充入惰性气体
V↑
V不变
③恒温恒压
a.充入反应物气体
C不变
V
b.充入惰性气体
V不变
P不变
C反不变
压强
V
P不变
C反
V
