陕西省西安市阎良区2020-2021学年高一下学期期末考试化学试题 含答案
文档属性
| 名称 | 陕西省西安市阎良区2020-2021学年高一下学期期末考试化学试题 含答案 |

|
|
| 格式 | zip | ||
| 文件大小 | 772.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-04 00:00:00 | ||
图片预览



文档简介
阎良区2020~2021学年度第二学期期末质量检测
高一化学
注意事项:
1.
本试卷共6页,全卷满分100分,答题时间90分钟;
2.
答卷前,考生须准确填写自己的姓名、准考证号,并认真核准条形码上的姓名、准考证号;
3.
第Ⅰ卷选择题必须使用2B铅笔填涂,第Ⅱ卷非选择题必须使用0.5毫米黑色墨水签字笔书写,涂写要工整、清晰;
4.
考试结束后,监考员将答题卡按顺序收回,装袋整理;试题卷不回收。
可能用到的相对原子质量:—1
—12
—16
第Ⅰ卷(选择题
共48分)
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
1.
糖尿病人由于身体原因,其尿液中葡萄糖含量偏高,下列物质可用于糖尿病检验的是
A.
新制氢氧化铜
B.
氢氧化钠溶液
C.
乙醇
D.
乙酸
2.
第十四届全运会将于2021年9月15日在西安举行,丙烷为全运会火炬的主要燃料,其在氧气中完全燃烧生成二氧化碳和水。下列相关微粒的化学用语不正确的是
A.
丙烷分子的球棍模型:
B.
中子数为10的氧原子符号:
C.
二氧化碳的结构式:O=C=O
D.
水的电子式:
3.
下列电池工作时能量转化形式与其它三个不同的是
A.
锌锰碱性电池
B.
硅太阳能电池
C.
铅蓄电池
D.
银锌纽扣电池
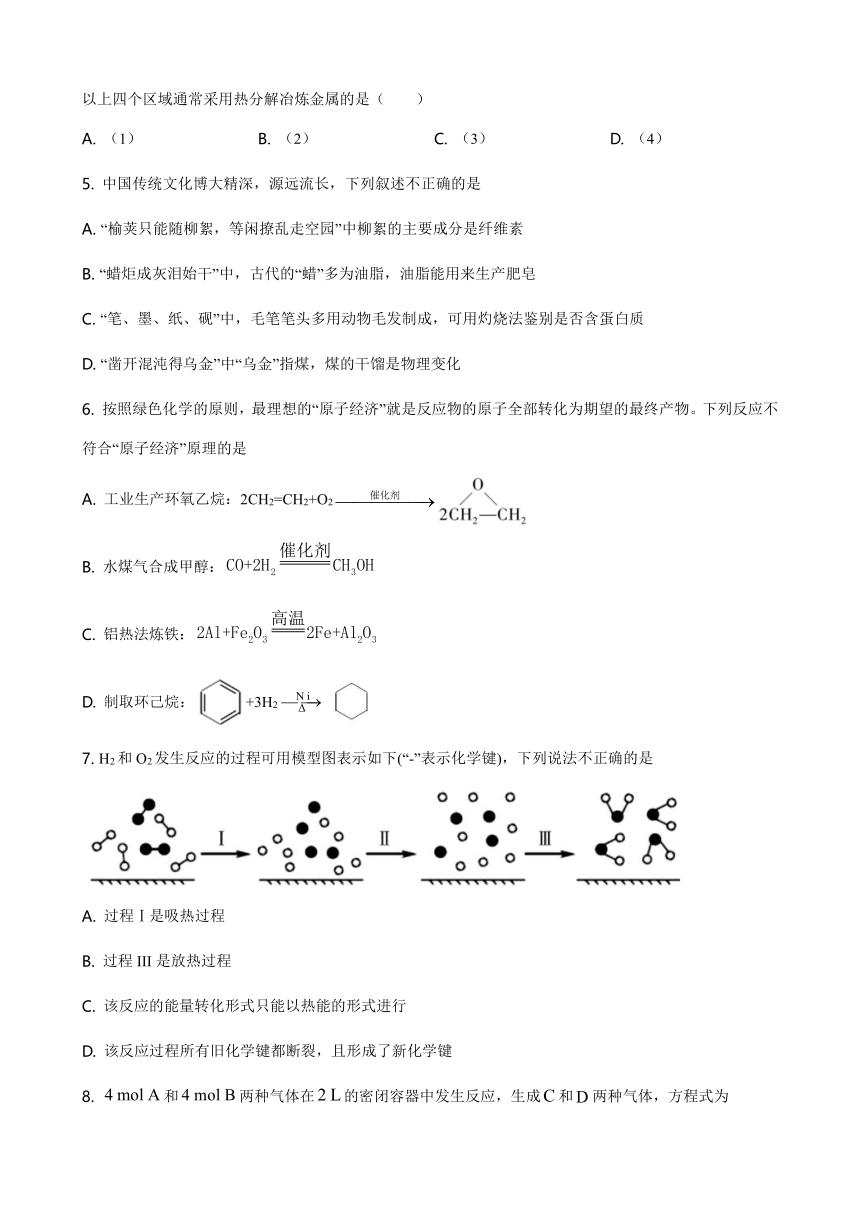
4.
金属活动性表:
以上四个区域通常采用热分解冶炼金属的是(
)
A.
(1)
B.
(2)
C.
(3)
D.
(4)
5.
中国传统文化博大精深,源远流长,下列叙述不正确的是
A.
“榆荚只能随柳絮,等闲撩乱走空园”中柳絮的主要成分是纤维素
B.
“蜡炬成灰泪始干”中,古代的“蜡”多为油脂,油脂能用来生产肥皂
C.
“笔、墨、纸、砚”中,毛笔笔头多用动物毛发制成,可用灼烧法鉴别是否含蛋白质
D.
“凿开混沌得乌金”中“乌金”指煤,煤的干馏是物理变化
6.
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。下列反应不符合“原子经济”原理的是
A.
工业生产环氧乙烷:2CH2=CH2+O2
B.
水煤气合成甲醇:
C.
铝热法炼铁:
D.
制取环己烷:+3H2
7.
H2和O2发生反应的过程可用模型图表示如下(“-”表示化学键),下列说法不正确的是
A.
过程Ⅰ是吸热过程
B.
过程III是放热过程
C.
该反应的能量转化形式只能以热能的形式进行
D.
该反应过程所有旧化学键都断裂,且形成了新化学键
8.
和两种气体在的密闭容器中发生反应,生成和两种气体,方程式为。前内,的平均反应速率为,则时,容器中的物质的量浓度为
A.
B.
C.
D.
9.
下列有机化学反应方程式书写及反应类型均正确的是
A.
nCH2=CH2
加聚反应
B.
加成反应
C.
氧化反应
D.
取代反应
10.
下列根据事实推出的结论正确的是
选项
事实
结论
A
Na在空气中燃烧生成Na2O2
Li在空气中燃烧生成Li2O2
B
浓硫酸可以干燥HCl气体
用浓硫酸干燥HI气体
C
D
硅是半导体材料
锗也是半导体材料
A.
A
B.
B
C.
C
D.
D
11.
某恒温恒容的密闭容器中发生反应:,下列判断反应达到平衡的标志是
A.
断开1
molH-H键的同时断开2
molH-I键
B.
混合气体的总压强不再变化
C.
c(H2)和c(I2)保持相等
D.
H2、I2、HI的分子数之比为1:1:2
12.
分子式为C4H8Cl2有机物共有(不含立体异构)
A.
7种
B.
8种
C.
9种
D.
10种
13.
关于乙醇和钠反应的叙述,正确的是
A.
钠浮在乙醇上面,四处游动
B.
钠与乙醇的反应比与水的反应剧烈
C.
乙醇中羟基氢原子不如水中氢原子活泼
D.
等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3∶1
14.
、、、、为原子序数依次增大的短周期主族元素,原子核外电子总数与原子次外层电子数相同;所在周期数与族序数相同;与同族。下列叙述不正确的是
A.
原子半径:
B.
元素最高正价为+6
C.
与、均可形成多种化合物
D.
、、、的简单离子的电子层结构相同
15.
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图,下列说法正确的是
A.
处通入
B.
该装置将化学能最终转化为电能
C.
通入的电极反应式为
D.
处为电池正极,发生了还原反应
16.
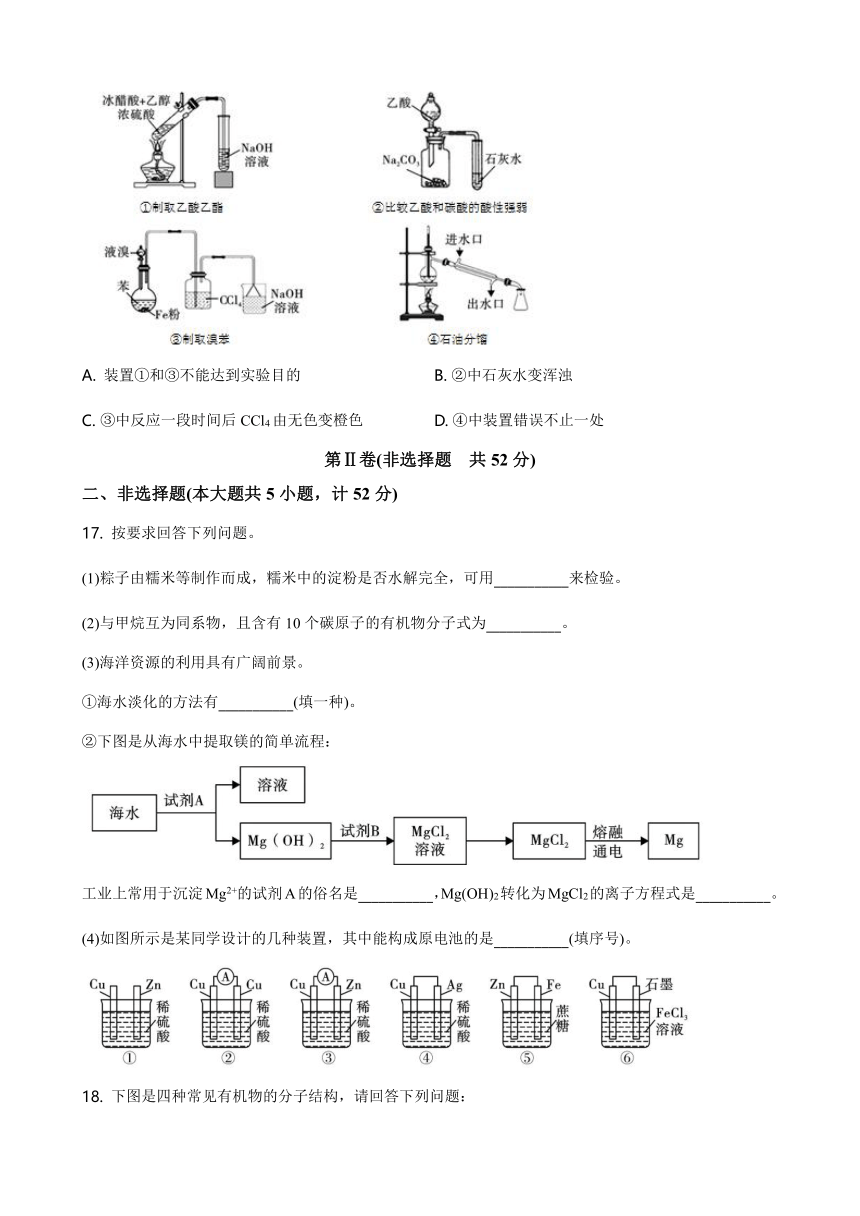
关于下列四种实验装置的叙述不正确的是
A.
装置①和③不能达到实验目的
B.
②中石灰水变浑浊
C.
③中反应一段时间后CCl4由无色变橙色
D.
④中装置错误不止一处
第Ⅱ卷(非选择题
共52分)
二、非选择题(本大题共5小题,计52分)
17.
按要求回答下列问题。
(1)粽子由糯米等制作而成,糯米中的淀粉是否水解完全,可用___________来检验。
(2)与甲烷互为同系物,且含有10个碳原子的有机物分子式为___________。
(3)海洋资源的利用具有广阔前景。
①海水淡化的方法有___________(填一种)。
②下图是从海水中提取镁的简单流程:
工业上常用于沉淀Mg2+的试剂A的俗名是___________,Mg(OH)2转化为MgCl2的离子方程式是___________。
(4)如图所示是某同学设计的几种装置,其中能构成原电池的是___________(填序号)。
18.
下图是四种常见有机物的分子结构,请回答下列问题:
(1)A分子的空间构型是___________。
(2)B具有的性质是___________(填序号)。
①无色无味液体
②有毒
③难溶于水
④密度比水大
(3)由B制备硝基苯的化学方程式为___________。
(4)B不能使酸性高锰酸钾溶液褪色,说明B分子中___________(填“存在”或“不存在”)碳碳单键与碳碳双键的交替结构。
(5)D中所含官能团的名称为___________。C与D发生酯化反应生成有香味的物质,其化学方程式为___________。
19.
下表为短周期主族元素原子半径和主要化合价,回答有关问题。
元素
①
②
③
④
⑤
⑥
⑦
⑧
原子半径()
0.74
160
0.53
1.10
0.99
0.89
0.75
1.43
最高或最低化合价
+2
+1
+5
+7
+2
+5
+3
-2
-3
-1
-3
(1)表中与元素⑧处于同一周期的元素有___________(填元素符号)。
(2)元素③和元素⑦能形成一种10电子化合物,画出该化合物的电子式___________。
(3)元素②和元素⑤形成的化合物是___________(填“离子化合物”或“共价化合物”)。
(4)①④⑦三种元素简单氢化物的稳定性由强到弱的顺序为___________(填化学式,下同),元素②、⑥的最高价氧化物对应的水化物中,碱性较强的是___________。
(5)请写出⑦的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式___________。
20.
化学反应中的能量和速率变化对生产生活有着重要意义。某研究学习小组同学进行下列探究活动。
(1)甲同学探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化。向装有铁片的试管中加入1
mol/L的H2SO4,观察到试管内有气泡产生,触摸试管外壁,温度升高。
①该反应为___________(填“放热”或“吸热”)反应。
②下列措施中,能加快氢气生成速率的是___________(填字母)。
a.将铁片改成铁粉
b.将稀H2SO4改成浓硫酸
c.加硫酸钠溶液
(2)乙同学认为原电池原理也可加快化学反应速率,他设计如图1所示实验装置。实验过程中可观察到的现象是___________。铁片上的电极反应式为___________。
(3)丙同学根据反应的发生条件,在老师的指导下,按如图2流程探究不同催化剂对NH3还原NO反应的催化性能。控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入一定体积滴有酚酞的稀硫酸中(溶液的体积、浓度均相同)。
①写出实验室用加热固体混合物的方法制备NH3的化学反应方程式___________。
②为比较不同催化剂催化性能,需要测量并记录的数据是___________。
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如图所示,则曲线___________(填序号)使用的催化剂催化性能最好,理由是___________。
21.
某同学为了探究甲烷、乙烯分别与卤素反应的情况,设计了以下实验,请回答问题。
Ⅰ.取2支硬质大试管,通过排饱和食盐水法先后各收集半试管甲烷和半试管氯气。分别用铁架台固定好,按如图的A、B装置进行实验,片刻后观察,补充并完成下列实验报告的内容。
实验操作及现象
实验结论
A
①在漫射日光条件下,试管内:___________、液面上方有___________形成、内壁上出现了油状液滴
③CH4与Cl2在___________条件下发生化学反应
B
②迅速剥开黑纸,立即观察:试管内气体颜色为黄绿色
④1
mol甲烷与足量Cl2发生取代反应时,得到最多的产物是___________(填化学式)。
Ⅱ.
探究乙烯与溴的加成反应。因实验室制得的乙烯中通常会含有少量的SO2等杂质气体,为此他设计了如图所示的实验装置:
(1)①②装置中可盛放的试剂是:①___________、②___________(填字母)。
A.
品红
B.
NaOH溶液
C.
溴水
D.
酸性高锰酸钾溶液
(2)除杂后观察到③中现象为___________,写出发生反应的化学方程式___________。
通过探究,该同学得出结论:甲烷和乙烯在不同条件下均能与卤素反应。
Ⅲ.
现有H2、Cl2、乙烷、乙烯这四种原料,请你设计一种制取一氯乙烷的最佳实验方案,请用化学方程式表示出来(注意:原料不一定要全部选用)___________。
高一化学参考答案
1.
A
2.
B
3.
B
4.
C
5.
D
6.
C
7.
C
8.B
9.
A
10.
D
11.
A
12.
C
13.
C
14.
D
15.
D
16.
A
17.
①.
碘水
②.
C10H22
③.
蒸馏法或电渗析法或离子交换法
④.
熟石灰或石灰乳
⑤.
Mg(OH)2+2H+=Mg2++2H2O
⑥.
③⑥
18.
①.
正四面体
②.
②③
③.
+HO-NO2+H2O
④.
不存在
⑤.
羧基
⑥.
CH3COOH+C2H5OHCH3COOC2H5+H2O
19.
①.
Mg、P、Cl
②.
③.
离子化合物
④.
H2O>NH3>PH3
⑤.
Mg(OH)2
⑥.
3Cu+8H++2=3Cu2++2NO↑+4H2O
20.
①.
放热
②.
a
③.
电流计指针偏转,铁片逐渐溶解,溶液由无色变为浅绿色,铜片上有气泡产生
④.
Fe-2e-=Fe2+
⑤.
Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
⑥.
溶液显色所需时间
⑦.
Ⅲ
⑧.
其它条件相同时,Ⅲ中NH3的物质的量减少的程度最快,反应速率最快,达平衡时间最短,所以催化剂的性能最好
21.
①.
黄绿色逐渐变浅,且液面上升
②.
白雾
③.
光照
④.
HCl
⑤.
B
⑥.
A
⑦.
溴水褪色
⑧.
CH2=CH2+Br2
CH2Br-CH2Br
⑨.
H2+Cl22HCl、CH2=CH2+HClCH3CH2Cl
高一化学
注意事项:
1.
本试卷共6页,全卷满分100分,答题时间90分钟;
2.
答卷前,考生须准确填写自己的姓名、准考证号,并认真核准条形码上的姓名、准考证号;
3.
第Ⅰ卷选择题必须使用2B铅笔填涂,第Ⅱ卷非选择题必须使用0.5毫米黑色墨水签字笔书写,涂写要工整、清晰;
4.
考试结束后,监考员将答题卡按顺序收回,装袋整理;试题卷不回收。
可能用到的相对原子质量:—1
—12
—16
第Ⅰ卷(选择题
共48分)
一、选择题(本大题共16小题,每小题3分,计48分。每小题只有一个选项是符合题意的)
1.
糖尿病人由于身体原因,其尿液中葡萄糖含量偏高,下列物质可用于糖尿病检验的是
A.
新制氢氧化铜
B.
氢氧化钠溶液
C.
乙醇
D.
乙酸
2.
第十四届全运会将于2021年9月15日在西安举行,丙烷为全运会火炬的主要燃料,其在氧气中完全燃烧生成二氧化碳和水。下列相关微粒的化学用语不正确的是
A.
丙烷分子的球棍模型:
B.
中子数为10的氧原子符号:
C.
二氧化碳的结构式:O=C=O
D.
水的电子式:
3.
下列电池工作时能量转化形式与其它三个不同的是
A.
锌锰碱性电池
B.
硅太阳能电池
C.
铅蓄电池
D.
银锌纽扣电池
4.
金属活动性表:
以上四个区域通常采用热分解冶炼金属的是(
)
A.
(1)
B.
(2)
C.
(3)
D.
(4)
5.
中国传统文化博大精深,源远流长,下列叙述不正确的是
A.
“榆荚只能随柳絮,等闲撩乱走空园”中柳絮的主要成分是纤维素
B.
“蜡炬成灰泪始干”中,古代的“蜡”多为油脂,油脂能用来生产肥皂
C.
“笔、墨、纸、砚”中,毛笔笔头多用动物毛发制成,可用灼烧法鉴别是否含蛋白质
D.
“凿开混沌得乌金”中“乌金”指煤,煤的干馏是物理变化
6.
按照绿色化学的原则,最理想的“原子经济”就是反应物的原子全部转化为期望的最终产物。下列反应不符合“原子经济”原理的是
A.
工业生产环氧乙烷:2CH2=CH2+O2
B.
水煤气合成甲醇:
C.
铝热法炼铁:
D.
制取环己烷:+3H2
7.
H2和O2发生反应的过程可用模型图表示如下(“-”表示化学键),下列说法不正确的是
A.
过程Ⅰ是吸热过程
B.
过程III是放热过程
C.
该反应的能量转化形式只能以热能的形式进行
D.
该反应过程所有旧化学键都断裂,且形成了新化学键
8.
和两种气体在的密闭容器中发生反应,生成和两种气体,方程式为。前内,的平均反应速率为,则时,容器中的物质的量浓度为
A.
B.
C.
D.
9.
下列有机化学反应方程式书写及反应类型均正确的是
A.
nCH2=CH2
加聚反应
B.
加成反应
C.
氧化反应
D.
取代反应
10.
下列根据事实推出的结论正确的是
选项
事实
结论
A
Na在空气中燃烧生成Na2O2
Li在空气中燃烧生成Li2O2
B
浓硫酸可以干燥HCl气体
用浓硫酸干燥HI气体
C
D
硅是半导体材料
锗也是半导体材料
A.
A
B.
B
C.
C
D.
D
11.
某恒温恒容的密闭容器中发生反应:,下列判断反应达到平衡的标志是
A.
断开1
molH-H键的同时断开2
molH-I键
B.
混合气体的总压强不再变化
C.
c(H2)和c(I2)保持相等
D.
H2、I2、HI的分子数之比为1:1:2
12.
分子式为C4H8Cl2有机物共有(不含立体异构)
A.
7种
B.
8种
C.
9种
D.
10种
13.
关于乙醇和钠反应的叙述,正确的是
A.
钠浮在乙醇上面,四处游动
B.
钠与乙醇的反应比与水的反应剧烈
C.
乙醇中羟基氢原子不如水中氢原子活泼
D.
等物质的量的乙醇和水分别与足量的钠反应,生成的气体体积比为3∶1
14.
、、、、为原子序数依次增大的短周期主族元素,原子核外电子总数与原子次外层电子数相同;所在周期数与族序数相同;与同族。下列叙述不正确的是
A.
原子半径:
B.
元素最高正价为+6
C.
与、均可形成多种化合物
D.
、、、的简单离子的电子层结构相同
15.
LED产品的使用为城市增添色彩。下图是氢氧燃料电池驱动LED发光的一种装置示意图,下列说法正确的是
A.
处通入
B.
该装置将化学能最终转化为电能
C.
通入的电极反应式为
D.
处为电池正极,发生了还原反应
16.
关于下列四种实验装置的叙述不正确的是
A.
装置①和③不能达到实验目的
B.
②中石灰水变浑浊
C.
③中反应一段时间后CCl4由无色变橙色
D.
④中装置错误不止一处
第Ⅱ卷(非选择题
共52分)
二、非选择题(本大题共5小题,计52分)
17.
按要求回答下列问题。
(1)粽子由糯米等制作而成,糯米中的淀粉是否水解完全,可用___________来检验。
(2)与甲烷互为同系物,且含有10个碳原子的有机物分子式为___________。
(3)海洋资源的利用具有广阔前景。
①海水淡化的方法有___________(填一种)。
②下图是从海水中提取镁的简单流程:
工业上常用于沉淀Mg2+的试剂A的俗名是___________,Mg(OH)2转化为MgCl2的离子方程式是___________。
(4)如图所示是某同学设计的几种装置,其中能构成原电池的是___________(填序号)。
18.
下图是四种常见有机物的分子结构,请回答下列问题:
(1)A分子的空间构型是___________。
(2)B具有的性质是___________(填序号)。
①无色无味液体
②有毒
③难溶于水
④密度比水大
(3)由B制备硝基苯的化学方程式为___________。
(4)B不能使酸性高锰酸钾溶液褪色,说明B分子中___________(填“存在”或“不存在”)碳碳单键与碳碳双键的交替结构。
(5)D中所含官能团的名称为___________。C与D发生酯化反应生成有香味的物质,其化学方程式为___________。
19.
下表为短周期主族元素原子半径和主要化合价,回答有关问题。
元素
①
②
③
④
⑤
⑥
⑦
⑧
原子半径()
0.74
160
0.53
1.10
0.99
0.89
0.75
1.43
最高或最低化合价
+2
+1
+5
+7
+2
+5
+3
-2
-3
-1
-3
(1)表中与元素⑧处于同一周期的元素有___________(填元素符号)。
(2)元素③和元素⑦能形成一种10电子化合物,画出该化合物的电子式___________。
(3)元素②和元素⑤形成的化合物是___________(填“离子化合物”或“共价化合物”)。
(4)①④⑦三种元素简单氢化物的稳定性由强到弱的顺序为___________(填化学式,下同),元素②、⑥的最高价氧化物对应的水化物中,碱性较强的是___________。
(5)请写出⑦的最高价氧化物对应水化物的稀溶液与铜反应的离子方程式___________。
20.
化学反应中的能量和速率变化对生产生活有着重要意义。某研究学习小组同学进行下列探究活动。
(1)甲同学探究反应Fe+H2SO4(稀)=FeSO4+H2↑中的能量变化。向装有铁片的试管中加入1
mol/L的H2SO4,观察到试管内有气泡产生,触摸试管外壁,温度升高。
①该反应为___________(填“放热”或“吸热”)反应。
②下列措施中,能加快氢气生成速率的是___________(填字母)。
a.将铁片改成铁粉
b.将稀H2SO4改成浓硫酸
c.加硫酸钠溶液
(2)乙同学认为原电池原理也可加快化学反应速率,他设计如图1所示实验装置。实验过程中可观察到的现象是___________。铁片上的电极反应式为___________。
(3)丙同学根据反应的发生条件,在老师的指导下,按如图2流程探究不同催化剂对NH3还原NO反应的催化性能。控制其他实验条件均相同,在催化反应器中装载不同的催化剂,将经催化反应后的混合气体通入一定体积滴有酚酞的稀硫酸中(溶液的体积、浓度均相同)。
①写出实验室用加热固体混合物的方法制备NH3的化学反应方程式___________。
②为比较不同催化剂催化性能,需要测量并记录的数据是___________。
③在不同催化剂时测得混合气体中NH3的物质的量与时间的关系如图所示,则曲线___________(填序号)使用的催化剂催化性能最好,理由是___________。
21.
某同学为了探究甲烷、乙烯分别与卤素反应的情况,设计了以下实验,请回答问题。
Ⅰ.取2支硬质大试管,通过排饱和食盐水法先后各收集半试管甲烷和半试管氯气。分别用铁架台固定好,按如图的A、B装置进行实验,片刻后观察,补充并完成下列实验报告的内容。
实验操作及现象
实验结论
A
①在漫射日光条件下,试管内:___________、液面上方有___________形成、内壁上出现了油状液滴
③CH4与Cl2在___________条件下发生化学反应
B
②迅速剥开黑纸,立即观察:试管内气体颜色为黄绿色
④1
mol甲烷与足量Cl2发生取代反应时,得到最多的产物是___________(填化学式)。
Ⅱ.
探究乙烯与溴的加成反应。因实验室制得的乙烯中通常会含有少量的SO2等杂质气体,为此他设计了如图所示的实验装置:
(1)①②装置中可盛放的试剂是:①___________、②___________(填字母)。
A.
品红
B.
NaOH溶液
C.
溴水
D.
酸性高锰酸钾溶液
(2)除杂后观察到③中现象为___________,写出发生反应的化学方程式___________。
通过探究,该同学得出结论:甲烷和乙烯在不同条件下均能与卤素反应。
Ⅲ.
现有H2、Cl2、乙烷、乙烯这四种原料,请你设计一种制取一氯乙烷的最佳实验方案,请用化学方程式表示出来(注意:原料不一定要全部选用)___________。
高一化学参考答案
1.
A
2.
B
3.
B
4.
C
5.
D
6.
C
7.
C
8.B
9.
A
10.
D
11.
A
12.
C
13.
C
14.
D
15.
D
16.
A
17.
①.
碘水
②.
C10H22
③.
蒸馏法或电渗析法或离子交换法
④.
熟石灰或石灰乳
⑤.
Mg(OH)2+2H+=Mg2++2H2O
⑥.
③⑥
18.
①.
正四面体
②.
②③
③.
+HO-NO2+H2O
④.
不存在
⑤.
羧基
⑥.
CH3COOH+C2H5OHCH3COOC2H5+H2O
19.
①.
Mg、P、Cl
②.
③.
离子化合物
④.
H2O>NH3>PH3
⑤.
Mg(OH)2
⑥.
3Cu+8H++2=3Cu2++2NO↑+4H2O
20.
①.
放热
②.
a
③.
电流计指针偏转,铁片逐渐溶解,溶液由无色变为浅绿色,铜片上有气泡产生
④.
Fe-2e-=Fe2+
⑤.
Ca(OH)2+2NH4ClCaCl2+2NH3↑+2H2O
⑥.
溶液显色所需时间
⑦.
Ⅲ
⑧.
其它条件相同时,Ⅲ中NH3的物质的量减少的程度最快,反应速率最快,达平衡时间最短,所以催化剂的性能最好
21.
①.
黄绿色逐渐变浅,且液面上升
②.
白雾
③.
光照
④.
HCl
⑤.
B
⑥.
A
⑦.
溴水褪色
⑧.
CH2=CH2+Br2
CH2Br-CH2Br
⑨.
H2+Cl22HCl、CH2=CH2+HClCH3CH2Cl
同课章节目录
