1.1_元素周期律课件(第1课时)
文档属性
| 名称 | 1.1_元素周期律课件(第1课时) |  | |
| 格式 | zip | ||
| 文件大小 | 623.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-19 15:58:35 | ||
图片预览











文档简介
(共38张PPT)
第二节
元素周期律
第一课时
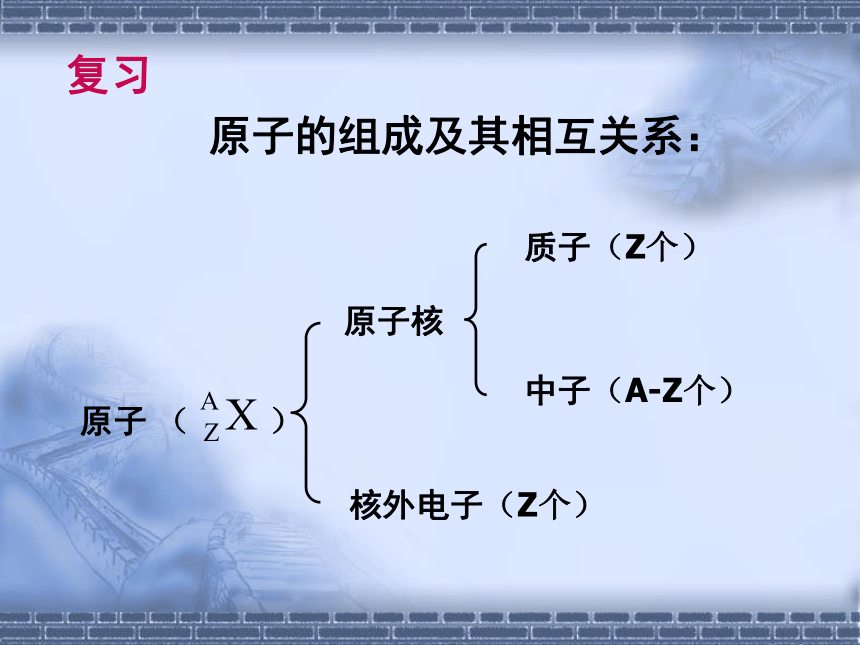
原子的组成及其相互关系:
原子核
核外电子(Z个)
质子(Z个)
中子(A-Z个)
原子 ( )
复习
位置关系:
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的;
体积关系:
原子很小,原子核更小(直径不及原子直径的万分之一),电子在核外作高速运动,所占的空间相对较大;
电荷关系:原子核带的电量跟核外电子的电量相等而电性相反,即:
核电荷数=核内质子数=核外电子数
质量关系:原子的质量主要集中在原子核上(原子核的密度极高),即原子的质量主要由质子和中子的质量决定;
原子的质量 所有质子的质量+所有中子的质量
质量数(A)=质子数(Z)+中子数(N)
一、核外电子的排布
1、核外电子运动的特点:
⑴电子的质量极微小(9.109 10-31kg);
⑵电子绕核运动是在原子这样极其微小的空间(原子的直径约10-10m)中进行;
⑶电子绕核作高速运动(运动的速度接近光速,约为108m/s)
那么核外电子运动的规律是什么呢?
2.核外电子排布规律:
核外电子受力分析:在含多个电子的原子中,一方面每个电子和核之间因带异性电荷而有吸引力,这个吸引力倾向于把电子尽可能拉得靠近核;另一方面,电子与电子之间带同性电荷而相互排斥,这个排斥力要迫使电子彼此尽可能远离。当吸引和排斥达成平衡时,核外电子就分布在离核不同的区域里运动,有不同的能量。
在含有多个电子的原子里,电子的能量是不同的。有些电子能量较低,在离核较近的区域里运动;有些电子能量较高,在离核较远的区域里运动。
科学上把能量不同的电子的运动区域称为电子层。把能量最低、离核最近的电子,称其运动在第一电子层上;能量稍高、运动在离核稍远的电子,称其运动在第二电子层上;由里向外,依次类推,叫三、四、五、六、七层。 也可把它们依次叫K、L、M、N、O、P、Q层。
规律1:核外电子是分层排布的。
规律2:电子一般总是尽先排布在能量最低的电子层里,即最先排布K层;当K层排满后,再排布L层;当L层排满后,再排布M层;……
那么,每个电子层最多可以排布多少个电子?首先研究一下稀有气体元素原子电子层排布的情况:
电子层数 n 1 2 3 4 5 6 7
K L M N O P Q
n越大,电子离核越远,其能量也越高
[练习]判断下列示意图是否正确?
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
从表中可看出,K层、L层、M层最多能排布的电子数目?
K-2,L-8,M-18
8个(氦原子是2个)
最外层电子数最多有几个?
试推断各电子层最多能容纳的电子数和电子层数之间有什么关系?
次外层不超过多少个?倒数第三层呢?
18个;32个
规律3:各电子层最多容纳的电子数是2n2(n表示电子层);
规律4:最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数目不超过18个,倒数第三层不超过32个
注:以上规律是相互联系的,不能孤立地机械地套用
核外电子排布的一般规律
能量最低
2n2
8
18
32
一低四不超。
注:以上规律是相互联系的,不能孤立地机械地套用
1. 核外电子总是尽先排布在 的电子层里;
即:排满 K 层才排L层;排满L层才排M层;
2. 最外层电子不能超过 个;
3. 次外层电子不能超过 个;
4. 倒数第三层电子不能超过 个。
5.每层电子不能超过 个;
1、某元素的原子核外有3个电子层,最外层有5个电子,该原子核内的质子数为
A 14 B 15 C 16 D 17
2、某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是
A Li B Si C Al D K
3、按核外电子排布规律,预测核电荷数为118的元素的原子核外电子层排布是
A 2、8、18、32、58
B 2、8、18、32、32、8
C 2、8、18、32、50、18、8
D 2、8、18、32、32、18、8
二、元素周期律
科学探究1 P14完成表格并总结归纳
结论:随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
课堂作业:根据核外电子排布规律,画出下列元素原子的结构示意图。
3Li、11Na、19K、37Rb、55Cs
9F、17Cl、35Br、53I
B
D
答案 B
A. B. C. D.
C
B
B
答案 D
第二节
元素周期律
第一课时
原子的组成及其相互关系:
原子核
核外电子(Z个)
质子(Z个)
中子(A-Z个)
原子 ( )
复习
位置关系:
原子是由居于原子中心的带正电的原子核和核外带负电的电子构成的;
体积关系:
原子很小,原子核更小(直径不及原子直径的万分之一),电子在核外作高速运动,所占的空间相对较大;
电荷关系:原子核带的电量跟核外电子的电量相等而电性相反,即:
核电荷数=核内质子数=核外电子数
质量关系:原子的质量主要集中在原子核上(原子核的密度极高),即原子的质量主要由质子和中子的质量决定;
原子的质量 所有质子的质量+所有中子的质量
质量数(A)=质子数(Z)+中子数(N)
一、核外电子的排布
1、核外电子运动的特点:
⑴电子的质量极微小(9.109 10-31kg);
⑵电子绕核运动是在原子这样极其微小的空间(原子的直径约10-10m)中进行;
⑶电子绕核作高速运动(运动的速度接近光速,约为108m/s)
那么核外电子运动的规律是什么呢?
2.核外电子排布规律:
核外电子受力分析:在含多个电子的原子中,一方面每个电子和核之间因带异性电荷而有吸引力,这个吸引力倾向于把电子尽可能拉得靠近核;另一方面,电子与电子之间带同性电荷而相互排斥,这个排斥力要迫使电子彼此尽可能远离。当吸引和排斥达成平衡时,核外电子就分布在离核不同的区域里运动,有不同的能量。
在含有多个电子的原子里,电子的能量是不同的。有些电子能量较低,在离核较近的区域里运动;有些电子能量较高,在离核较远的区域里运动。
科学上把能量不同的电子的运动区域称为电子层。把能量最低、离核最近的电子,称其运动在第一电子层上;能量稍高、运动在离核稍远的电子,称其运动在第二电子层上;由里向外,依次类推,叫三、四、五、六、七层。 也可把它们依次叫K、L、M、N、O、P、Q层。
规律1:核外电子是分层排布的。
规律2:电子一般总是尽先排布在能量最低的电子层里,即最先排布K层;当K层排满后,再排布L层;当L层排满后,再排布M层;……
那么,每个电子层最多可以排布多少个电子?首先研究一下稀有气体元素原子电子层排布的情况:
电子层数 n 1 2 3 4 5 6 7
K L M N O P Q
n越大,电子离核越远,其能量也越高
[练习]判断下列示意图是否正确?
稀有气体元素原子电子层排布
核电荷数 元素名称 元素符号 各电子层的电子数
K L M N O P
2 氦 He 2
10 氖 Ne 2 8
18 氩 Ar 2 8 8
36 氪 Kr 2 8 18 8
54 氙 Xe 2 8 18 18 8
86 氡 Rn 2 8 18 32 18 8
从表中可看出,K层、L层、M层最多能排布的电子数目?
K-2,L-8,M-18
8个(氦原子是2个)
最外层电子数最多有几个?
试推断各电子层最多能容纳的电子数和电子层数之间有什么关系?
次外层不超过多少个?倒数第三层呢?
18个;32个
规律3:各电子层最多容纳的电子数是2n2(n表示电子层);
规律4:最外层电子数不超过8个(K层是最外层时,最多不超过2个),次外层电子数目不超过18个,倒数第三层不超过32个
注:以上规律是相互联系的,不能孤立地机械地套用
核外电子排布的一般规律
能量最低
2n2
8
18
32
一低四不超。
注:以上规律是相互联系的,不能孤立地机械地套用
1. 核外电子总是尽先排布在 的电子层里;
即:排满 K 层才排L层;排满L层才排M层;
2. 最外层电子不能超过 个;
3. 次外层电子不能超过 个;
4. 倒数第三层电子不能超过 个。
5.每层电子不能超过 个;
1、某元素的原子核外有3个电子层,最外层有5个电子,该原子核内的质子数为
A 14 B 15 C 16 D 17
2、某元素的原子核外有三个电子层,M层的电子数是L层电子数的1/2,则该元素的原子是
A Li B Si C Al D K
3、按核外电子排布规律,预测核电荷数为118的元素的原子核外电子层排布是
A 2、8、18、32、58
B 2、8、18、32、32、8
C 2、8、18、32、50、18、8
D 2、8、18、32、32、18、8
二、元素周期律
科学探究1 P14完成表格并总结归纳
结论:随着原子序数的递增,元素原子的电子层排布、原子半径和化合价都呈现周期性变化。
课堂作业:根据核外电子排布规律,画出下列元素原子的结构示意图。
3Li、11Na、19K、37Rb、55Cs
9F、17Cl、35Br、53I
B
D
答案 B
A. B. C. D.
C
B
B
答案 D
