2020-2021学年高二化学人教版选修5有机化学基础第一章第四节物质的分离提纯(1)课件(23张ppt)
文档属性
| 名称 | 2020-2021学年高二化学人教版选修5有机化学基础第一章第四节物质的分离提纯(1)课件(23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-04 19:25:34 | ||
图片预览








文档简介
(共23张PPT)
高中人教版
选修五
第一章
认识有机化合物
第4节
研究有机化合物的一般步骤和方法
(1)物质的分离提纯
口腔癌的发生率因近年来嚼食槟榔人口的增加而逐年上升。
槟榔里的成分有:酚类、多糖、脂肪、粗纤维、水分、灰分、生物碱和许多微量元素。
实验室中如何来研究槟榔中的成分?研究有机化合物的一般步骤和方法是什么?
新课引入:
研究有机物的一般步骤:
分离、
提纯
元素定量分析
确定实验式
测定相对分子质量
确定分子式
现代物理实验
方法确定结构式
粗产品
每一个操作步骤是怎样完成的呢?
一.
分离提纯:
1.
混合物分离中常用的操作有哪些?
2.
分离提纯的基本原则:
不增:
不减:
易分离:
易复原:
过滤、结晶、蒸馏、升华、萃取和分液等
不引入新杂质
不减少被提纯物
杂质转换为沉淀、气体等容易分离除去
被提纯物易复原
利用有机物与杂质物理性质的差异
1.
蒸馏
蒸馏法适用于分离、提纯什么有机物?对有机物与杂质的沸点差别有何要求?
b.
蒸馏装置主要仪器有哪些?
有哪些注意事项?
适用于分离、提纯互溶的液态有机物,该有机物的热稳定性较强,与杂质的沸点相差一般约大于30℃
。
蒸馏烧瓶、冷凝管(直形、球形、蛇形冷凝管和空冷凝管)
----分离、提纯液态有机物的常用方法。
利用混合物中各种成分的沸点不同,在蒸馏过程中低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
有机物热稳定性较强、含少量杂质、与杂质沸点相差较大(一般约大于30℃)
(2)条件:
(1)
原理
1.蒸馏
(3)注意事项
A.
仪器组装:“先下后上,由左至右”;
B.
加热蒸馏烧瓶需垫石棉网;
C.蒸馏烧瓶盛装的液体:
不超过容积的
2/3;
不得将全部溶液蒸干;需使用沸石;
D.冷凝水水流方向应与蒸汽流方向相反
(逆流:下进上出);
E.温度计水银球位置与蒸馏烧瓶支管口齐平,
以测量馏出蒸气的温度;
F.加热温度不能超过混合物中沸点最高物质的沸点,并利用移动酒精灯来调节温度.
G.实验开始时,先开冷凝水,后加热。实验结束时,先停止加热,后关冷凝水。
随堂练习
1.欲用96%的工业酒精制取无水乙醇时,可选用的
方法是(
)
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.
直接加热蒸馏出酒精
B
注:
当两种物质沸点相差不到30℃时,可先将杂质转化为离子化合物,然后利用蒸馏的方法进行除杂!
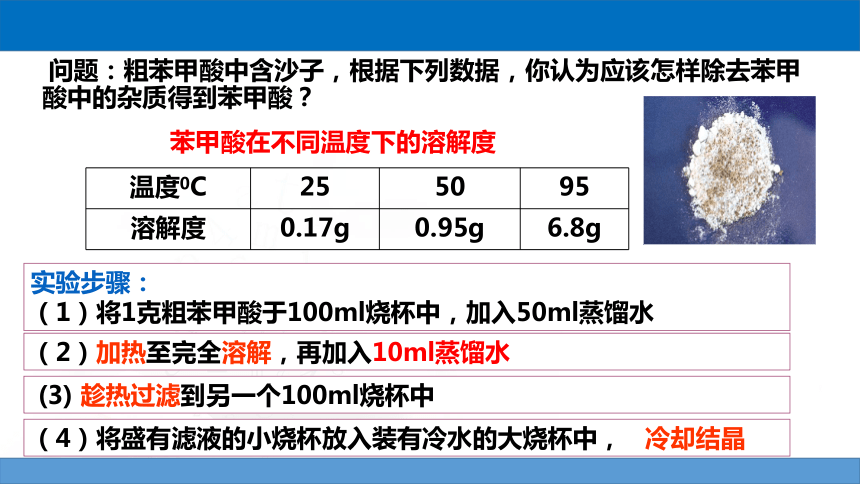
问题:粗苯甲酸中含沙子,根据下列数据,你认为应该怎样除去苯甲酸中的杂质得到苯甲酸?
苯甲酸在不同温度下的溶解度
温度0C
25
50
95
溶解度
0.17g
0.95g
6.8g
实验步骤:
(1)将1克粗苯甲酸于100ml烧杯中,加入50ml蒸馏水
(2)加热至完全溶解,再加入10ml蒸馏水
(3)
趁热过滤到另一个100ml烧杯中
(4)将盛有滤液的小烧杯放入装有冷水的大烧杯中,
冷却结晶
苯甲酸的重结晶
加热溶解
趁热过滤
冷却结晶
2.
重结晶
利用混合物(有机物和杂质)中各组分在某种溶剂中溶解度不同或在同一溶剂中不同温度时的溶解度不同而使他们相互分离。常用冷却或蒸发分离出有机物。
提纯固体有机物常采用重结晶法。
a.
溶剂要求
杂质在此溶剂中溶解度很小或很大;
被提纯的有机物在此溶剂中的溶解度,受温度的影响较大。
b.
实验步骤
加热溶解
→
趁热过滤
→
冷却结晶→过滤、洗涤、干燥。
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
趁热过滤
冷却结晶,过滤,洗涤
重结晶法的操作流程
溶于溶剂制成饱和溶液,
1、为什么在粗苯甲酸全溶后再加少量蒸馏水?
水量刚好,趁热过滤过程中温度降低,溶液易达到饱和而结晶析出,损失苯甲酸。
2、温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
不是。温度过低,杂质的溶解度也会降低,部分杂质会析出,达不到提纯苯甲酸的目的。
思考与交流:
阅读课本p17,思考下面问题
3、在重结晶过程中进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?
洗涤不溶性固体表面的可溶性有机物。
4、在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
洗涤除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的溶解损失。
随堂练习2
1)若
KNO3中含有少量NaCl应如何除杂?
2)若
NaCl中含有少量KNO3应如何除杂?
(已知
①温度越高,KNO3的溶解度越大,且变化非常明显。
②NaCl的溶解度几乎不受温度影响。
重结晶(或降温结晶),获得较纯净的KNO3
蒸发结晶,获得较纯净的NaCl
(溶解→蒸发浓缩→结晶→过滤、洗涤、干燥)
3.
萃取
【思考与交流】
如何提取碘水中的碘?
实验原理是什么?
用到的实验仪器(玻璃仪器)有哪些?
如何选取萃取剂?
这样得到的碘纯净吗?如果不纯,如何处理?(蒸馏)
分液有哪些注意事项?
(1)萃取原理:包括液液萃取和固液萃取(药酒)。
利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法
(2)萃取剂的选择条件:
①萃取剂与原溶剂不互溶。②萃取剂与原混合物不反应。
③溶质在萃取剂中有较大的溶解度
(3)常用萃取剂
:
煤油
植物油
苯
四氯化碳
(4)步骤
检漏
装液
振荡并放气
分液
静置
静置
分液
分液--分离互不相溶、密度不同的混合物的方法
先拿掉塞子,打开下口旋塞;下层下放,上层上到。
注意:放液时需要及时关闭旋塞。
1、如何提取碘水中的碘?实验原理是什么?
2、进行提取碘的实验要用到哪些仪器?
3、如何选取萃取剂?
4、分液有哪些注意事项?
用四氯化碳、苯等萃取;利用溶解度的不同。
拿掉塞子;及时关闭旋塞;下层下放,上层上到。
铁架台、分液漏斗、烧杯
①与原溶剂互不相溶
②被萃取的物质在萃取剂中的溶解度要大得多
思考与交流
1.下列每组中各有三对物质,它们都能用分液漏斗分离的是
A
乙酸乙酯和水,酒精和水,植物油和水
B
四氯化碳和水,溴苯和水,硝基苯和水
C
甘油和水,乙酸和水,乙酸和乙醇
D
汽油和水,苯和水,己烷和水
2.可以用分液漏斗分离的一组液体混和物是
A
溴和四氯化碳
B
苯和溴苯
C
汽油和苯
D
硝基苯和水
?
?
?
随堂练习3
3.现有四组混合物:
乙酸乙酯和乙酸钠溶液
乙醇和甘油
溴化钠和单质溴的水溶液
碘和四氯化碳的混合物
分离以上各混合物的正确方法依次是( )
A.分液、萃取、蒸馏、萃取
B.萃取、蒸馏、分液、萃取
C.分液、蒸馏、萃取、蒸馏
D.蒸馏、萃取、分液、萃取
C
5.纯碱和氯化钠的溶解度曲线如右图,将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用( )
蒸馏法
萃取法
重结晶法
分液法
C
6.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
在组装蒸馏装置时,温度计的水银球应伸入液面以下
分离碘与CCl4的混合物,不可采用蒸馏的方法
在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加入少量蒸馏水
在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤
C
高中人教版
选修五
第一章
认识有机化合物
第4节
研究有机化合物的一般步骤和方法
(1)物质的分离提纯
口腔癌的发生率因近年来嚼食槟榔人口的增加而逐年上升。
槟榔里的成分有:酚类、多糖、脂肪、粗纤维、水分、灰分、生物碱和许多微量元素。
实验室中如何来研究槟榔中的成分?研究有机化合物的一般步骤和方法是什么?
新课引入:
研究有机物的一般步骤:
分离、
提纯
元素定量分析
确定实验式
测定相对分子质量
确定分子式
现代物理实验
方法确定结构式
粗产品
每一个操作步骤是怎样完成的呢?
一.
分离提纯:
1.
混合物分离中常用的操作有哪些?
2.
分离提纯的基本原则:
不增:
不减:
易分离:
易复原:
过滤、结晶、蒸馏、升华、萃取和分液等
不引入新杂质
不减少被提纯物
杂质转换为沉淀、气体等容易分离除去
被提纯物易复原
利用有机物与杂质物理性质的差异
1.
蒸馏
蒸馏法适用于分离、提纯什么有机物?对有机物与杂质的沸点差别有何要求?
b.
蒸馏装置主要仪器有哪些?
有哪些注意事项?
适用于分离、提纯互溶的液态有机物,该有机物的热稳定性较强,与杂质的沸点相差一般约大于30℃
。
蒸馏烧瓶、冷凝管(直形、球形、蛇形冷凝管和空冷凝管)
----分离、提纯液态有机物的常用方法。
利用混合物中各种成分的沸点不同,在蒸馏过程中低沸点的组分先蒸出,高沸点的组分后蒸出,从而达到分离提纯的目的。
有机物热稳定性较强、含少量杂质、与杂质沸点相差较大(一般约大于30℃)
(2)条件:
(1)
原理
1.蒸馏
(3)注意事项
A.
仪器组装:“先下后上,由左至右”;
B.
加热蒸馏烧瓶需垫石棉网;
C.蒸馏烧瓶盛装的液体:
不超过容积的
2/3;
不得将全部溶液蒸干;需使用沸石;
D.冷凝水水流方向应与蒸汽流方向相反
(逆流:下进上出);
E.温度计水银球位置与蒸馏烧瓶支管口齐平,
以测量馏出蒸气的温度;
F.加热温度不能超过混合物中沸点最高物质的沸点,并利用移动酒精灯来调节温度.
G.实验开始时,先开冷凝水,后加热。实验结束时,先停止加热,后关冷凝水。
随堂练习
1.欲用96%的工业酒精制取无水乙醇时,可选用的
方法是(
)
A.加入无水CuSO4,再过滤
B.加入生石灰,再蒸馏
C.加入浓硫酸,再加热,蒸出乙醇
D.
直接加热蒸馏出酒精
B
注:
当两种物质沸点相差不到30℃时,可先将杂质转化为离子化合物,然后利用蒸馏的方法进行除杂!
问题:粗苯甲酸中含沙子,根据下列数据,你认为应该怎样除去苯甲酸中的杂质得到苯甲酸?
苯甲酸在不同温度下的溶解度
温度0C
25
50
95
溶解度
0.17g
0.95g
6.8g
实验步骤:
(1)将1克粗苯甲酸于100ml烧杯中,加入50ml蒸馏水
(2)加热至完全溶解,再加入10ml蒸馏水
(3)
趁热过滤到另一个100ml烧杯中
(4)将盛有滤液的小烧杯放入装有冷水的大烧杯中,
冷却结晶
苯甲酸的重结晶
加热溶解
趁热过滤
冷却结晶
2.
重结晶
利用混合物(有机物和杂质)中各组分在某种溶剂中溶解度不同或在同一溶剂中不同温度时的溶解度不同而使他们相互分离。常用冷却或蒸发分离出有机物。
提纯固体有机物常采用重结晶法。
a.
溶剂要求
杂质在此溶剂中溶解度很小或很大;
被提纯的有机物在此溶剂中的溶解度,受温度的影响较大。
b.
实验步骤
加热溶解
→
趁热过滤
→
冷却结晶→过滤、洗涤、干燥。
不纯固体物质
残渣
(不溶性杂质)
滤液
母液
(可溶性杂质和部分被提纯物)
晶体
(产品)
趁热过滤
冷却结晶,过滤,洗涤
重结晶法的操作流程
溶于溶剂制成饱和溶液,
1、为什么在粗苯甲酸全溶后再加少量蒸馏水?
水量刚好,趁热过滤过程中温度降低,溶液易达到饱和而结晶析出,损失苯甲酸。
2、温度越低,苯甲酸的溶解度越小,为了得到更多的苯甲酸晶体,是不是结晶时的温度越低越好?
不是。温度过低,杂质的溶解度也会降低,部分杂质会析出,达不到提纯苯甲酸的目的。
思考与交流:
阅读课本p17,思考下面问题
3、在重结晶过程中进行热过滤后,要用少量热溶剂冲洗一遍,其目的是什么?
洗涤不溶性固体表面的可溶性有机物。
4、在晶体析出后,分离晶体和滤液时,要用少量的冷溶剂洗涤晶体,其洗涤的目的是什么?为什么要用冷溶剂?
洗涤除去晶体表面附着的可溶性杂质;用冷溶剂洗涤可降低洗涤过程中晶体的溶解损失。
随堂练习2
1)若
KNO3中含有少量NaCl应如何除杂?
2)若
NaCl中含有少量KNO3应如何除杂?
(已知
①温度越高,KNO3的溶解度越大,且变化非常明显。
②NaCl的溶解度几乎不受温度影响。
重结晶(或降温结晶),获得较纯净的KNO3
蒸发结晶,获得较纯净的NaCl
(溶解→蒸发浓缩→结晶→过滤、洗涤、干燥)
3.
萃取
【思考与交流】
如何提取碘水中的碘?
实验原理是什么?
用到的实验仪器(玻璃仪器)有哪些?
如何选取萃取剂?
这样得到的碘纯净吗?如果不纯,如何处理?(蒸馏)
分液有哪些注意事项?
(1)萃取原理:包括液液萃取和固液萃取(药酒)。
利用混合物中一种溶质在互不相溶的两种溶剂中的溶解性不同,一种溶剂把溶质从它与另一种溶剂组成的溶液中提取出来的方法
(2)萃取剂的选择条件:
①萃取剂与原溶剂不互溶。②萃取剂与原混合物不反应。
③溶质在萃取剂中有较大的溶解度
(3)常用萃取剂
:
煤油
植物油
苯
四氯化碳
(4)步骤
检漏
装液
振荡并放气
分液
静置
静置
分液
分液--分离互不相溶、密度不同的混合物的方法
先拿掉塞子,打开下口旋塞;下层下放,上层上到。
注意:放液时需要及时关闭旋塞。
1、如何提取碘水中的碘?实验原理是什么?
2、进行提取碘的实验要用到哪些仪器?
3、如何选取萃取剂?
4、分液有哪些注意事项?
用四氯化碳、苯等萃取;利用溶解度的不同。
拿掉塞子;及时关闭旋塞;下层下放,上层上到。
铁架台、分液漏斗、烧杯
①与原溶剂互不相溶
②被萃取的物质在萃取剂中的溶解度要大得多
思考与交流
1.下列每组中各有三对物质,它们都能用分液漏斗分离的是
A
乙酸乙酯和水,酒精和水,植物油和水
B
四氯化碳和水,溴苯和水,硝基苯和水
C
甘油和水,乙酸和水,乙酸和乙醇
D
汽油和水,苯和水,己烷和水
2.可以用分液漏斗分离的一组液体混和物是
A
溴和四氯化碳
B
苯和溴苯
C
汽油和苯
D
硝基苯和水
?
?
?
随堂练习3
3.现有四组混合物:
乙酸乙酯和乙酸钠溶液
乙醇和甘油
溴化钠和单质溴的水溶液
碘和四氯化碳的混合物
分离以上各混合物的正确方法依次是( )
A.分液、萃取、蒸馏、萃取
B.萃取、蒸馏、分液、萃取
C.分液、蒸馏、萃取、蒸馏
D.蒸馏、萃取、分液、萃取
C
5.纯碱和氯化钠的溶解度曲线如右图,将纯碱从氯化钠和纯碱的混合物中分离出来,最好应用( )
蒸馏法
萃取法
重结晶法
分液法
C
6.下列关于物质的分离、提纯实验中的一些操作或做法,正确的是( )
在组装蒸馏装置时,温度计的水银球应伸入液面以下
分离碘与CCl4的混合物,不可采用蒸馏的方法
在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加入少量蒸馏水
在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温再过滤
C
