2020-2021学年高一化学人教版(2019)必修第二册第五章第三节 第一课时(二氧化硅和硅酸)课件 (20张ppt))
文档属性
| 名称 | 2020-2021学年高一化学人教版(2019)必修第二册第五章第三节 第一课时(二氧化硅和硅酸)课件 (20张ppt)) |  | |
| 格式 | zip | ||
| 文件大小 | 8.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-04 19:27:56 | ||
图片预览






文档简介
(共20张PPT)
第一节
无机非金属材料主角——硅
第一课时
二氧化硅和硅酸
硅的存在与分布
存在:硅是亲氧元素,没有游离态,只有化合态(以氧化物和硅酸盐的形式存在)
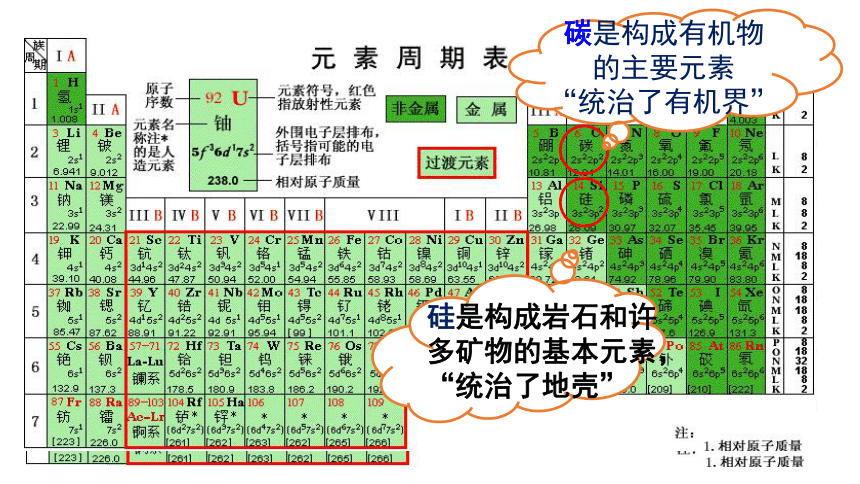
碳是构成有机物的主要元素
“统治了有机界”
硅是构成岩石和许多矿物的基本元素,“统治了地壳”
Si
+14
8
4
2
C
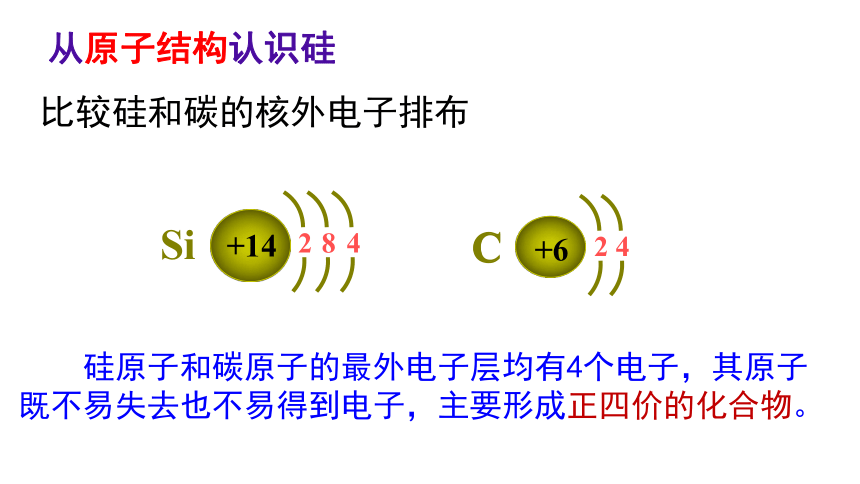
从原子结构认识硅
比较硅和碳的核外电子排布
+6
4
2
C
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成正四价的化合物。
结晶形(石英晶体)
无定形
玛瑙
一、
二氧化硅(
SiO2
)
1、存在:
硅石
无色透明
彩色环带或层状
水晶
——硅藻土
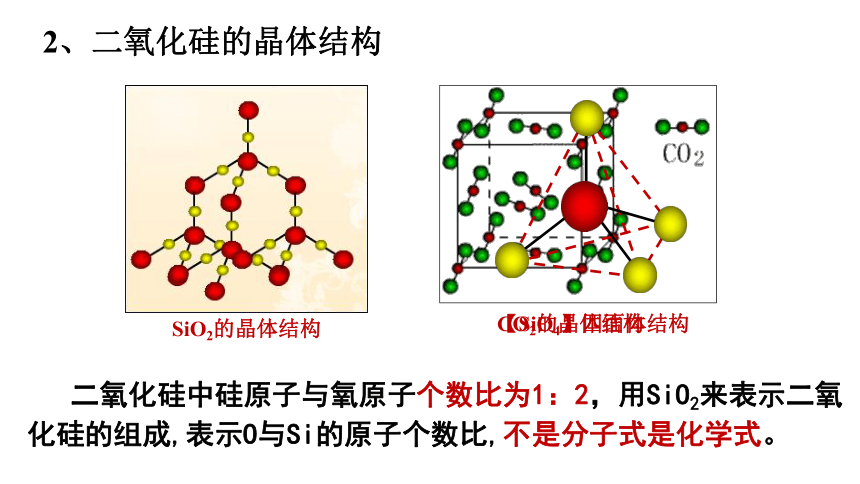
2、二氧化硅的晶体结构
CO2的晶体结构
SiO2的晶体结构
【SiO4】四面体结构
二氧化硅中硅原子与氧原子个数比为1:2,用SiO2来表示二氧化硅的组成,表示O与Si的原子个数比,不是分子式是化学式。
3、用途及物理性质
玛瑙
水晶
石英制品
光导纤维
用途
物理性质:
硬度大、熔点高、难溶于水
从物质分类角度来看,SiO2属于哪类物质,请你预测二氧化硅的可能具有的化学性质?
酸性氧化物
酸性氧化物
的通性
①与水反应生成对应的酸
②与碱性氧化物反应生成盐
③与强碱反应生成盐和水
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
因为玻璃中含有SiO2,会与NaOH溶液反应生成硅酸钠,使瓶塞与瓶口粘在一起而打不开。
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
刻蚀玻璃
在玻璃表面涂上一层石蜡
在石蜡上雕刻出花纹,向挖空部分加少量氢氟酸
洗掉酸并去掉石蜡
①
②
③
【玻璃雕刻步骤】
思考:实验室能否用玻璃瓶盛装氢氟酸(HF)?
注意:实验室用塑料瓶来盛装HF。
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
特殊性质
思考:某同学推断出SiO2为两性氧化物,是否正确?
答:不正确。SiO2是酸性氧化物,可以和HF反应,但是没有生成盐,SiF4不是盐,不符合两性氧化物的定义。
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
CO2
+H2O+Na2CO3
===
2NaHCO3
SiO2+Na2CO3
====
Na2SiO3+CO2↑
高温
SiO2+CaCO3==CaSiO3+CO2↑
高温
碳
CO2+C=2CO
SiO2+2C
====
Si+2CO↑
高温
碳酸盐
结论
实验现象
实验操作
硅酸是一种不溶于水的白色固体
二、硅酸
实验4-1:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸
滴加酚酞试液后溶液呈红色,滴加稀盐酸后溶液变为无色,有白色胶状沉淀生成。
1、制备:
Na2SiO3溶液呈碱性;
结论
化学方程式
离子方程式
Na2SiO3+2HCl
=
H2SiO3
(胶体)+2NaCl
SiO32-+2H+
=
H2SiO3
(胶体)
强酸制弱酸原理(酸性:HCl
>
H2SiO3)
现象:生成白色凝胶
结论:硅酸钠溶液可以和
CO2反应生成硅酸,所以要
密闭保存
酸性:
H2CO3>H2SiO3
Na2SiO3
+
CO2
+
H2O
=Na2CO3
+
H2SiO3
(胶体)
2、化学性质
(1)与强碱溶液反应:
(2)不稳定性:
H2SiO3
+
2NaOH
=Na2SiO3
+2H2O
△
H2SiO3
=
SiO2
+
H2O
强酸制弱酸原理(酸性HCl>H2CO3>H2SiO3)
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
3、用途:
用途:可作干燥剂和催化剂的载体。
蓝色硅胶干燥剂(氯化钴)
橙色硅胶干燥剂(甲基紫)
分子式为mSiO2·nH2O
一、SiO2
1.结构:正四面体空间网状结构
2.物理性质:硬度大、熔点高、难溶于水。
4.化学性质
①与碱
②与碱性氧化物
③与HF
④与碳酸盐
⑤与碳
二、H2SiO3
1.制取:强酸制弱酸
2.性质:难溶于水、弱酸(比碳酸弱)、不稳定性
3.用途:干燥剂、催化剂载体
3.用途:光导纤维
酸性氧化物
刻蚀玻璃
制硅
1、关于二氧化硅说法错误的是(
)
A、水晶的主要成分是二氧化硅。
B、不能由二氧化硅跟水直接作用制取硅酸。
C、二氧化硅能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物。
D、二氧化硅和二氧化碳在物理性质上有很大差别。
【课堂练习】
2、下列说法正确的是(
)
A、SiO2溶于水显酸性
B、光导纤维的主要成分是SiO2
C、SiO2是酸性氧化物,它不溶于任何酸
D、因高温时SiO2与Na2CO3反应放出CO2,所以硅酸酸性比碳酸强
C
B
【课后作业】
完成大小本练习册
第一节
无机非金属材料主角——硅
第一课时
二氧化硅和硅酸
硅的存在与分布
存在:硅是亲氧元素,没有游离态,只有化合态(以氧化物和硅酸盐的形式存在)
碳是构成有机物的主要元素
“统治了有机界”
硅是构成岩石和许多矿物的基本元素,“统治了地壳”
Si
+14
8
4
2
C
从原子结构认识硅
比较硅和碳的核外电子排布
+6
4
2
C
硅原子和碳原子的最外电子层均有4个电子,其原子既不易失去也不易得到电子,主要形成正四价的化合物。
结晶形(石英晶体)
无定形
玛瑙
一、
二氧化硅(
SiO2
)
1、存在:
硅石
无色透明
彩色环带或层状
水晶
——硅藻土
2、二氧化硅的晶体结构
CO2的晶体结构
SiO2的晶体结构
【SiO4】四面体结构
二氧化硅中硅原子与氧原子个数比为1:2,用SiO2来表示二氧化硅的组成,表示O与Si的原子个数比,不是分子式是化学式。
3、用途及物理性质
玛瑙
水晶
石英制品
光导纤维
用途
物理性质:
硬度大、熔点高、难溶于水
从物质分类角度来看,SiO2属于哪类物质,请你预测二氧化硅的可能具有的化学性质?
酸性氧化物
酸性氧化物
的通性
①与水反应生成对应的酸
②与碱性氧化物反应生成盐
③与强碱反应生成盐和水
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
因为玻璃中含有SiO2,会与NaOH溶液反应生成硅酸钠,使瓶塞与瓶口粘在一起而打不开。
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
刻蚀玻璃
在玻璃表面涂上一层石蜡
在石蜡上雕刻出花纹,向挖空部分加少量氢氟酸
洗掉酸并去掉石蜡
①
②
③
【玻璃雕刻步骤】
思考:实验室能否用玻璃瓶盛装氢氟酸(HF)?
注意:实验室用塑料瓶来盛装HF。
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
特殊性质
思考:某同学推断出SiO2为两性氧化物,是否正确?
答:不正确。SiO2是酸性氧化物,可以和HF反应,但是没有生成盐,SiF4不是盐,不符合两性氧化物的定义。
二氧化碳
二氧化硅
水
碱
碱性氧化物
CO2+H2O=H2CO3
CO2+2NaOH=Na2CO3+H2O
CO2+CaO=CaCO3
不反应
SiO2
+
2NaOH
=
Na2SiO3
+H2O
4、化学性质
SiO2+CaO=CaSiO3
高温
HF
SiO2+4HF=SiF4↑+2H2O
不反应
CO2
+H2O+Na2CO3
===
2NaHCO3
SiO2+Na2CO3
====
Na2SiO3+CO2↑
高温
SiO2+CaCO3==CaSiO3+CO2↑
高温
碳
CO2+C=2CO
SiO2+2C
====
Si+2CO↑
高温
碳酸盐
结论
实验现象
实验操作
硅酸是一种不溶于水的白色固体
二、硅酸
实验4-1:向饱和Na2SiO3溶液中滴入酚酞,再滴入稀盐酸
滴加酚酞试液后溶液呈红色,滴加稀盐酸后溶液变为无色,有白色胶状沉淀生成。
1、制备:
Na2SiO3溶液呈碱性;
结论
化学方程式
离子方程式
Na2SiO3+2HCl
=
H2SiO3
(胶体)+2NaCl
SiO32-+2H+
=
H2SiO3
(胶体)
强酸制弱酸原理(酸性:HCl
>
H2SiO3)
现象:生成白色凝胶
结论:硅酸钠溶液可以和
CO2反应生成硅酸,所以要
密闭保存
酸性:
H2CO3>H2SiO3
Na2SiO3
+
CO2
+
H2O
=Na2CO3
+
H2SiO3
(胶体)
2、化学性质
(1)与强碱溶液反应:
(2)不稳定性:
H2SiO3
+
2NaOH
=Na2SiO3
+2H2O
△
H2SiO3
=
SiO2
+
H2O
强酸制弱酸原理(酸性HCl>H2CO3>H2SiO3)
硅酸凝胶经干燥脱水就形成干胶,称为“硅胶”。
3、用途:
用途:可作干燥剂和催化剂的载体。
蓝色硅胶干燥剂(氯化钴)
橙色硅胶干燥剂(甲基紫)
分子式为mSiO2·nH2O
一、SiO2
1.结构:正四面体空间网状结构
2.物理性质:硬度大、熔点高、难溶于水。
4.化学性质
①与碱
②与碱性氧化物
③与HF
④与碳酸盐
⑤与碳
二、H2SiO3
1.制取:强酸制弱酸
2.性质:难溶于水、弱酸(比碳酸弱)、不稳定性
3.用途:干燥剂、催化剂载体
3.用途:光导纤维
酸性氧化物
刻蚀玻璃
制硅
1、关于二氧化硅说法错误的是(
)
A、水晶的主要成分是二氧化硅。
B、不能由二氧化硅跟水直接作用制取硅酸。
C、二氧化硅能与氢氟酸反应,又能与烧碱反应,所以它是两性氧化物。
D、二氧化硅和二氧化碳在物理性质上有很大差别。
【课堂练习】
2、下列说法正确的是(
)
A、SiO2溶于水显酸性
B、光导纤维的主要成分是SiO2
C、SiO2是酸性氧化物,它不溶于任何酸
D、因高温时SiO2与Na2CO3反应放出CO2,所以硅酸酸性比碳酸强
C
B
【课后作业】
完成大小本练习册
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
