酸碱中和滴定
图片预览



文档简介
(共11张PPT)
选修四 化学反应原理
专题三 溶液中的离子反应
第二单元 溶液的酸碱性
酸碱中和滴定
你知道吗?
用什么方法可以比较精确地测得一瓶未知浓度NaOH溶液的浓度?
①.中和反应的实质是什么?
思考
H++OH-=H2O
②当酸碱刚好完全反应时,酸和碱的物质的量的关系
是怎样的?
aC酸V酸=bC碱V碱
酸与碱的元数相同时:
C酸V酸=C碱V碱
a元酸与b元碱反应时:
nH+= nOH-
可以用已知浓度的酸(或碱)来测定出未知浓度的碱(或酸)的浓度
酸碱中和滴定
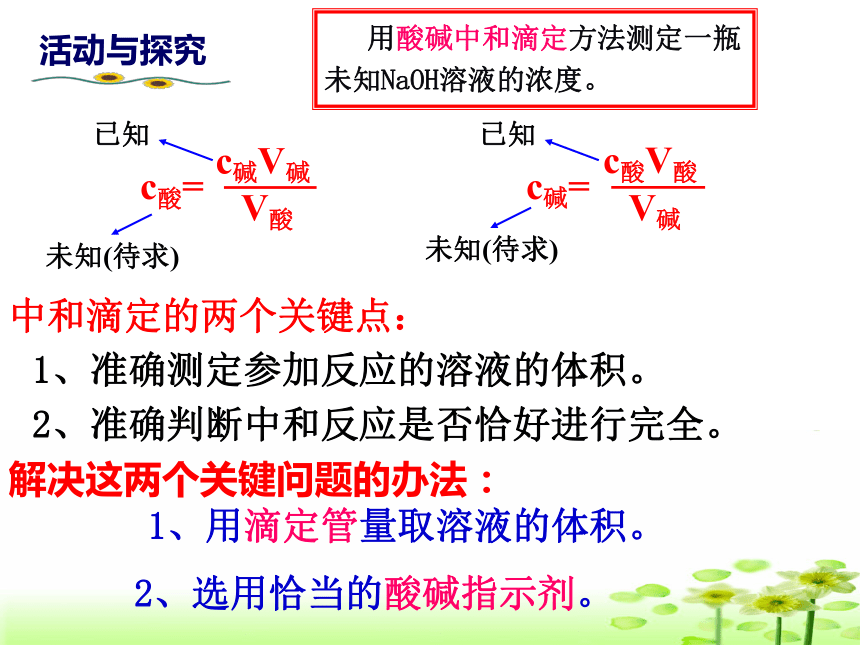
用酸碱中和滴定方法测定一瓶未知NaOH溶液的浓度。
活动与探究
【例题1】用0.1032mol/L的HCl溶液滴定25.00mL
未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84mL通过中和滴定测得NaOH溶液的物质的量浓度是多少?
【解】这是一元强酸和一元强碱的中和滴定,可以利用
c(HCl) ·V(HCl)=c(NaOH) ·V(NaOH),即
c(HCl) · V(HCl)
V(NaOH)
c(NaOH) =
0.1032mol/L · 0.02784L
0.02500L
=
=0.1149mol /L
用酸碱中和滴定方法测定一瓶未知NaOH溶液的浓度。
活动与探究
中和滴定的两个关键点:
1、准确测定参加反应的溶液的体积。
2、准确判断中和反应是否恰好进行完全。
解决这两个关键问题的办法:
1、用滴定管量取溶液的体积。
2、选用恰当的酸碱指示剂。
c酸=
c碱V碱
V酸
c碱=
c酸V酸
V碱
未知(待求)
已知
已知
未知(待求)
酸碱中和滴定
与量筒对比
(1)酸式滴定用的是玻璃活塞,碱式滴定管用的是橡皮管。
(2)滴定管的刻度从上往下标,下面一部分没有读数,因此使用时不能放到刻度以下。
(3)酸式滴定管不能用来盛放碱溶液,碱式滴定管不盛放酸溶液或会腐蚀橡胶的溶液(如强氧化性的溶液)。
(4)滴定管的精确度为0.01mL,比量筒精确;所以读数时要读到小数点后两位。
实际滴出的溶液体积=
滴定后的读数-滴定前的读数
终点的判断
溶液颜色发生变化且在半分钟内不再变色。
多次测定求各体积的平均值
强酸滴定强碱
强碱滴定强酸
甲基橙由黄 橙
酚酞由红 无色
甲基橙由红 橙
酚酞由无色 粉红
酸碱中和滴定
2.滴定阶段:
3.数据处理阶段:
NaOH + HCl = NaCl + H2O
C标.V标= C待.V待
1.准备阶段:
①检查是否漏水
②水洗
③润洗
④装液
⑤记录初读数
⑥取待测液
⑦加指示剂
⑧滴加标准液直至颜色发生明显变化
⑨记录末读数
⑩计算待测液浓度
用酸碱中和滴定方法测定一瓶未知NaOH溶液的浓度。
活动与探究
把滴定管固定在滴定管夹上,锥形瓶放在下面接液体,滴定过程中用左手控制活塞,用右手摇动锥形瓶,眼睛应注视锥形瓶中溶液颜色的变化
量取液体常用仪器:量筒、滴定管
量筒:
粗量仪,10mL量筒最小分刻度为
读数精确到 ,无“0”刻度
滴定管
标有温度、容积、“0”刻度在最高点
常用规格:25mL、50mL
最小分刻度: ,读数精确到
(精量仪可估读一位,粗量仪不能估读)
0.1mL
0.1mL
0.1mL
0.01mL
量筒与滴定管的比较
7
8
滴定管
选修四 化学反应原理
专题三 溶液中的离子反应
第二单元 溶液的酸碱性
酸碱中和滴定
你知道吗?
用什么方法可以比较精确地测得一瓶未知浓度NaOH溶液的浓度?
①.中和反应的实质是什么?
思考
H++OH-=H2O
②当酸碱刚好完全反应时,酸和碱的物质的量的关系
是怎样的?
aC酸V酸=bC碱V碱
酸与碱的元数相同时:
C酸V酸=C碱V碱
a元酸与b元碱反应时:
nH+= nOH-
可以用已知浓度的酸(或碱)来测定出未知浓度的碱(或酸)的浓度
酸碱中和滴定
用酸碱中和滴定方法测定一瓶未知NaOH溶液的浓度。
活动与探究
【例题1】用0.1032mol/L的HCl溶液滴定25.00mL
未知浓度的NaOH溶液,滴定完成时,用去HCl溶液27.84mL通过中和滴定测得NaOH溶液的物质的量浓度是多少?
【解】这是一元强酸和一元强碱的中和滴定,可以利用
c(HCl) ·V(HCl)=c(NaOH) ·V(NaOH),即
c(HCl) · V(HCl)
V(NaOH)
c(NaOH) =
0.1032mol/L · 0.02784L
0.02500L
=
=0.1149mol /L
用酸碱中和滴定方法测定一瓶未知NaOH溶液的浓度。
活动与探究
中和滴定的两个关键点:
1、准确测定参加反应的溶液的体积。
2、准确判断中和反应是否恰好进行完全。
解决这两个关键问题的办法:
1、用滴定管量取溶液的体积。
2、选用恰当的酸碱指示剂。
c酸=
c碱V碱
V酸
c碱=
c酸V酸
V碱
未知(待求)
已知
已知
未知(待求)
酸碱中和滴定
与量筒对比
(1)酸式滴定用的是玻璃活塞,碱式滴定管用的是橡皮管。
(2)滴定管的刻度从上往下标,下面一部分没有读数,因此使用时不能放到刻度以下。
(3)酸式滴定管不能用来盛放碱溶液,碱式滴定管不盛放酸溶液或会腐蚀橡胶的溶液(如强氧化性的溶液)。
(4)滴定管的精确度为0.01mL,比量筒精确;所以读数时要读到小数点后两位。
实际滴出的溶液体积=
滴定后的读数-滴定前的读数
终点的判断
溶液颜色发生变化且在半分钟内不再变色。
多次测定求各体积的平均值
强酸滴定强碱
强碱滴定强酸
甲基橙由黄 橙
酚酞由红 无色
甲基橙由红 橙
酚酞由无色 粉红
酸碱中和滴定
2.滴定阶段:
3.数据处理阶段:
NaOH + HCl = NaCl + H2O
C标.V标= C待.V待
1.准备阶段:
①检查是否漏水
②水洗
③润洗
④装液
⑤记录初读数
⑥取待测液
⑦加指示剂
⑧滴加标准液直至颜色发生明显变化
⑨记录末读数
⑩计算待测液浓度
用酸碱中和滴定方法测定一瓶未知NaOH溶液的浓度。
活动与探究
把滴定管固定在滴定管夹上,锥形瓶放在下面接液体,滴定过程中用左手控制活塞,用右手摇动锥形瓶,眼睛应注视锥形瓶中溶液颜色的变化
量取液体常用仪器:量筒、滴定管
量筒:
粗量仪,10mL量筒最小分刻度为
读数精确到 ,无“0”刻度
滴定管
标有温度、容积、“0”刻度在最高点
常用规格:25mL、50mL
最小分刻度: ,读数精确到
(精量仪可估读一位,粗量仪不能估读)
0.1mL
0.1mL
0.1mL
0.01mL
量筒与滴定管的比较
7
8
滴定管
