人教版(2019)化学必修一 同步课件 2.1.2钠的化合物(37张ppt)
文档属性
| 名称 | 人教版(2019)化学必修一 同步课件 2.1.2钠的化合物(37张ppt) |
|
|
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-05 00:00:00 | ||
图片预览








文档简介
(共37张PPT)
必修第一册
人教版
高一上
第一节
钠及其化合物
第三节
物质的量
第二节
氯及其化合物
第二章
海水中的重要元素
——钠和氯
CONTENTS
本节内容
碳酸钠和碳酸氢钠
氧化钠和过氧化钠
二
一
焰色反应
三
课堂讲解
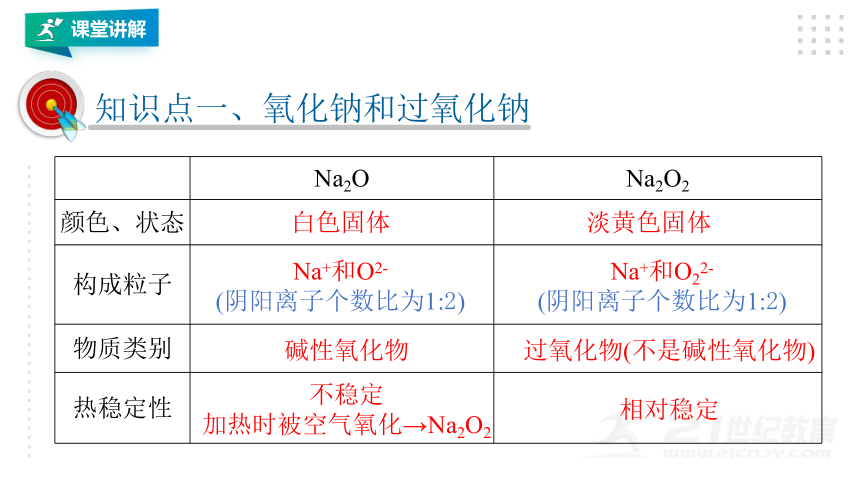
知识点一、氧化钠和过氧化钠
Na2O
Na2O2
颜色、状态
构成粒子
物质类别
热稳定性
白色固体
淡黄色固体
Na+和O2-
(阴阳离子个数比为1:2)
Na+和O22-
(阴阳离子个数比为1:2)
碱性氧化物
过氧化物(不是碱性氧化物)
不稳定
加热时被空气氧化→Na2O2
相对稳定
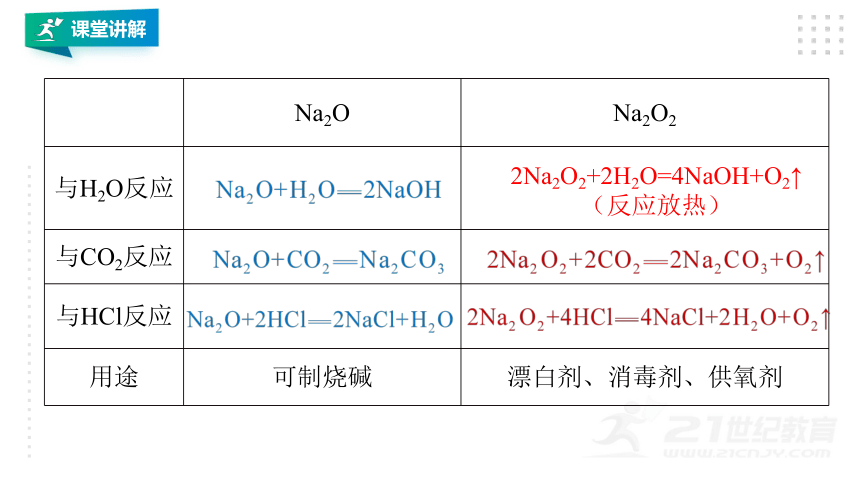
课堂讲解
Na2O
Na2O2
与H2O反应
与CO2反应
与HCl反应
用途
可制烧碱
漂白剂、消毒剂、供氧剂
2Na2O2+2H2O=4NaOH+O2↑
(反应放热)
(1)Na2O2与H2O、CO2和酸反应时,Na2O2既是氧化剂又是还原剂,每份Na2O2转移1个e-
(2)过氧化钠可作漂白剂,若向紫色石蕊溶液中加入过量Na2O2粉末,振荡,溶液先变蓝色后褪色,若向酚酞溶液,中加入过量
Na2O2粉末,振荡,则先变红色后褪色
【注意事项】
新知讲解
(3)计算技巧
①足量过氧化钠与H2、CO和O2点燃混合物反应计算中。可认为Na2O2+H2=2NaOH、Na2O2+CO=Na2CO3、2Na2O2+CO+H2=Na2CO3+2NaOH
(实际上述反应均不能发生)
②a
g通式符合(CO)m(H2)n(m=0,1,2…;n=0,1,2…)的物质在氧气中燃烧,将其产物通过足量的Na2O2固体,反应完毕,固体增重a
g
新知讲解
课堂练习
【例1】下列叙述中正确的是(
)
A.Na2O和Na2O2都能与水反应生成NaOH,都属于碱性氧化物
B.Na2O2溶于水产生O2的离子方程式为Na2O2+H2O=2Na++2OH-+O2↑
C.在反应2Na2O2+2CO2=2Na2CO3+O2中,CO2既不是氧化剂也不是还原剂
D.Na2O、Na2O2组成元素相同,但阳离子与阴离子的个数比不同
C
课堂练习
【例2】下列关于Na2O和Na2O2的叙述中正确的是(
)
A.Na2O比Na2O2稳定
B.均可与CO2、H2O反应产生氧气
C.所含氧元素的化合价均为-2价
D.阴、阳离子的个数比均为1:2
D
课堂练习
【例3】如图所示,试管b中盛有水,气球a中盛有干燥的Na2O2。U形管中注有浅红色的墨水,将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,产生的现象是(
)
A.U形管内红墨水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:dC
课堂练习
【例4】向下列溶液中加入少量过氧化钠固体,肯定不会产生沉淀的是(
)
A.氯化铁溶液
B.饱和碳酸氢钠溶液
C.硫化钠溶液
D.饱和氢氧化钙溶液
B
课堂练习
【例5】某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种阴离子,向其中加入足量的
Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
(
)
A.CO32-
B.HCO3-
C.SO32-
D.CH3COO-
D
课堂练习
【例6】取a
g某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质量增加了b
g。若b>a,则A为(
)
A.H2
B.CO
C.C12H22O11
D.C6H12O6
C
新知讲解
知识点二、碳酸钠和碳酸氢钠
碳酸钠
碳酸氢钠
俗名
性状
溶解性
____溶于水,比NaHCO3溶解度___
____溶于水
酸碱性
水溶液均呈_____,同浓度下,Na2CO3溶液碱性____
热稳定性
纯碱、苏打
小苏打
白色粉末
细小的白色晶体
易
大
易
碱性
更强
稳定,受热不易分解
不稳定,受热易分解
新知讲解
碳酸钠
碳酸氢钠
与酸反应
与NaOH溶液反应
与澄清石灰水反应
不反应
①CO32-+H+=HCO3-
②HCO3-
+H+=CO2↑+H2O
②HCO3-
+H+=CO2↑+H2O
(比Na2CO3与酸反应快)
HCO3-
+OH-
=CO32-+H2O
HCO3-(少)+Ca2+
+OH-
=CaCO3↓
+H2O
2HCO3-(过)+Ca2+
+2OH-
=CaCO3↓
+2H2O
CO32-+Ca2+=CaCO3↓
必修第一册
人教版
高一上
第一节
钠及其化合物
第三节
物质的量
第二节
氯及其化合物
第二章
海水中的重要元素
——钠和氯
CONTENTS
本节内容
碳酸钠和碳酸氢钠
氧化钠和过氧化钠
二
一
焰色反应
三
课堂讲解
知识点一、氧化钠和过氧化钠
Na2O
Na2O2
颜色、状态
构成粒子
物质类别
热稳定性
白色固体
淡黄色固体
Na+和O2-
(阴阳离子个数比为1:2)
Na+和O22-
(阴阳离子个数比为1:2)
碱性氧化物
过氧化物(不是碱性氧化物)
不稳定
加热时被空气氧化→Na2O2
相对稳定
课堂讲解
Na2O
Na2O2
与H2O反应
与CO2反应
与HCl反应
用途
可制烧碱
漂白剂、消毒剂、供氧剂
2Na2O2+2H2O=4NaOH+O2↑
(反应放热)
(1)Na2O2与H2O、CO2和酸反应时,Na2O2既是氧化剂又是还原剂,每份Na2O2转移1个e-
(2)过氧化钠可作漂白剂,若向紫色石蕊溶液中加入过量Na2O2粉末,振荡,溶液先变蓝色后褪色,若向酚酞溶液,中加入过量
Na2O2粉末,振荡,则先变红色后褪色
【注意事项】
新知讲解
(3)计算技巧
①足量过氧化钠与H2、CO和O2点燃混合物反应计算中。可认为Na2O2+H2=2NaOH、Na2O2+CO=Na2CO3、2Na2O2+CO+H2=Na2CO3+2NaOH
(实际上述反应均不能发生)
②a
g通式符合(CO)m(H2)n(m=0,1,2…;n=0,1,2…)的物质在氧气中燃烧,将其产物通过足量的Na2O2固体,反应完毕,固体增重a
g
新知讲解
课堂练习
【例1】下列叙述中正确的是(
)
A.Na2O和Na2O2都能与水反应生成NaOH,都属于碱性氧化物
B.Na2O2溶于水产生O2的离子方程式为Na2O2+H2O=2Na++2OH-+O2↑
C.在反应2Na2O2+2CO2=2Na2CO3+O2中,CO2既不是氧化剂也不是还原剂
D.Na2O、Na2O2组成元素相同,但阳离子与阴离子的个数比不同
C
课堂练习
【例2】下列关于Na2O和Na2O2的叙述中正确的是(
)
A.Na2O比Na2O2稳定
B.均可与CO2、H2O反应产生氧气
C.所含氧元素的化合价均为-2价
D.阴、阳离子的个数比均为1:2
D
课堂练习
【例3】如图所示,试管b中盛有水,气球a中盛有干燥的Na2O2。U形管中注有浅红色的墨水,将气球用橡皮筋紧缚在试管口。实验时将气球中的Na2O2抖落到试管b的水中,产生的现象是(
)
A.U形管内红墨水褪色
B.试管内溶液变红
C.气球a被吹大
D.U形管水位:d
课堂练习
【例4】向下列溶液中加入少量过氧化钠固体,肯定不会产生沉淀的是(
)
A.氯化铁溶液
B.饱和碳酸氢钠溶液
C.硫化钠溶液
D.饱和氢氧化钙溶液
B
课堂练习
【例5】某溶液中含有HCO3-、SO32-、CO32-、CH3COO-等四种阴离子,向其中加入足量的
Na2O2固体后,假设溶液体积无变化,溶液中离子浓度基本保持不变的是
(
)
A.CO32-
B.HCO3-
C.SO32-
D.CH3COO-
D
课堂练习
【例6】取a
g某物质A,在氧气中完全燃烧,使燃烧产物跟足量过氧化钠反应,反应后固体的质量增加了b
g。若b>a,则A为(
)
A.H2
B.CO
C.C12H22O11
D.C6H12O6
C
新知讲解
知识点二、碳酸钠和碳酸氢钠
碳酸钠
碳酸氢钠
俗名
性状
溶解性
____溶于水,比NaHCO3溶解度___
____溶于水
酸碱性
水溶液均呈_____,同浓度下,Na2CO3溶液碱性____
热稳定性
纯碱、苏打
小苏打
白色粉末
细小的白色晶体
易
大
易
碱性
更强
稳定,受热不易分解
不稳定,受热易分解
新知讲解
碳酸钠
碳酸氢钠
与酸反应
与NaOH溶液反应
与澄清石灰水反应
不反应
①CO32-+H+=HCO3-
②HCO3-
+H+=CO2↑+H2O
②HCO3-
+H+=CO2↑+H2O
(比Na2CO3与酸反应快)
HCO3-
+OH-
=CO32-+H2O
HCO3-(少)+Ca2+
+OH-
=CaCO3↓
+H2O
2HCO3-(过)+Ca2+
+2OH-
=CaCO3↓
+2H2O
CO32-+Ca2+=CaCO3↓
