广东省梅州市高中2020-2021学年高一下学期末考试化学试题 Word版含答案
文档属性
| 名称 | 广东省梅州市高中2020-2021学年高一下学期末考试化学试题 Word版含答案 |

|
|
| 格式 | docx | ||
| 文件大小 | 718.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-04 00:00:00 | ||
图片预览


文档简介
11125200123825002020-2021学年梅州高中高一期末考试
化学试卷(必修第二册)
一、单项选择题
1.《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于
A.纤维素、蛋白质 B.糖类、油脂 C.纤维素、油脂 D.单糖、蛋白质
2.化学与生活、生产、环境等密切相关。下列说法错误的是
A.医疗上用作X射线检查的内服药“钡餐”是BaSO4
B.蛋白质、油脂、糖类一定条件下都能发生水解反应
C.煤的液化、石油的裂化和油脂的皂化都属于化学变化
D.工业上可用氢氟酸雕刻玻璃
3.现代社会的发展与进步离不开材料,下列有关材料的说法正确的是
A. “超轻海绵”使用的石墨烯是新型无机非金属材料
B. “C919”大飞机使用的氮化硅陶瓷是传统无机非金属材料
C. “北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
D. “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
4.下列说法正确的是
A.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
B.酿酒过程中葡萄糖在酒化酶的作用下可水解生成乙醇和二氧化碳
C.液态植物油在一定条件下可转化为性质更稳定的氢化植物油
D.淀粉溶液中加入一定量稀硫酸,加热,待溶液冷却,向溶液加入新制的Cu(OH)2,加热,未见砖红色沉淀,证明淀粉没有发生水解
right44455.依据右图中氮元素及其化合物间的转化关系,判断下列说法不正确的是
A.x是N2O5 B.可用排空气法收集NO
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,可通过NH3与
NO2反应实现
6.根据下列实验事实得出的相应结论正确的是
选项
实验事实
结论
A
NH3的水溶液可以导电
NH3是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
浓硝酸久置发黄
硝酸不稳定
D
浓硫酸能使蓝色胆矾晶体变成白色
浓硫酸具有脱水性
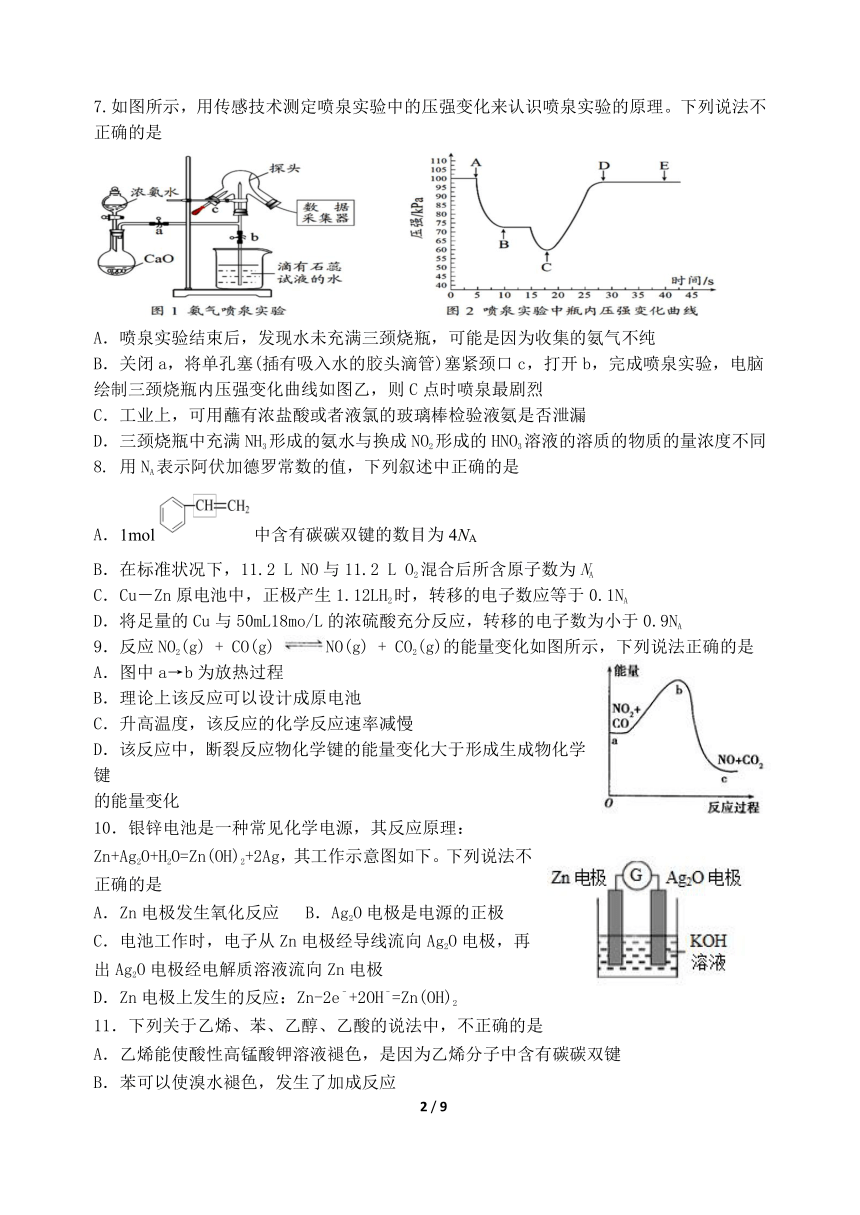
7.如图所示,用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法不正确的是
A.喷泉实验结束后,发现水未充满三颈烧瓶,可能是因为收集的氨气不纯
B.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈烧瓶内压强变化曲线如图乙,则C点时喷泉最剧烈
C.工业上,可用蘸有浓盐酸或者液氯的玻璃棒检验液氨是否泄漏
D.三颈烧瓶中充满NH3形成的氨水与换成NO2形成的HNO3溶液的溶质的物质的量浓度不同
8. 用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1molfalse中含有碳碳双键的数目为4NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
C.Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应等于0.1NA
D.将足量的Cu与50mL18mo/L的浓硫酸充分反应,转移的电子数为小于0.9NA
9.反应NO2(g) + CO(g) NO(g) + CO2(g)的能量变化如图所示,下列说法正确的是
39096955715A.图中a→b为放热过程
B.理论上该反应可以设计成原电池
C.升高温度,该反应的化学反应速率减慢
D.该反应中,断裂反应物化学键的能量变化大于形成生成物化学键
的能量变化
349440533210510.银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
A.Zn电极发生氧化反应 B.Ag2O电极是电源的正极
C.电池工作时,电子从Zn电极经导线流向Ag2O电极,再出Ag2O电极经电解质溶液流向Zn电极
D.Zn电极上发生的反应:Zn-2e–+2OH–=Zn(OH)2
11.下列关于乙烯、苯、乙醇、乙酸的说法中,不正确的是
A.乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键
B.苯可以使溴水褪色,发生了加成反应
C.乙醇在铜催化并加热条件下生成乙醛,乙醇发生了氧化反应
D.生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性
12.进行一氯取代反应后,只能生成三种沸点不同的有机物的是
A.(CH3)3CCH2CH3 B.(CH3CH2)2CHCH3 C.(CH3)2CHCH(CH3)2 D.(CH3)2CHCH2CH2CH3
13.有机物A的结构简式如图所示,下列关于A的说法正确的是
301625074930A.A的分子式为C13H14O5
B.1mol Na2CO3最多能消耗1mol有机物A
C.1mol A和足量金属钠反应生成22.4L气体
D.A只能发生取代、氧化、加成反应
14.某有机物的结构简式为HOCH2CH=CHCH2COOH,下列关于该有机物的说法错误的是
A.该有机物含有3种官能团
B.该有机物能发生氧化反应、加成反应、加聚反应、酯化反应
C.该有机物能使溴水和酸性高锰酸钾溶液褪色,其褪色原理一样
338201024130D.1mol该有机物能与2mol Na发生反应
15. 我国学者研究出一种用于催化DMO和氢气反应获得EG的纳米反应器,如图是反应的微观过程示意图。下列说法正确的是
A.Cu纳米颗粒是一种胶体,能将氢气解离成氢原子
B.EG和乙醇是同系物
C.DMO属于一种烃
D.催化过程中断裂的化学键有 H—H、C—O、C===O
16.除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是
选项
物质
使用的试剂
主要操作
A
FeCl2(FeCl3)溶液
过量铜粉
过滤
B
乙烷(乙烯)
酸性高锰酸钾溶液
洗气
C
乙醇(水)
金属钠
蒸馏
D
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
17.在一定温度下,向aL密闭容器中加入1mol H2(g)和1mol Br2(g),发生如下反应:H2(g)+Br2(g)2HBr(g)。此反应达到平衡的标志是
A.容器内H2、Br2、HBr的浓度之比为1∶1∶2 B.容器内颜色不随时间变化
C.容器内压强不随时间变化 D.单位时间内消耗n mol H2,同时生成2n mol HBr
18.某同学设计以下实验方案,从海带中提取I2。下列说法不正确的是
A.操作①是过滤
B.②中双氧水作还原剂
C.③的离子方程式是5I–+IO+6H+=3I2+3H2O
D.含I2的溶液经3步转化为I2的悬浊液,其目的是富集
19.短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X的一种核素在考古时常用来鉴定一些文物的年代,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.化合物XZ2各原子均满足8电子的稳定结构
B.已知含氧酸的酸性:H2ZO3>H2XO3,则Z的非金属性强于X
C.若单质W失火,不能用泡沫灭火器扑灭
D.Y的氢氧化物可用于治疗胃酸过多
20.我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,图为海水综合利用部分流程,有关说法正确的是
A.过程①只发生了化学变化
B.过程④中反应的离子方程式为false
C.过程⑤只需要蒸馏即可得到单质Br2
D.上述工艺流程中涉及到化合、分解、复分解和置换反应
班级 姓名 座号 成绩
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
二、填空题
21.(1)含氮元素的相关物质中会对自然环境造成的污染有______
(写一种即可)。
(2)下图是常见的气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2应选择的装置是_____________(填字母)。
318135040640(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。其催化反应机理如下图所示,写出该反应发生的化学方程式__________________ __ 。
(4)实验室制取NH3的化学反应方程式为_____________________ __ ______ __,收集满NH3后组成如图甲装置,若要引发喷泉,应采取的操作是_________________ 。
(5)NH3的催化氧化是工业制取硝酸的关键步骤,化学方程式为________ ____ ____________ __,将产生的氨气与过量的氧气通入到图乙所示装置中,用酒精灯加热催化剂至红热时反应开始发生,熄灭酒精灯后反应仍能继续进行,说明该反应是___________(填“吸热”或“放热”)反应。
(6)设计实验证明硝酸具有强氧化性________________ _______________ ________ _ _ 。(只要写出实验原理或思路即可,不需写出实验详细步骤)
left75057022.节日期间因燃放鞭炮会引起空气中SO2 含量增大,造成大气污染。某实验小组同学欲探究SO2的性质并测定空气中SO2 的含量。(1)他们设计如下实验装置,请你参与探究,并回答下列问题:
①装置 A1 中发生反应的化学方程式为 ;
②装置 B 用于检验SO2 的漂白性,所盛试剂为 ,装置 D 用于检验SO2 的 性;
③为验证二氧化硫的还原性,反应一段时间后取试管 C 中的溶液分成三份,进行如下实验: 方案Ⅰ:向第一份溶液中加入AgNO3 溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2 ,产生白色沉淀上述方案合理的是(填“Ⅰ”、“Ⅱ”、“Ⅲ”);C 中发生的离子方程式为: 。
④为了实现绿色环保的目标,甲同学欲用装置 A2 代替装置 A1 你认为装置 A2 的优点是(写两点) 。
(2)他们拟用以下方法测定空气中SO2 含量(假设空气中无其他还原性气体)。
你认为哪个装置可行 (填序号),另一装置不可行的理由
为 。
(如没有,则不填)
36887153238523.化学电池在通讯、交通及日常生活中有着广泛的应用。(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为Zn+2MnO2+2H2O2MnOOH+Zn(OH)2,碱性锌锰干电池的负极材料是__ _(填名称),负极上发生的电极反应为_ __。若反应消耗13g负极材料,则电池中转移电子的物质的量为_ __mol。
(2)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为PbO2+2H2SO42PbSO4+2H2O。下列说法正确的是___(填标号)。
A.电解液中H2SO4的浓度始终保持不变
B.放电时正极上的电极反应式为PbO2+2e?+4H++SO=PbSO4+2H2O
C.放电时,当外电路通过1mol电子时,理论上负极质量增加48g
4130040223520D.放电时,溶液中的SO向正极移动
(3)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为_ __(填“Mg”或“Al”),正极上的电极反应式为_ __ 。
(4)被誉为改变末来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
①O2进入的电极为________(填“正极”或“负极”)。
329819067310②电池工作时,溶液中的OH?向___________(填“正极”或“负极”)迁移。
③若电池工作时转移0.04mol电子,理论上消耗标准状态下___________mL O2。
24.一定条件下铁可以和CO2发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
308546533655(1)t1时,正、逆反应速率的大小关系为ν正__________ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=__________;
(3)下列条件的改变能减慢其反应速率的是__________(选填序号)
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大
④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________(选填序号)。
①v(CO2)=v(CO) ②单位时间内生成n mol CO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化 ④容器中气体的平均分子量不随时间而变化
⑤混合气体的密度不再变化
25.烃A是一种基础化工原料,标准状况下密度为1.25g·L?1,B与G互为同系物。H是有芳香味的油状液体。有关物质转化关系如下图:
请回答:
(1)化合物A的结构简式为______ _____,化合物F中所含的官能团是_______ __ _ _(填名称),已知G的结构简式为CH3CH2CH2OH,则F→G反应的反应类型是_______ ____。
(2)D+G→H的化学方程式是_____ ______。
(3)E→X的化学方程式是____ __ ___。
(4)下列说法正确的是___________。
A.D+G→H过程,浓硫酸作催化剂和吸水剂 B.H在碱性条件下水解是皂化反应
C.用碳酸钠溶液无法鉴别D、G和H
D.相同物质的量的B、C、D完全燃烧消耗的氧气量依次减少
10756900110363002020-2021学年梅州高中高一期末考试
化学试卷答案
单项选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
A
C
B
C
D
D
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
A
A
C
D
D
B
B
B
B
二、填空题
21.(16分)
(1)NO、NO2、光化学烟雾、酸雨等(或其他合理答案) (2分)
(2)AD (2分)
(3)4NO+4NH3+O2false4N2+6H2O (2分)
(4)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+H2O(2分)
打开止水夹,挤压饮用水塑料瓶产生少量气泡 (2分)
(5)4NH3+5O24NO+6H2O(2分); 放热(2分)
(6)铜片常温下可以与硝酸发生反应(2分,其他合理答案也给分)
22.(1)①false ②品红溶液 氧化性 ③III false
④不用加热(或节约能源,节约药品)﹔相对安全(或易于控制反应进行,反应更充分) (2) a 空气中含有的false也能与碱石灰反应,造成测量不准确
23(1)锌 Zn-2e?+2OH?=Zn(OH)2 0.4 (2)BC
(3)Al 2H2O+2e?=2OH?+H2↑ (4)①正极 ②负极 ③224
24.(1)>;(2)71.4%;0.125?mol·L-1·min-1 (3)①③; (4)②④⑤
25.(1)CH2=CH2 碳碳双键和醛基 还原反应(或加成反应)
CH3COOH+CH3CH2CH2OHfalseCH3COOCH2CH2CH3+H2O
nCH2=CHCOOH
AD
化学试卷(必修第二册)
一、单项选择题
1.《天工开物》中记载:人贱者短褐、枲裳,冬以御寒,夏以蔽体,其质造物之所具也。属草木者,为枲、麻、苘、葛,属禽兽与昆虫者为裘褐、丝绵。各载其半,而裳服充焉矣。文中的“枲、麻、苘、葛”和“裘褐、丝绵”分别属于
A.纤维素、蛋白质 B.糖类、油脂 C.纤维素、油脂 D.单糖、蛋白质
2.化学与生活、生产、环境等密切相关。下列说法错误的是
A.医疗上用作X射线检查的内服药“钡餐”是BaSO4
B.蛋白质、油脂、糖类一定条件下都能发生水解反应
C.煤的液化、石油的裂化和油脂的皂化都属于化学变化
D.工业上可用氢氟酸雕刻玻璃
3.现代社会的发展与进步离不开材料,下列有关材料的说法正确的是
A. “超轻海绵”使用的石墨烯是新型无机非金属材料
B. “C919”大飞机使用的氮化硅陶瓷是传统无机非金属材料
C. “北斗系统”组网成功,北斗芯片中的半导体材料为二氧化硅
D. “神舟十一号”宇宙飞船返回舱外表面使用的高温结构陶瓷的主要成分是硅酸盐
4.下列说法正确的是
A.重金属盐能使蛋白质变性,所以吞服“钡餐”会引起中毒
B.酿酒过程中葡萄糖在酒化酶的作用下可水解生成乙醇和二氧化碳
C.液态植物油在一定条件下可转化为性质更稳定的氢化植物油
D.淀粉溶液中加入一定量稀硫酸,加热,待溶液冷却,向溶液加入新制的Cu(OH)2,加热,未见砖红色沉淀,证明淀粉没有发生水解
right44455.依据右图中氮元素及其化合物间的转化关系,判断下列说法不正确的是
A.x是N2O5 B.可用排空气法收集NO
C.工业上以NH3、空气、水为原料生产硝酸
D.由NH3→N2,从原理上看,可通过NH3与
NO2反应实现
6.根据下列实验事实得出的相应结论正确的是
选项
实验事实
结论
A
NH3的水溶液可以导电
NH3是电解质
B
SO2通入硝酸钡溶液出现白色沉淀
BaSO3不溶于强酸
C
浓硝酸久置发黄
硝酸不稳定
D
浓硫酸能使蓝色胆矾晶体变成白色
浓硫酸具有脱水性
7.如图所示,用传感技术测定喷泉实验中的压强变化来认识喷泉实验的原理。下列说法不正确的是
A.喷泉实验结束后,发现水未充满三颈烧瓶,可能是因为收集的氨气不纯
B.关闭a,将单孔塞(插有吸入水的胶头滴管)塞紧颈口c,打开b,完成喷泉实验,电脑绘制三颈烧瓶内压强变化曲线如图乙,则C点时喷泉最剧烈
C.工业上,可用蘸有浓盐酸或者液氯的玻璃棒检验液氨是否泄漏
D.三颈烧瓶中充满NH3形成的氨水与换成NO2形成的HNO3溶液的溶质的物质的量浓度不同
8. 用NA表示阿伏加德罗常数的值,下列叙述中正确的是
A.1molfalse中含有碳碳双键的数目为4NA
B.在标准状况下,11.2 L NO与11.2 L O2混合后所含原子数为NA
C.Cu-Zn原电池中,正极产生1.12LH2时,转移的电子数应等于0.1NA
D.将足量的Cu与50mL18mo/L的浓硫酸充分反应,转移的电子数为小于0.9NA
9.反应NO2(g) + CO(g) NO(g) + CO2(g)的能量变化如图所示,下列说法正确的是
39096955715A.图中a→b为放热过程
B.理论上该反应可以设计成原电池
C.升高温度,该反应的化学反应速率减慢
D.该反应中,断裂反应物化学键的能量变化大于形成生成物化学键
的能量变化
349440533210510.银锌电池是一种常见化学电源,其反应原理:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其工作示意图如下。下列说法不正确的是
A.Zn电极发生氧化反应 B.Ag2O电极是电源的正极
C.电池工作时,电子从Zn电极经导线流向Ag2O电极,再出Ag2O电极经电解质溶液流向Zn电极
D.Zn电极上发生的反应:Zn-2e–+2OH–=Zn(OH)2
11.下列关于乙烯、苯、乙醇、乙酸的说法中,不正确的是
A.乙烯能使酸性高锰酸钾溶液褪色,是因为乙烯分子中含有碳碳双键
B.苯可以使溴水褪色,发生了加成反应
C.乙醇在铜催化并加热条件下生成乙醛,乙醇发生了氧化反应
D.生活中可以用食醋除去水壶中的水垢,主要是利用了食醋中醋酸的酸性
12.进行一氯取代反应后,只能生成三种沸点不同的有机物的是
A.(CH3)3CCH2CH3 B.(CH3CH2)2CHCH3 C.(CH3)2CHCH(CH3)2 D.(CH3)2CHCH2CH2CH3
13.有机物A的结构简式如图所示,下列关于A的说法正确的是
301625074930A.A的分子式为C13H14O5
B.1mol Na2CO3最多能消耗1mol有机物A
C.1mol A和足量金属钠反应生成22.4L气体
D.A只能发生取代、氧化、加成反应
14.某有机物的结构简式为HOCH2CH=CHCH2COOH,下列关于该有机物的说法错误的是
A.该有机物含有3种官能团
B.该有机物能发生氧化反应、加成反应、加聚反应、酯化反应
C.该有机物能使溴水和酸性高锰酸钾溶液褪色,其褪色原理一样
338201024130D.1mol该有机物能与2mol Na发生反应
15. 我国学者研究出一种用于催化DMO和氢气反应获得EG的纳米反应器,如图是反应的微观过程示意图。下列说法正确的是
A.Cu纳米颗粒是一种胶体,能将氢气解离成氢原子
B.EG和乙醇是同系物
C.DMO属于一种烃
D.催化过程中断裂的化学键有 H—H、C—O、C===O
16.除去下列物质中的杂质(括号内的物质),所使用的试剂和主要操作都正确的是
选项
物质
使用的试剂
主要操作
A
FeCl2(FeCl3)溶液
过量铜粉
过滤
B
乙烷(乙烯)
酸性高锰酸钾溶液
洗气
C
乙醇(水)
金属钠
蒸馏
D
乙酸乙酯(乙酸)
饱和碳酸钠溶液
分液
17.在一定温度下,向aL密闭容器中加入1mol H2(g)和1mol Br2(g),发生如下反应:H2(g)+Br2(g)2HBr(g)。此反应达到平衡的标志是
A.容器内H2、Br2、HBr的浓度之比为1∶1∶2 B.容器内颜色不随时间变化
C.容器内压强不随时间变化 D.单位时间内消耗n mol H2,同时生成2n mol HBr
18.某同学设计以下实验方案,从海带中提取I2。下列说法不正确的是
A.操作①是过滤
B.②中双氧水作还原剂
C.③的离子方程式是5I–+IO+6H+=3I2+3H2O
D.含I2的溶液经3步转化为I2的悬浊液,其目的是富集
19.短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X的一种核素在考古时常用来鉴定一些文物的年代,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A.化合物XZ2各原子均满足8电子的稳定结构
B.已知含氧酸的酸性:H2ZO3>H2XO3,则Z的非金属性强于X
C.若单质W失火,不能用泡沫灭火器扑灭
D.Y的氢氧化物可用于治疗胃酸过多
20.我国有广阔的海岸线,建设海峡经济区,海水的综合利用大有可为,图为海水综合利用部分流程,有关说法正确的是
A.过程①只发生了化学变化
B.过程④中反应的离子方程式为false
C.过程⑤只需要蒸馏即可得到单质Br2
D.上述工艺流程中涉及到化合、分解、复分解和置换反应
班级 姓名 座号 成绩
题号
1
2
3
4
5
6
7
8
9
10
答案
题号
11
12
13
14
15
16
17
18
19
20
答案
二、填空题
21.(1)含氮元素的相关物质中会对自然环境造成的污染有______
(写一种即可)。
(2)下图是常见的气体发生装置和收集装置(部分装置的夹持仪器已省略),实验室以Cu与浓HNO3反应制备并收集NO2应选择的装置是_____________(填字母)。
318135040640(3)SCR脱硝技术已成为使用广泛和成熟的烟气净化技术,脱硝效率高达90%以上。其催化反应机理如下图所示,写出该反应发生的化学方程式__________________ __ 。
(4)实验室制取NH3的化学反应方程式为_____________________ __ ______ __,收集满NH3后组成如图甲装置,若要引发喷泉,应采取的操作是_________________ 。
(5)NH3的催化氧化是工业制取硝酸的关键步骤,化学方程式为________ ____ ____________ __,将产生的氨气与过量的氧气通入到图乙所示装置中,用酒精灯加热催化剂至红热时反应开始发生,熄灭酒精灯后反应仍能继续进行,说明该反应是___________(填“吸热”或“放热”)反应。
(6)设计实验证明硝酸具有强氧化性________________ _______________ ________ _ _ 。(只要写出实验原理或思路即可,不需写出实验详细步骤)
left75057022.节日期间因燃放鞭炮会引起空气中SO2 含量增大,造成大气污染。某实验小组同学欲探究SO2的性质并测定空气中SO2 的含量。(1)他们设计如下实验装置,请你参与探究,并回答下列问题:
①装置 A1 中发生反应的化学方程式为 ;
②装置 B 用于检验SO2 的漂白性,所盛试剂为 ,装置 D 用于检验SO2 的 性;
③为验证二氧化硫的还原性,反应一段时间后取试管 C 中的溶液分成三份,进行如下实验: 方案Ⅰ:向第一份溶液中加入AgNO3 溶液,有白色沉淀生成;
方案Ⅱ:向第二份溶液中加入品红溶液,红色褪去;
方案Ⅲ:向第三份溶液中加入BaCl2 ,产生白色沉淀上述方案合理的是(填“Ⅰ”、“Ⅱ”、“Ⅲ”);C 中发生的离子方程式为: 。
④为了实现绿色环保的目标,甲同学欲用装置 A2 代替装置 A1 你认为装置 A2 的优点是(写两点) 。
(2)他们拟用以下方法测定空气中SO2 含量(假设空气中无其他还原性气体)。
你认为哪个装置可行 (填序号),另一装置不可行的理由
为 。
(如没有,则不填)
36887153238523.化学电池在通讯、交通及日常生活中有着广泛的应用。(1)碱性锌锰干电池(如图所示)是应用最普遍的电池之一,电池总反应为Zn+2MnO2+2H2O2MnOOH+Zn(OH)2,碱性锌锰干电池的负极材料是__ _(填名称),负极上发生的电极反应为_ __。若反应消耗13g负极材料,则电池中转移电子的物质的量为_ __mol。
(2)铅蓄电池是典型的可充电电池,它的正、负极格板都是惰性材料,电池总反应式为PbO2+2H2SO42PbSO4+2H2O。下列说法正确的是___(填标号)。
A.电解液中H2SO4的浓度始终保持不变
B.放电时正极上的电极反应式为PbO2+2e?+4H++SO=PbSO4+2H2O
C.放电时,当外电路通过1mol电子时,理论上负极质量增加48g
4130040223520D.放电时,溶液中的SO向正极移动
(3)镁铝电池的构造如图所示,当电解质溶液为NaOH溶液时,可知电池的负极材料为_ __(填“Mg”或“Al”),正极上的电极反应式为_ __ 。
(4)被誉为改变末来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。如图为氢氧燃料电池的结构示意图,回答下列问题:
①O2进入的电极为________(填“正极”或“负极”)。
329819067310②电池工作时,溶液中的OH?向___________(填“正极”或“负极”)迁移。
③若电池工作时转移0.04mol电子,理论上消耗标准状态下___________mL O2。
24.一定条件下铁可以和CO2发生反应Fe(s)+CO2(g) FeO(s)+CO(g) △H>0。一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示。
308546533655(1)t1时,正、逆反应速率的大小关系为ν正__________ν逆(填“>”“<”或“=”);
(2)4分钟内,CO2的转化率为__________;CO的平均反应速率v(CO)=__________;
(3)下列条件的改变能减慢其反应速率的是__________(选填序号)
①降低温度 ②减少铁粉的质量 ③保持压强不变,充入He使容器的体积增大
④保持体积不变,充入He使体系压强增大
(4)下列描述能说明上述反应已达平衡的是__________(选填序号)。
①v(CO2)=v(CO) ②单位时间内生成n mol CO2的同时生成n mol CO
③ 容器中气体压强不随时间而变化 ④容器中气体的平均分子量不随时间而变化
⑤混合气体的密度不再变化
25.烃A是一种基础化工原料,标准状况下密度为1.25g·L?1,B与G互为同系物。H是有芳香味的油状液体。有关物质转化关系如下图:
请回答:
(1)化合物A的结构简式为______ _____,化合物F中所含的官能团是_______ __ _ _(填名称),已知G的结构简式为CH3CH2CH2OH,则F→G反应的反应类型是_______ ____。
(2)D+G→H的化学方程式是_____ ______。
(3)E→X的化学方程式是____ __ ___。
(4)下列说法正确的是___________。
A.D+G→H过程,浓硫酸作催化剂和吸水剂 B.H在碱性条件下水解是皂化反应
C.用碳酸钠溶液无法鉴别D、G和H
D.相同物质的量的B、C、D完全燃烧消耗的氧气量依次减少
10756900110363002020-2021学年梅州高中高一期末考试
化学试卷答案
单项选择题
题号
1
2
3
4
5
6
7
8
9
10
答案
A
B
A
C
B
C
D
D
B
C
题号
11
12
13
14
15
16
17
18
19
20
答案
B
A
A
C
D
D
B
B
B
B
二、填空题
21.(16分)
(1)NO、NO2、光化学烟雾、酸雨等(或其他合理答案) (2分)
(2)AD (2分)
(3)4NO+4NH3+O2false4N2+6H2O (2分)
(4)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+H2O(2分)
打开止水夹,挤压饮用水塑料瓶产生少量气泡 (2分)
(5)4NH3+5O24NO+6H2O(2分); 放热(2分)
(6)铜片常温下可以与硝酸发生反应(2分,其他合理答案也给分)
22.(1)①false ②品红溶液 氧化性 ③III false
④不用加热(或节约能源,节约药品)﹔相对安全(或易于控制反应进行,反应更充分) (2) a 空气中含有的false也能与碱石灰反应,造成测量不准确
23(1)锌 Zn-2e?+2OH?=Zn(OH)2 0.4 (2)BC
(3)Al 2H2O+2e?=2OH?+H2↑ (4)①正极 ②负极 ③224
24.(1)>;(2)71.4%;0.125?mol·L-1·min-1 (3)①③; (4)②④⑤
25.(1)CH2=CH2 碳碳双键和醛基 还原反应(或加成反应)
CH3COOH+CH3CH2CH2OHfalseCH3COOCH2CH2CH3+H2O
nCH2=CHCOOH
AD
同课章节目录
