2012高考化学创新方案学习课件:第三章 第三节 第二课时 影响盐类水解的主要因素和盐类水解的应用
文档属性
| 名称 | 2012高考化学创新方案学习课件:第三章 第三节 第二课时 影响盐类水解的主要因素和盐类水解的应用 |  | |
| 格式 | zip | ||
| 文件大小 | 662.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-22 12:16:04 | ||
图片预览








文档简介
(共51张PPT)
第二课时 影响盐类水解的主要因素和盐类水解的应用
一、影响盐类水解的主要因素
1.盐本身的性质
生成盐的弱酸越 ,该盐的水解程度越 ,生成盐的弱碱越弱,该盐的水解程度越 .
弱
大
大
2.反应条件的影响
(1)[实验探究] 影响FeCl3水解的因素
水解反应的离子方程式为:
.
Fe3++3H2O Fe(OH)3+3H+
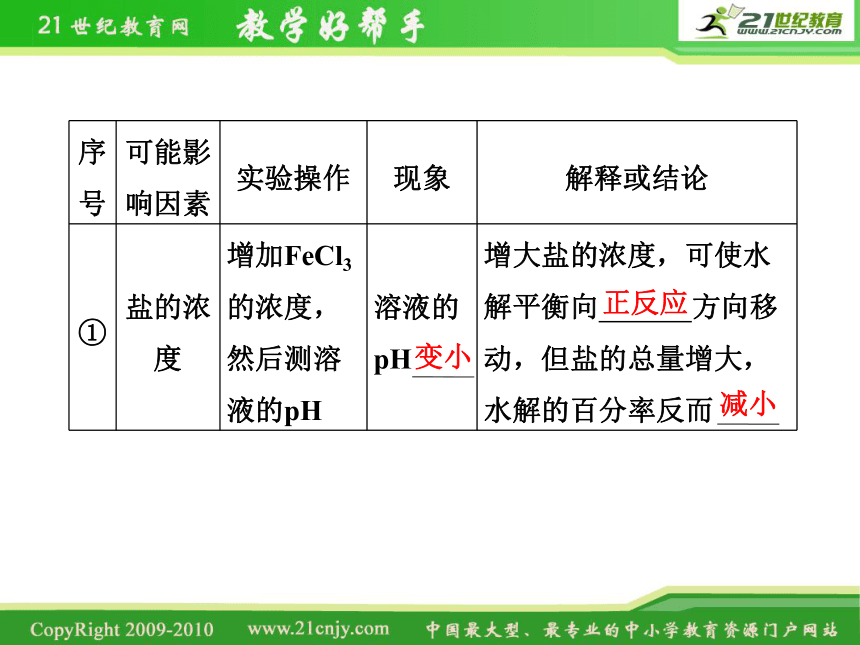
序号 可能影响因素 实验操作 现象 解释或结论
① 盐的浓度 增加FeCl3的浓度,然后测溶液的pH 溶液的pH 增大盐的浓度,可使水解平衡向 方向移动,但盐的总量增大,水解的百分率反而
变小
正反应
减小
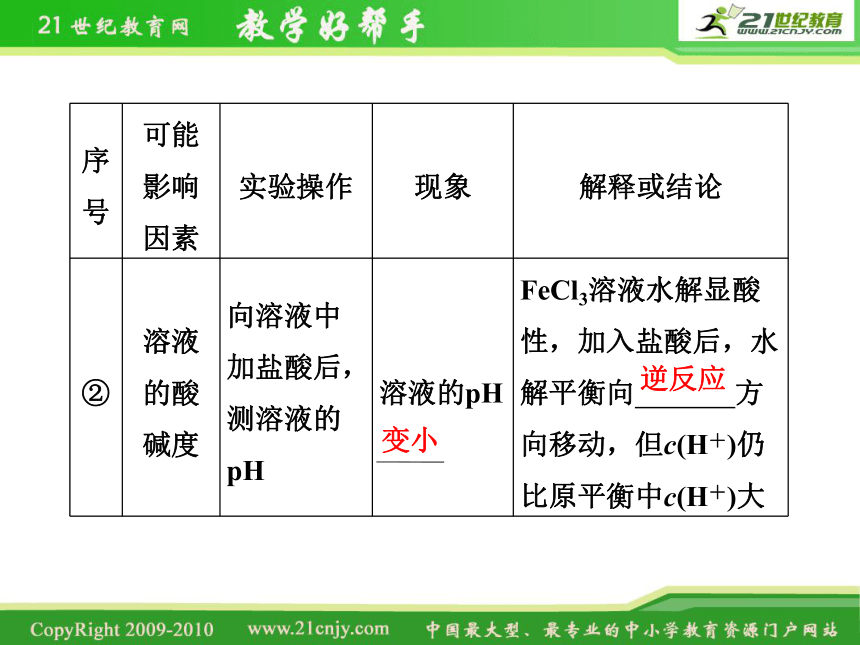
序号 可能影响因素 实验操作 现象 解释或结论
② 溶液的酸碱度 向溶液中加盐酸后,测溶液的pH 溶液的pH FeCl3溶液水解显酸性,加入盐酸后,水解平衡向 方向移动,但c(H+)仍比原平衡中c(H+)大
变小
逆反应
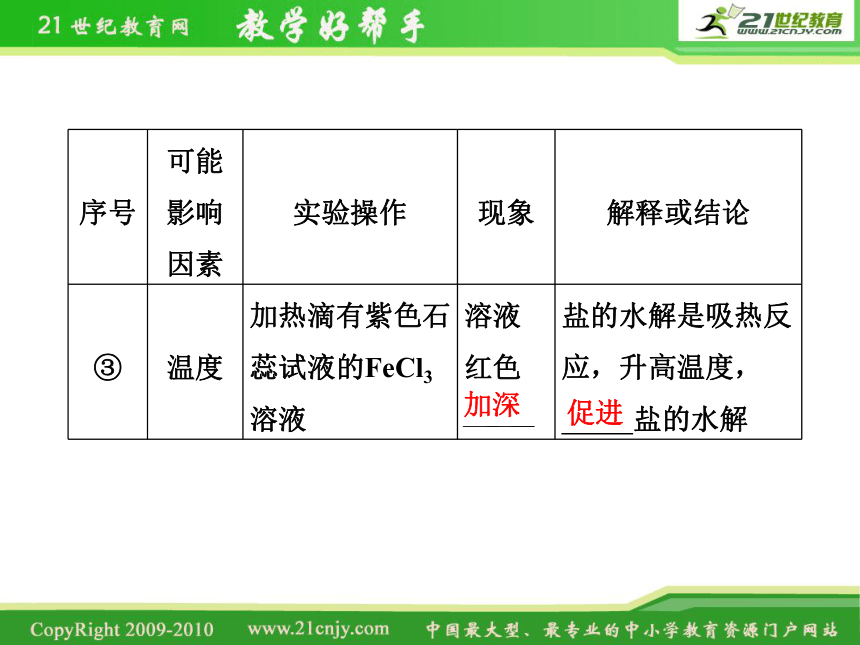
序号 可能影响因素 实验操作 现象 解释或结论
③ 温度 加热滴有紫色石蕊试液的FeCl3溶液 溶液红色
盐的水解是吸热反应,升高温度,
盐的水解
加深
促进
(2)[结论]
①浓度:增大盐的浓度,可使水解平衡向 方向移动,水解程度 ,加水稀释,水解平衡向 方向移动,水解程度 .
②增大c(H+)可促进 水解,抑制 水解;增大c(OH-)可促进 水解,抑制 水解.
③温度:升高温度,水解平衡向 方向移动,水解程度 .
增大
正
减小
正
增大
阴离子
阳离子
阴离子
阴离子
正
0.1 mol/L的Na2CO3溶液与1 mol/L的Na2CO3溶液相比,水解程度大还是小?碱性哪个强?
提示:0.1 mol/L的Na2CO3溶液水解程度大,1 mol/L的Na2CO3溶液碱性强.
二、盐类水解反应的应用
(1)用热纯碱液去污,加热可促进Na2CO3的水解,使溶液
中c(OH-)增大,去污能力增强.
(2)配制易水解的盐溶液,如配制FeCl3水溶液时,加入少
量的盐酸,以防止溶液浑浊.
(3)用作净水剂,如铝盐、铁盐溶于水时,水解生成氢氧
化物胶体,可以净水.
(4)制备无机化合物,如用TiCl4制备TiO2.其反应的方程
式为TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl.
2.常温下,由水电离的c(OH-)=10-3 mol/L时,可能
是NaOH溶液,也可能是FeCl3溶液 ( )
提示:错误.纯水电离的c(OH-)=c(H+)=10-7 mol/L,10-3 mol/L>10-7 mol/L,所以c(OH-)=10-3 mol/L的溶液促进了水的电离.一定不是酸溶液也不是碱溶液,可能是盐溶液.
一、盐类水解的应用
1.实验室配制和储存易水解的盐溶液
配制FeCl3溶液时加入一定量的盐酸,防止铁离子水解,
配制CuSO4溶液时加入少量的硫酸,防止铜离子水解.
2.某些活泼金属与强酸弱碱盐反应
Mg放入NH4Cl、CuCl2、FeCl3溶液中产生氢气.
6.判断盐溶液的酸碱性或pH
如相同物质的量浓度的下列溶液:NaCl、KHSO4、Na3PO4、Na2HPO4、CH3COOH,pH由大到小的顺序为Na3PO4>Na2HPO4>NaCl>CH3COOH>KHSO4.
7.加热蒸发盐溶液时所得固体
不分解的盐溶液加热蒸干时,析出盐的晶体,如NaCl溶液;能水解,但生成的酸不挥发,也能析出该盐的晶体,如Al2(SO4)3溶液,能水解,但水解后生成的酸有挥发性,则析出金属氢氧化物,若蒸干后继续加热,则可分解为金属氧化物,如AlCl3、FeCl3.若盐在较低温度下受热能分解,则加热蒸干其溶液时,盐已分解,如Ca(HCO3)2.
8.判断盐所对应酸的相对强弱
如已知物质的量浓度相同的两种盐溶液NaA和NaB,其溶液的pH前者大于后者,则酸HA和HB的酸性强弱为HB>HA.
9.某些试剂的实验室贮存
如Na2CO3溶液、Na3PO4溶液等不能贮存于磨口玻璃瓶中.
10.证明弱酸或弱碱的某些实验要考虑盐的水解
如证明Cu(OH)2为弱碱时,可用CuCl2溶液能使蓝色石蕊试纸变红(显酸性)证明之.
11.除杂
(1)采用加热的方法来促进溶液中某些盐的水解,使之
生成氢氧化物沉淀,以除去溶液中某些金属离子.例如,不纯的KNO3溶液中常含有杂质Fe3+,可用加热的方法来除去KNO3溶液中所含的Fe3+.
(2)向MgCl2、FeCl3的混合溶液中加入MgO以除去
FeCl3.
3.常见题型
(1)多元弱酸溶液中,根据弱酸的分步电离进行分析.
(2)多元弱酸的正盐溶液中,按弱酸根离子的分步水解进
行分析.
(3)不同溶液中同一离子浓度大小的比较,要看溶液中其
他离子对该离子的影响.
(4)混合溶液中各离子浓度的比较,要进行综合分析,如
电离因素、水解因素等.
[特别关注]
质子守恒可以利用物料守恒和电荷守恒综合推断解决,往往出现分子要优先考虑物料守恒,仅出现离子可优先考虑电荷守恒,如果二者均不能判断,再利用质子守恒.
考查点一 水解平衡及影响因素
[答案] D
[关键一点]
利用水解平衡的移动,除去溶液中的杂质离子时,不能引入新的杂质离子,除去MgCl2酸性溶液中的Fe3+时,除了用MgCO3外还可加入Mg、MgO、Mg(OH)2等物质,消耗了H+,使水解平衡移动,但又没有引入新的杂质.
1.向三份0.1 mol/L CH3COONa溶液中分别加入少量
NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
解析:本题考查盐类水解的影响因素.CH3COONa为强碱弱酸盐,水解后呈碱性,NH4NO3和FeCl3水解呈酸性,因此这两种盐会促进CH3COONa的水解,溶液中的CH3COO-浓度减小;Na2SO3为强碱弱酸盐,水解后溶液呈碱性,抑制CH3COONa的水解,溶液中的CH3COO-浓度增大.
答案: A
考查点二 盐类水解的应用
[例2] 下列有关问题,与盐的水解有关的是 ( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
[解析] ①中NH4Cl与ZnCl2溶液水解均显酸性,可以除
去金属表面的锈.②HCO与Al3+两种离子水解相互促进,产生二氧化碳,可作灭火剂.③草木灰的主要成分为碳
酸钾,水解显碱性,而铵态氮肥水解显酸性,因而不能
混合施用.④碳酸钠溶液水解显碱性,而磨口玻璃塞中
的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏合在
一起而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡
胶塞.⑤AlCl3溶液中存在水解平衡:AlCl3+3H2O
Al(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体.
[答案] D
2.下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.粗盐在空气中易潮解
C.加热氯化铁溶液颜色变深
D.浓硫化钠溶液有臭味
答案:B
解析:A项,碳酸钠水解显碱性,利用油污在碱性条件下水解生成可溶于水的物质而达到去污目的;C项,氯化铁溶液中发生Fe3++3H2O Fe(OH)3+3H+,在加热条件下水解平衡正向移动造成体系颜色加深;D项,硫化钠溶液中存在S2-+H2O HS-+OH-,HS-+H2O H2S+OH-,水解产物H2S是产生臭味的原因;B项,粗盐中混有MgCl2、CaCl2易结合空气中的水蒸气发生潮解,这与盐类的水解无关.
考查点三 溶液离子浓度的比较
[例3] 常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后(若混合后两者的体积可以相加),恰好完全反应,则下列有关所得混合液的说法正确的是 ( )
A.所得混合液中c(Na+)>c(CH3COO-)>c(H+)>
c(OH-)
B.混合后溶液pH=7
C.所得混合液中存在c(CH3COOH)+c(CH3COO-)=
0.05 mol/L
D.混合后溶液中存在c(CH3COOH)+c(CH3COO-)=
c(Na+)+c(H+)
[答案] C
[关键一点]
离子浓度大小比较中的“一”、“二”、“三”:
“一”指一个原理,“二”指两类平衡,电离平衡和水解平衡;“三”指三个守恒,电荷守恒、物料守恒和质子守恒.其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,溶液呈电中性;物料守恒是指某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和;质子守恒是指溶液中由水电离出来的H+和OH-总是相等的.质子守恒可由电荷守恒和物料守恒联立推导出来.
答案: C
解析:C项的电荷不守恒,在什么情况下都不可能出现.
点击此图片进入训练全程跟踪
第二课时 影响盐类水解的主要因素和盐类水解的应用
一、影响盐类水解的主要因素
1.盐本身的性质
生成盐的弱酸越 ,该盐的水解程度越 ,生成盐的弱碱越弱,该盐的水解程度越 .
弱
大
大
2.反应条件的影响
(1)[实验探究] 影响FeCl3水解的因素
水解反应的离子方程式为:
.
Fe3++3H2O Fe(OH)3+3H+
序号 可能影响因素 实验操作 现象 解释或结论
① 盐的浓度 增加FeCl3的浓度,然后测溶液的pH 溶液的pH 增大盐的浓度,可使水解平衡向 方向移动,但盐的总量增大,水解的百分率反而
变小
正反应
减小
序号 可能影响因素 实验操作 现象 解释或结论
② 溶液的酸碱度 向溶液中加盐酸后,测溶液的pH 溶液的pH FeCl3溶液水解显酸性,加入盐酸后,水解平衡向 方向移动,但c(H+)仍比原平衡中c(H+)大
变小
逆反应
序号 可能影响因素 实验操作 现象 解释或结论
③ 温度 加热滴有紫色石蕊试液的FeCl3溶液 溶液红色
盐的水解是吸热反应,升高温度,
盐的水解
加深
促进
(2)[结论]
①浓度:增大盐的浓度,可使水解平衡向 方向移动,水解程度 ,加水稀释,水解平衡向 方向移动,水解程度 .
②增大c(H+)可促进 水解,抑制 水解;增大c(OH-)可促进 水解,抑制 水解.
③温度:升高温度,水解平衡向 方向移动,水解程度 .
增大
正
减小
正
增大
阴离子
阳离子
阴离子
阴离子
正
0.1 mol/L的Na2CO3溶液与1 mol/L的Na2CO3溶液相比,水解程度大还是小?碱性哪个强?
提示:0.1 mol/L的Na2CO3溶液水解程度大,1 mol/L的Na2CO3溶液碱性强.
二、盐类水解反应的应用
(1)用热纯碱液去污,加热可促进Na2CO3的水解,使溶液
中c(OH-)增大,去污能力增强.
(2)配制易水解的盐溶液,如配制FeCl3水溶液时,加入少
量的盐酸,以防止溶液浑浊.
(3)用作净水剂,如铝盐、铁盐溶于水时,水解生成氢氧
化物胶体,可以净水.
(4)制备无机化合物,如用TiCl4制备TiO2.其反应的方程
式为TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl.
2.常温下,由水电离的c(OH-)=10-3 mol/L时,可能
是NaOH溶液,也可能是FeCl3溶液 ( )
提示:错误.纯水电离的c(OH-)=c(H+)=10-7 mol/L,10-3 mol/L>10-7 mol/L,所以c(OH-)=10-3 mol/L的溶液促进了水的电离.一定不是酸溶液也不是碱溶液,可能是盐溶液.
一、盐类水解的应用
1.实验室配制和储存易水解的盐溶液
配制FeCl3溶液时加入一定量的盐酸,防止铁离子水解,
配制CuSO4溶液时加入少量的硫酸,防止铜离子水解.
2.某些活泼金属与强酸弱碱盐反应
Mg放入NH4Cl、CuCl2、FeCl3溶液中产生氢气.
6.判断盐溶液的酸碱性或pH
如相同物质的量浓度的下列溶液:NaCl、KHSO4、Na3PO4、Na2HPO4、CH3COOH,pH由大到小的顺序为Na3PO4>Na2HPO4>NaCl>CH3COOH>KHSO4.
7.加热蒸发盐溶液时所得固体
不分解的盐溶液加热蒸干时,析出盐的晶体,如NaCl溶液;能水解,但生成的酸不挥发,也能析出该盐的晶体,如Al2(SO4)3溶液,能水解,但水解后生成的酸有挥发性,则析出金属氢氧化物,若蒸干后继续加热,则可分解为金属氧化物,如AlCl3、FeCl3.若盐在较低温度下受热能分解,则加热蒸干其溶液时,盐已分解,如Ca(HCO3)2.
8.判断盐所对应酸的相对强弱
如已知物质的量浓度相同的两种盐溶液NaA和NaB,其溶液的pH前者大于后者,则酸HA和HB的酸性强弱为HB>HA.
9.某些试剂的实验室贮存
如Na2CO3溶液、Na3PO4溶液等不能贮存于磨口玻璃瓶中.
10.证明弱酸或弱碱的某些实验要考虑盐的水解
如证明Cu(OH)2为弱碱时,可用CuCl2溶液能使蓝色石蕊试纸变红(显酸性)证明之.
11.除杂
(1)采用加热的方法来促进溶液中某些盐的水解,使之
生成氢氧化物沉淀,以除去溶液中某些金属离子.例如,不纯的KNO3溶液中常含有杂质Fe3+,可用加热的方法来除去KNO3溶液中所含的Fe3+.
(2)向MgCl2、FeCl3的混合溶液中加入MgO以除去
FeCl3.
3.常见题型
(1)多元弱酸溶液中,根据弱酸的分步电离进行分析.
(2)多元弱酸的正盐溶液中,按弱酸根离子的分步水解进
行分析.
(3)不同溶液中同一离子浓度大小的比较,要看溶液中其
他离子对该离子的影响.
(4)混合溶液中各离子浓度的比较,要进行综合分析,如
电离因素、水解因素等.
[特别关注]
质子守恒可以利用物料守恒和电荷守恒综合推断解决,往往出现分子要优先考虑物料守恒,仅出现离子可优先考虑电荷守恒,如果二者均不能判断,再利用质子守恒.
考查点一 水解平衡及影响因素
[答案] D
[关键一点]
利用水解平衡的移动,除去溶液中的杂质离子时,不能引入新的杂质离子,除去MgCl2酸性溶液中的Fe3+时,除了用MgCO3外还可加入Mg、MgO、Mg(OH)2等物质,消耗了H+,使水解平衡移动,但又没有引入新的杂质.
1.向三份0.1 mol/L CH3COONa溶液中分别加入少量
NH4NO3、Na2SO3、FeCl3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 ( )
A.减小、增大、减小 B.增大、减小、减小
C.减小、增大、增大 D.增大、减小、增大
解析:本题考查盐类水解的影响因素.CH3COONa为强碱弱酸盐,水解后呈碱性,NH4NO3和FeCl3水解呈酸性,因此这两种盐会促进CH3COONa的水解,溶液中的CH3COO-浓度减小;Na2SO3为强碱弱酸盐,水解后溶液呈碱性,抑制CH3COONa的水解,溶液中的CH3COO-浓度增大.
答案: A
考查点二 盐类水解的应用
[例2] 下列有关问题,与盐的水解有关的是 ( )
①NH4Cl与ZnCl2溶液可作焊接金属中的除锈剂
②用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂
③草木灰与铵态氮肥不能混合施用
④实验室盛放碳酸钠溶液的试剂瓶不能用磨口玻璃塞
⑤加热蒸干AlCl3溶液得到Al(OH)3固体
A.①②③ B.②③④ C.①④⑤ D.①②③④⑤
[解析] ①中NH4Cl与ZnCl2溶液水解均显酸性,可以除
去金属表面的锈.②HCO与Al3+两种离子水解相互促进,产生二氧化碳,可作灭火剂.③草木灰的主要成分为碳
酸钾,水解显碱性,而铵态氮肥水解显酸性,因而不能
混合施用.④碳酸钠溶液水解显碱性,而磨口玻璃塞中
的二氧化硅会与碱反应生成硅酸钠将瓶塞与瓶口黏合在
一起而打不开,因此实验室盛放碳酸钠的试剂瓶应用橡
胶塞.⑤AlCl3溶液中存在水解平衡:AlCl3+3H2O
Al(OH)3+3HCl,加热时,HCl挥发使平衡不断右移,最终得到Al(OH)3固体.
[答案] D
2.下列过程或现象与盐类水解无关的是 ( )
A.纯碱溶液去油污
B.粗盐在空气中易潮解
C.加热氯化铁溶液颜色变深
D.浓硫化钠溶液有臭味
答案:B
解析:A项,碳酸钠水解显碱性,利用油污在碱性条件下水解生成可溶于水的物质而达到去污目的;C项,氯化铁溶液中发生Fe3++3H2O Fe(OH)3+3H+,在加热条件下水解平衡正向移动造成体系颜色加深;D项,硫化钠溶液中存在S2-+H2O HS-+OH-,HS-+H2O H2S+OH-,水解产物H2S是产生臭味的原因;B项,粗盐中混有MgCl2、CaCl2易结合空气中的水蒸气发生潮解,这与盐类的水解无关.
考查点三 溶液离子浓度的比较
[例3] 常温时将pH=3的CH3COOH溶液与pH=13的NaOH溶液等体积混合后(若混合后两者的体积可以相加),恰好完全反应,则下列有关所得混合液的说法正确的是 ( )
A.所得混合液中c(Na+)>c(CH3COO-)>c(H+)>
c(OH-)
B.混合后溶液pH=7
C.所得混合液中存在c(CH3COOH)+c(CH3COO-)=
0.05 mol/L
D.混合后溶液中存在c(CH3COOH)+c(CH3COO-)=
c(Na+)+c(H+)
[答案] C
[关键一点]
离子浓度大小比较中的“一”、“二”、“三”:
“一”指一个原理,“二”指两类平衡,电离平衡和水解平衡;“三”指三个守恒,电荷守恒、物料守恒和质子守恒.其中电荷守恒是指溶液中阳离子所带正电荷总数等于阴离子所带负电荷总数,溶液呈电中性;物料守恒是指某一组分的原始浓度应该等于它在溶液中各种存在形式的浓度之和;质子守恒是指溶液中由水电离出来的H+和OH-总是相等的.质子守恒可由电荷守恒和物料守恒联立推导出来.
答案: C
解析:C项的电荷不守恒,在什么情况下都不可能出现.
点击此图片进入训练全程跟踪
