2012高二化学优化巩固课件:第四章 第三节 第一课时 电 解 原 理(新人教版选修4)
文档属性
| 名称 | 2012高二化学优化巩固课件:第四章 第三节 第一课时 电 解 原 理(新人教版选修4) |  | |
| 格式 | zip | ||
| 文件大小 | 647.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2012-04-22 15:26:17 | ||
图片预览











文档简介
(共48张PPT)
第一课时 电 解 原 理
一、电解
1.概念
使电流通过 而在阴、阳两极引起
的过程.
电解质溶液
氧化还原反应
2.特点
(1)电解是最强有力的 手段,是 (填“
可逆”或“不可逆”)的.
(2)电解质溶液的导电过程,就是电解质溶液的
过程.
氧化还原
不可逆
电解
二、电解池
1.定义
把 能转化成 能的装置.
电
化学
2.形成条件
(1) 电源;
(2)两个电极:与电源正极相连的一极是 极;与电源负
极相连的一极是 极;
(3)电解质 或 电解质;
(4)形成 回路.
直流
熔融
阳
阴
溶液
闭合
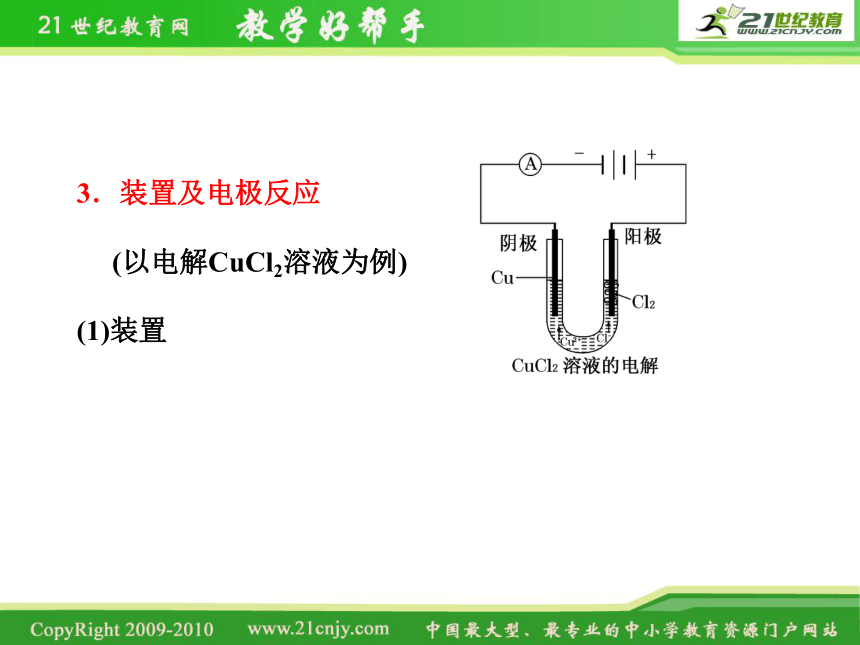
3.装置及电极反应
(以电解CuCl2溶液为例)
(1)装置
(2)电极反应
阴极 发生 反应
阳极 ,发生 反应
总反应
Cu2++2e-===Cu
还原
2Cl--2e-===Cl2↑
氧化
CuCl2 Cu+Cl2↑
4.电子流向和离子流向
(1)电子流向
电源 极―→电解池 极
电解池 极―→电源 极
(2)离子流向
阳离子―→电解池 极
阴离子―→电解池 极
负
阴
阳
正
阴
阳
在氯化铜溶液中除了Cu2+和Cl-之外还有H+和OH-,这两种离子为什么没有得或失电子?
提示:Cu2+比H+更容易得电子,而Cl-比OH-更容易失电子,可从氧化性强弱的方面判断得电子的顺序,从还原性强弱的角度比较失电子的顺序.
2.电解池的形成条件必须有电极、电解质溶液和电源、
形成闭合回路这四个条件 ( )
提示:错误.四个条件中,电解质溶液不是必需的,其他三个条件都是必需.因为有的电解是电解质在熔化状态下进行的,不一定非要形成溶液.
3.电解和电离的本质是一样的 ( )
提示:错误.电解需要在外接电源作用下进行,而电离是电解质在水分子的作用下解离成自由移动的离子的过程,电离不需要通电.
4.电解进行时,电子从电源的负极,沿导线经电解液
一直流回到电源的正极.而电流沿相反的方向,从电源正极沿导线经电解液一直流到电源的负极( )
提示:错误.电子不能通过电解质溶液.
一、电解中电极产物的判断
1.阳极产物的判断
(1)如果是活性电极(金属活动性顺序表中Ag以前),则电
极材料失电子,电极被溶解,溶液中的阴离子不能失电子.
(2)如果是惰性电极(Pt、Au、石墨),则要再看溶液中离
子的失电子能力,此时根据阴离子放电顺序加以判断.阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根(SO 、NO 等)>F-.
2-4
-3
2.阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(H+浓度较大时)>Pb2+>Sn2+>Fe2+>Zn2+>H+(H+浓度较小时)>Al3+>Mg2+>Na+>Ca2+>K+.
[特别关注]
阴、阳离子的放电顺序不是绝对化的,放电情况与离子性质、溶液浓度、电流密度和电极材料有关.在理解以上放电顺序时要特别注意,如Pb2+、Sn2+、Fe2+、Zn2+在H+浓度小时放电能力排在H+前面,在H+浓度大时放电能力排在H+后面.Al3+、Mg2+、Na+、Ca2+、K+只在熔融状态下放电,而在水溶液里不放电.
二、电极反应式和总反应式的书写
1.根据给出的两个电极反应式,写总反应式.
已知两个电极反应式,写总反应式时,要使两个电极反应式得失电子数相等,将两式相加,消去相同的化学式即可.
2.给出总反应式,写出电极反应式.
书写电极反应式的步骤一般分为四步:
(1)列物质、标得失;(2)选离子、配电荷;(3)配个数、巧用水;(4)两式加、验总式.
3.根据信息给予的知识,写电极反应式和总反应式.
[特别关注]
解答有关电解问题的步骤
(1)首先要判定是否为电解池,有外接直流电源则为电解池,否则不是电解池.
(2)对于电解池,首先要考虑阳极材料,若为惰性电极,溶液中的阴离子被氧化;若为活性电极,则被氧化的是电极本身.
(3)若溶液中的阴、阳离子有多种,则根据离子放电顺序判定什么离子先放电,什么离子后放电,并写出电极方程式.
(4)根据电极方程式解答相关问题.
三、用惰性电极电解时电解液的类型
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
电解
水型 含氧酸 H2SO4 4H++4e-===2H2↑ 4OH--4e-===2H2O+O2↑ 2H2O
2H2↑+O2↑ 水 增大 减小 加水
可溶性强碱 NaOH 增大
活泼金属含氧酸盐 KNO3 不变
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
电解电解质型 无氧酸 HCl 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2HCl
H2↑+Cl2↑ 电解质 减小 增大 氯化氢
不活泼金属无
氧酸盐 CuCl2 Cu2++2e-===Cu 2Cl--2e-===Cl2↑ CuCl2
Cu+Cl2↑ 氯化铜
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
放H2生碱型 活泼金属无氧酸盐 NaCl 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2NaCl+2H2O
2NaOH+H2↑+Cl2↑ 电解质和水 生成新电解质 增大 氯化氢
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
放O2生酸型 不活泼金属含氧酸盐 CuSO4 2Cu2++4e-===2Cu 4OH--4e-===2H2O+O2↑ 2CuSO4+2H2O
2Cu+2H2SO4+O2↑ 电解质和水 生成新电解质 减小 氧化铜或碳酸铜
[特别关注]
(1)用惰性电极电解电解质水溶液时,首先要全面分析电解质溶液的组成,找全离子并分为阴、阳两组,然后排出阴、阳离子的放电顺序,写出两极上的电极反应式,根据两极的电极反应式写出反应的总方程式.
(2)若阴极为H+放电,则阴极区c(OH-)增大;若阳极区OH-放电,则阳极区c(H+)增大;若阴、阳极同时有H+、OH-放电,相当于电解水,电解质溶液浓度增大.
考查点一 电解原理和电解池
[例1] 如图是电解CuCl2溶液的装置,
其中c、d为石墨电极,则下列有关判
断正确的是 ( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
[答案] C
[解析] 电流从电源的正极流出,故a为电源的正极,b为负极;与电源正极相连的c为阳极,与电源负极相连的d为阴极.在电解过程中,因为Cu2+是阳离子,移向阴极d,在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极c,在阳极放电析出Cl2,导致溶液中氯离子浓度降低.
1.下列有关电解池的说法正确的是 ( )
A.在电解池中与外接电源负极相连的电极是阳极
B.电解任何物质阳极上失电子数与阴极上得电子数
相等
C.电解氯化铜溶液时在阴极上有气体生成
D.电解NaCl、CuCl2两种溶液参加反应的物质是相
同的
解析:与负极相连的是阴极;电解氯化铜时阳极上有氯气生成.阴极上有铜析出;电解NaCl溶液时水参加了反应,而电解CuCl2溶液,水没有参加反应.
答案: B
考查点二 电极产物的判断
[答案] A
2.某同学按如图所示的装置进行电解实验.下列说法正
确的是 ( )
答案: BC
考查点三 电解基本规律的应用
[例3] 用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是 ( )
A.AgNO3[AgNO3] B.NaOH[H2O]
C.KCl[KCl] D.CuSO4[Cu(OH)2]
[答案] B
[关键一点]
将两电极析出的物质化合,所得产物可使溶液复原,如电解饱和食盐水时,要使溶液复原,只需通入HCl气体即可(H2+Cl2===2HCl),而不是加入盐酸.
3.用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物
质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物
质的量之比为1∶1
答案: D
解析:电解稀H2SO4,实质是电解水,因溶剂减少,H2SO4浓度将增大,故溶液的pH变小;电解稀NaOH溶液,虽然OH-在阳极放电,但H+同时也在阴极放电,其实质同样是电解水,溶液的浓度也将变大,故溶液的pH变大;电解Na2SO4溶液,其实质也是电解水,在阴极和阳极分别析出H2和O2,二者的物质的量之比为2∶1,而非1∶2,电解CuCl2溶液,在阴、阳两极上分别析出Cu和Cl2,二者的物质的量之比为1∶1.
点击此图片进入训练全程跟踪
第一课时 电 解 原 理
一、电解
1.概念
使电流通过 而在阴、阳两极引起
的过程.
电解质溶液
氧化还原反应
2.特点
(1)电解是最强有力的 手段,是 (填“
可逆”或“不可逆”)的.
(2)电解质溶液的导电过程,就是电解质溶液的
过程.
氧化还原
不可逆
电解
二、电解池
1.定义
把 能转化成 能的装置.
电
化学
2.形成条件
(1) 电源;
(2)两个电极:与电源正极相连的一极是 极;与电源负
极相连的一极是 极;
(3)电解质 或 电解质;
(4)形成 回路.
直流
熔融
阳
阴
溶液
闭合
3.装置及电极反应
(以电解CuCl2溶液为例)
(1)装置
(2)电极反应
阴极 发生 反应
阳极 ,发生 反应
总反应
Cu2++2e-===Cu
还原
2Cl--2e-===Cl2↑
氧化
CuCl2 Cu+Cl2↑
4.电子流向和离子流向
(1)电子流向
电源 极―→电解池 极
电解池 极―→电源 极
(2)离子流向
阳离子―→电解池 极
阴离子―→电解池 极
负
阴
阳
正
阴
阳
在氯化铜溶液中除了Cu2+和Cl-之外还有H+和OH-,这两种离子为什么没有得或失电子?
提示:Cu2+比H+更容易得电子,而Cl-比OH-更容易失电子,可从氧化性强弱的方面判断得电子的顺序,从还原性强弱的角度比较失电子的顺序.
2.电解池的形成条件必须有电极、电解质溶液和电源、
形成闭合回路这四个条件 ( )
提示:错误.四个条件中,电解质溶液不是必需的,其他三个条件都是必需.因为有的电解是电解质在熔化状态下进行的,不一定非要形成溶液.
3.电解和电离的本质是一样的 ( )
提示:错误.电解需要在外接电源作用下进行,而电离是电解质在水分子的作用下解离成自由移动的离子的过程,电离不需要通电.
4.电解进行时,电子从电源的负极,沿导线经电解液
一直流回到电源的正极.而电流沿相反的方向,从电源正极沿导线经电解液一直流到电源的负极( )
提示:错误.电子不能通过电解质溶液.
一、电解中电极产物的判断
1.阳极产物的判断
(1)如果是活性电极(金属活动性顺序表中Ag以前),则电
极材料失电子,电极被溶解,溶液中的阴离子不能失电子.
(2)如果是惰性电极(Pt、Au、石墨),则要再看溶液中离
子的失电子能力,此时根据阴离子放电顺序加以判断.阴离子放电顺序:S2->I->Br->Cl->OH->含氧酸根(SO 、NO 等)>F-.
2-4
-3
2.阴极产物的判断
直接根据阳离子放电顺序进行判断,阳离子放电顺序:Ag+>Hg2+>Fe3+>Cu2+>H+(H+浓度较大时)>Pb2+>Sn2+>Fe2+>Zn2+>H+(H+浓度较小时)>Al3+>Mg2+>Na+>Ca2+>K+.
[特别关注]
阴、阳离子的放电顺序不是绝对化的,放电情况与离子性质、溶液浓度、电流密度和电极材料有关.在理解以上放电顺序时要特别注意,如Pb2+、Sn2+、Fe2+、Zn2+在H+浓度小时放电能力排在H+前面,在H+浓度大时放电能力排在H+后面.Al3+、Mg2+、Na+、Ca2+、K+只在熔融状态下放电,而在水溶液里不放电.
二、电极反应式和总反应式的书写
1.根据给出的两个电极反应式,写总反应式.
已知两个电极反应式,写总反应式时,要使两个电极反应式得失电子数相等,将两式相加,消去相同的化学式即可.
2.给出总反应式,写出电极反应式.
书写电极反应式的步骤一般分为四步:
(1)列物质、标得失;(2)选离子、配电荷;(3)配个数、巧用水;(4)两式加、验总式.
3.根据信息给予的知识,写电极反应式和总反应式.
[特别关注]
解答有关电解问题的步骤
(1)首先要判定是否为电解池,有外接直流电源则为电解池,否则不是电解池.
(2)对于电解池,首先要考虑阳极材料,若为惰性电极,溶液中的阴离子被氧化;若为活性电极,则被氧化的是电极本身.
(3)若溶液中的阴、阳离子有多种,则根据离子放电顺序判定什么离子先放电,什么离子后放电,并写出电极方程式.
(4)根据电极方程式解答相关问题.
三、用惰性电极电解时电解液的类型
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
电解
水型 含氧酸 H2SO4 4H++4e-===2H2↑ 4OH--4e-===2H2O+O2↑ 2H2O
2H2↑+O2↑ 水 增大 减小 加水
可溶性强碱 NaOH 增大
活泼金属含氧酸盐 KNO3 不变
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
电解电解质型 无氧酸 HCl 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2HCl
H2↑+Cl2↑ 电解质 减小 增大 氯化氢
不活泼金属无
氧酸盐 CuCl2 Cu2++2e-===Cu 2Cl--2e-===Cl2↑ CuCl2
Cu+Cl2↑ 氯化铜
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
放H2生碱型 活泼金属无氧酸盐 NaCl 2H++2e-===H2↑ 2Cl--2e-===Cl2↑ 2NaCl+2H2O
2NaOH+H2↑+Cl2↑ 电解质和水 生成新电解质 增大 氯化氢
类型 电解质特点 实例 电极反应式 电解方程式 电解对象 电解质 溶液 电解质
阴极 阳极 溶液浓度的变化 pH变化 溶液复原的方法
放O2生酸型 不活泼金属含氧酸盐 CuSO4 2Cu2++4e-===2Cu 4OH--4e-===2H2O+O2↑ 2CuSO4+2H2O
2Cu+2H2SO4+O2↑ 电解质和水 生成新电解质 减小 氧化铜或碳酸铜
[特别关注]
(1)用惰性电极电解电解质水溶液时,首先要全面分析电解质溶液的组成,找全离子并分为阴、阳两组,然后排出阴、阳离子的放电顺序,写出两极上的电极反应式,根据两极的电极反应式写出反应的总方程式.
(2)若阴极为H+放电,则阴极区c(OH-)增大;若阳极区OH-放电,则阳极区c(H+)增大;若阴、阳极同时有H+、OH-放电,相当于电解水,电解质溶液浓度增大.
考查点一 电解原理和电解池
[例1] 如图是电解CuCl2溶液的装置,
其中c、d为石墨电极,则下列有关判
断正确的是 ( )
A.a为负极,b为正极
B.a为阳极,b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
[答案] C
[解析] 电流从电源的正极流出,故a为电源的正极,b为负极;与电源正极相连的c为阳极,与电源负极相连的d为阴极.在电解过程中,因为Cu2+是阳离子,移向阴极d,在阴极放电析出Cu,所以d电极质量增加;Cl-是阴离子,移向阳极c,在阳极放电析出Cl2,导致溶液中氯离子浓度降低.
1.下列有关电解池的说法正确的是 ( )
A.在电解池中与外接电源负极相连的电极是阳极
B.电解任何物质阳极上失电子数与阴极上得电子数
相等
C.电解氯化铜溶液时在阴极上有气体生成
D.电解NaCl、CuCl2两种溶液参加反应的物质是相
同的
解析:与负极相连的是阴极;电解氯化铜时阳极上有氯气生成.阴极上有铜析出;电解NaCl溶液时水参加了反应,而电解CuCl2溶液,水没有参加反应.
答案: B
考查点二 电极产物的判断
[答案] A
2.某同学按如图所示的装置进行电解实验.下列说法正
确的是 ( )
答案: BC
考查点三 电解基本规律的应用
[例3] 用惰性电极电解下列溶液一段时间后再加入一定量的某种纯净物(方括号内物质),能使溶液恢复到原来的成分和浓度的是 ( )
A.AgNO3[AgNO3] B.NaOH[H2O]
C.KCl[KCl] D.CuSO4[Cu(OH)2]
[答案] B
[关键一点]
将两电极析出的物质化合,所得产物可使溶液复原,如电解饱和食盐水时,要使溶液复原,只需通入HCl气体即可(H2+Cl2===2HCl),而不是加入盐酸.
3.用惰性电极实现电解,下列说法正确的是 ( )
A.电解稀硫酸溶液,实质上是电解水,故溶液pH不变
B.电解稀氢氧化钠溶液,要消耗OH-,故溶液pH减小
C.电解硫酸钠溶液,在阴极上和阳极上析出产物的物
质的量之比为1∶2
D.电解氯化铜溶液,在阴极上和阳极上析出产物的物
质的量之比为1∶1
答案: D
解析:电解稀H2SO4,实质是电解水,因溶剂减少,H2SO4浓度将增大,故溶液的pH变小;电解稀NaOH溶液,虽然OH-在阳极放电,但H+同时也在阴极放电,其实质同样是电解水,溶液的浓度也将变大,故溶液的pH变大;电解Na2SO4溶液,其实质也是电解水,在阴极和阳极分别析出H2和O2,二者的物质的量之比为2∶1,而非1∶2,电解CuCl2溶液,在阴、阳两极上分别析出Cu和Cl2,二者的物质的量之比为1∶1.
点击此图片进入训练全程跟踪
