鲁教版化学 第七单元 常见的酸和碱复习课 导学案
文档属性
| 名称 | 鲁教版化学 第七单元 常见的酸和碱复习课 导学案 |  | |
| 格式 | doc | ||
| 文件大小 | 100.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-04 21:25:23 | ||
图片预览

文档简介
第七单元 常见的酸和碱复习课导学案
【学习目标】
1.了解浓盐酸和浓硫酸的特性,知道常见酸碱的物理性质,掌握常见酸碱的化学性质。
2.理解复分解反应和中和反应,知道溶液的酸碱度,会测溶液的pH,了解pH与溶液酸碱
度的关系。
3.能用酸碱的性质解决简单的问题。
【自主学习】
一、常见酸的性质
1.实验室的浓硫酸和浓盐酸由于保管不慎标签脱落,请你根据所学知识区分两种浓酸。
看:打开瓶盖,在瓶口有白雾的是 ;说明此酸具有 性。
闻:打开瓶盖,轻轻扇动闻其气味有刺激性气味的是 ;
称:把两瓶酸分别放在天平的两盘上,并用砝码及游码调平,一段时间后,指针偏向的一
方瓶内是 ;
溶于水:分别把两种酸慢慢倒入少量水中( 为何如此操作?反之会造成什么后果? ),
并不断搅拌,烧杯壁发热的是 ;
木棒试:分别取两种酸沾在木棒上,木棒变黑的是 ;
铁棒试:分别取两种酸少许于试管中,插入铁棒有气体冒出的是 ;
你能归纳出两种浓酸的性质有何不同吗?
2.酸溶液的化学性质
(1)与指示剂反应,使紫色石蕊变 ,无色酚酞 ;
(2)与活泼金属的反应(以铝、铁为例分别写出与稀硫酸、稀盐酸反应的方程式)
, ,
, ,
(3)与金属氧化物的反应 Fe2O3 + HCl- ;CuO + H2SO4- ;
(4)与碱的反应 NaOH+ HCl- ;Fe(OH)3 + H2SO4- 。
(5)与盐的反应
①与碳酸盐(弱酸盐)的反应 CaCO3 + HCl — ;
Na2CO3 + H2SO4 — ;NaHCO3 + HCl — 。
思考:如何检验 HCO3—、CO32- ? 。
以上酸的化学性质体现了酸的共性,因为酸溶液中都含有 离子。
②与强酸盐的反应 AgNO3 + HCl- ;BaCl2 + H2SO4- 。
体现了不同的酸可以与不同的盐发生反应,这类化学反应叫做 反应。
二、常见碱的性质
1.你知道吗?氢氧化钠具有很强的腐蚀性,所以它有三个俗名 、 、 ,
溶解性是 溶于水,在常见的酸碱中溶于水放热的液体是 ,溶于水放热
的固体是 ,与水反应放热的氧化物是 ,反应后得到的碱的俗名
是 、 ,固体氢氧化钠因易吸收空气中的 、 保
存时需密封,纯净的氢氧化钠溶液经常使用会变质,你知道如何检验是否变质吗?若已变
质可加入 溶液除去杂质。
2.可溶性碱[常见的有 NaOH、KOH、Ca(OH)2、Ba(OH)2 ]的化学性质:
(1)与指示剂反应,使石蕊溶液变 色,使酚酞溶液变 色。
(2)与非金属氧化物反应 ( 重点是理解下列两反应的应用 )
CO2 + NaOH — ;CO2 + Ca(OH)2 — 。
(3)与酸的中和反应 NaOH + HCl— ;Ca(OH)2 + HCl— 。
Ba(OH)2 + H2SO4 — ,该反应属于 或 。
(4)与可溶性盐溶液的反应 Na2CO3 + Ca(OH)2 — ( 此反应有何用途? )
FeCl3 + NaOH — ;CuSO4 + NaOH — 。
(NH4)2SO4 + Ca(OH)2 — ,该反应属于 反应。
3.难溶性碱[常见的有 Mg(OH)2 、Al(OH)3 、Cu(OH)2、Fe(OH)3 ]的化学性质
(1)与酸的中和反应 Mg(OH)2 + HCl — ;Al(OH)3 + HCl — 。
( 用于治疗胃酸过多)
(2)受热分解 Cu(OH)2 — ,Fe(OH)3 — 。
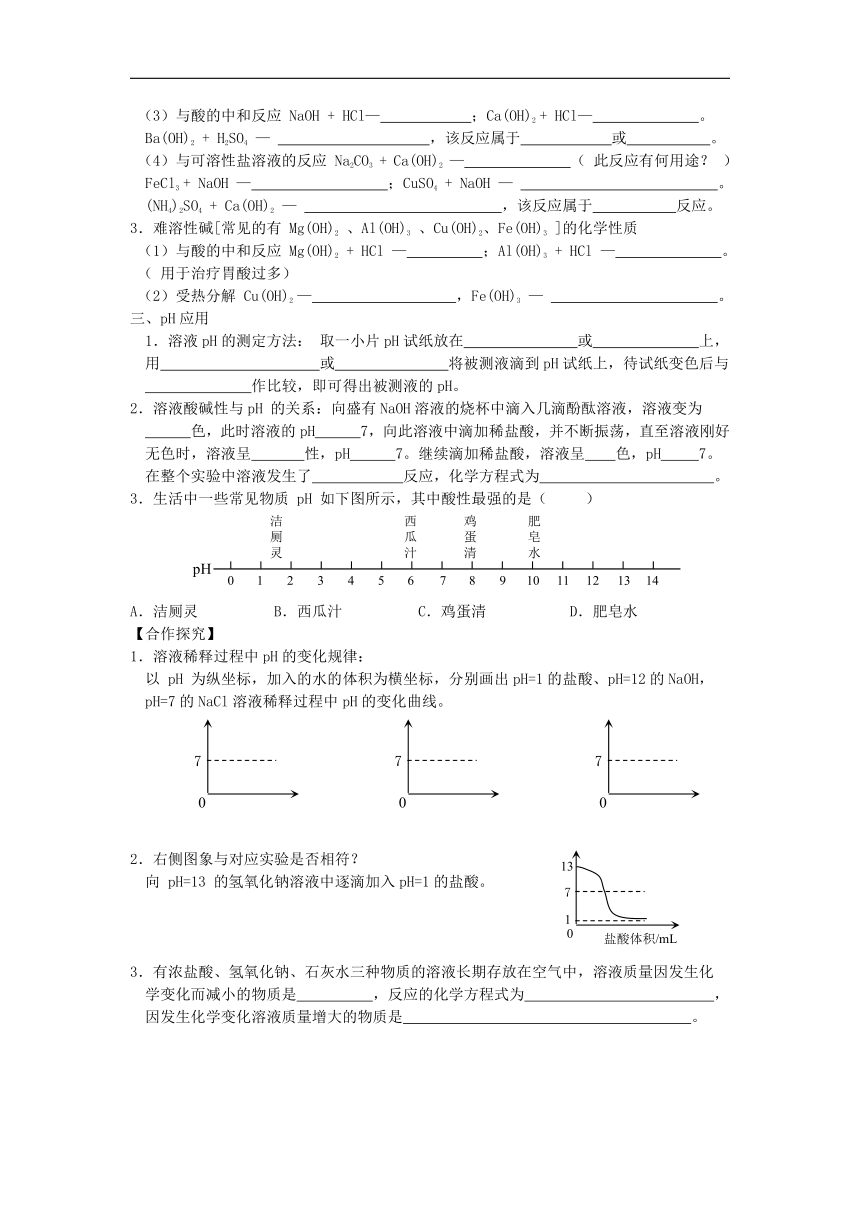
三、pH应用
1.溶液pH的测定方法: 取一小片pH试纸放在 或 上,
用 或 将被测液滴到pH试纸上,待试纸变色后与
作比较,即可得出被测液的pH。
2.溶液酸碱性与pH 的关系:向盛有NaOH溶液的烧杯中滴入几滴酚酞溶液,溶液变为
色,此时溶液的pH 7,向此溶液中滴加稀盐酸,并不断振荡,直至溶液刚好
无色时,溶液呈 性,pH 7。继续滴加稀盐酸,溶液呈 色,pH 7。
在整个实验中溶液发生了 反应,化学方程式为 。
3.生活中一些常见物质 pH 如下图所示,其中酸性最强的是( )
A.洁厕灵 B.西瓜汁 C.鸡蛋清 D.肥皂水
【合作探究】
1.溶液稀释过程中pH的变化规律:
以 pH 为纵坐标,加入的水的体积为横坐标,分别画出pH=1的盐酸、pH=12的NaOH,
pH=7的NaCl溶液稀释过程中pH的变化曲线。
2.右侧图象与对应实验是否相符?
向 pH=13 的氢氧化钠溶液中逐滴加入pH=1的盐酸。
3.有浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化
学变化而减小的物质是 ,反应的化学方程式为 ,
因发生化学变化溶液质量增大的物质是 。
【达标检测】
1.盐酸、希硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是( ) A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气
D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
2.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁
酸腐蚀的是( )
A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗
3.小烧杯中盛有含石蕊的氢氧化钠溶液。逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的
顺序是 ( )
A.紫色——红色——蓝色 B.蓝色——紫色——红色
C.蓝色——红色——紫色 D.紫色——蓝色——红色
4.下列有关物质用途的说法中,错误的是 ( )
A.干冰用于人工降雨 B.用氢氧化钠改良酸性土壤
C.小苏打用于治疗胃酸过多 D.用稀盐酸除去铁器表面的锈渍
5.下列对实验意外事故的处理错误的是 ( )
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上 3%~5%的碳酸氢钠溶液
6.下列实验操作正确的是 ( )
7.检验某溶液是否是酸时,不能选用的试剂是( )
A.紫色石蕊溶液 B.无色酚酞溶液 C.碳酸钠溶液 D.锌粒
8.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而减少的是
A.浓盐酸 B.烧碱 C.石灰水 D.氯化钾
9.构建知识网络,可以帮助我们理解知识间的内在联系。右图是盐酸与不同类别物质之
间反应的知识网络。
(1)图中 M 应为 类物质。
(2)写出一种能与盐酸反应的金属: 。
(3)盐酸能与碱反应的实质是盐酸中的 (写离子
符号)与碱中的OH-反应生成H2O。
(4)用盐酸除铁锈(主要成分Fe2O3)的化学方程式是 。
10.纯碱属于盐类物质,用pH试纸测定某浓度的纯碱溶液其PH为10,请说明该溶液呈
性,能使紫色石蕊试液变成 色。
11.下列是几种作物生长最适宜的pH范围:西瓜6.0~7.0,柑橘5.0~6.0,桑树6.0~
8.0。经测定,土壤的pH=5,该土壤显???? ?? 性,如果仅从土壤的酸碱性考虑,上述作物
中最适宜种植的是??? ???,若想发扬“种桑养鱼”的特色,改种桑树,可用???? ??改良土壤。
【拓展提升】
1.一定条件下,下列物质的转化不能由一步反应实现的是( )
A. Fe2O3→FeCl3 B. Na2CO3→CO2 C. CuSO4→Cu D. Fe(NO3)2→Cu
2.下列各组物质在pH=1的溶液中能大量共存且形成无色溶液的是( )
A.CaCl2、NaOH、MgSO4 B.K2SO4、CuCl2、KNO3
C.Na2SO4、NH4NO3、MgCl2 D. NaCl、K2CO3、NH4NO3
3.下列各组物质中,在恰好完全反应后,溶液的导电性不会明显减小的是( )
A.氢氧化钡与硫酸铜 B.铁与稀盐酸 C.氢氧化钡与稀硫酸 D. 氢氧化钙与碳酸钠
4.下列实验方案或结论正确的是
选项 实验目的 实验方案或结论
A 除去铁制品上的铁锈 将铁制品长时间浸泡在足量的稀硫酸中
B 鉴别NaNO3溶液和NaCl溶液 各取少量于试管中,分别滴加酚酞溶液,观察现象
C 除去CO2中的少量HCl气体 先通过NaOH溶液,再通过浓硫酸
D 鉴别NaCl溶液、Na2SO4溶液和
(NH4)2SO4溶液 各取少量于试管中,分别滴加Ba(OH)2溶液,察现象
5.某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你
与他们一起完成以下探究活动:
? 【对固体猜想】
? 猜想I:全部是Na2CO3,猜想的依据是 ;
? 猜想Ⅱ:全部是NaOH?
猜想Ⅲ:部分是NaOH,部分是Na2CO3。
? 【实验和推断】
实验步骤 实验现象
①取少量白色固体于试管中,加水振荡后,至全部溶解。 无色溶液
②向试管的溶液中滴加适量物质X的溶液 现象A
③再向试管中滴加几滴酚酞试液。 现象B
? (1)若现象A为有气泡产生,则加入的X溶液是 ,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是 。
? (2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色酚酞试液变红色,则白色
沉淀为 (填化学式),该实验 (填“能”或“不能”)说明样品中
有NaOH。
? (3)若X是CaCl2溶液,猜想Ⅲ成立的实验现象是 、
。
??????
【总结反思】
【学习目标】
1.了解浓盐酸和浓硫酸的特性,知道常见酸碱的物理性质,掌握常见酸碱的化学性质。
2.理解复分解反应和中和反应,知道溶液的酸碱度,会测溶液的pH,了解pH与溶液酸碱
度的关系。
3.能用酸碱的性质解决简单的问题。
【自主学习】
一、常见酸的性质
1.实验室的浓硫酸和浓盐酸由于保管不慎标签脱落,请你根据所学知识区分两种浓酸。
看:打开瓶盖,在瓶口有白雾的是 ;说明此酸具有 性。
闻:打开瓶盖,轻轻扇动闻其气味有刺激性气味的是 ;
称:把两瓶酸分别放在天平的两盘上,并用砝码及游码调平,一段时间后,指针偏向的一
方瓶内是 ;
溶于水:分别把两种酸慢慢倒入少量水中( 为何如此操作?反之会造成什么后果? ),
并不断搅拌,烧杯壁发热的是 ;
木棒试:分别取两种酸沾在木棒上,木棒变黑的是 ;
铁棒试:分别取两种酸少许于试管中,插入铁棒有气体冒出的是 ;
你能归纳出两种浓酸的性质有何不同吗?
2.酸溶液的化学性质
(1)与指示剂反应,使紫色石蕊变 ,无色酚酞 ;
(2)与活泼金属的反应(以铝、铁为例分别写出与稀硫酸、稀盐酸反应的方程式)
, ,
, ,
(3)与金属氧化物的反应 Fe2O3 + HCl- ;CuO + H2SO4- ;
(4)与碱的反应 NaOH+ HCl- ;Fe(OH)3 + H2SO4- 。
(5)与盐的反应
①与碳酸盐(弱酸盐)的反应 CaCO3 + HCl — ;
Na2CO3 + H2SO4 — ;NaHCO3 + HCl — 。
思考:如何检验 HCO3—、CO32- ? 。
以上酸的化学性质体现了酸的共性,因为酸溶液中都含有 离子。
②与强酸盐的反应 AgNO3 + HCl- ;BaCl2 + H2SO4- 。
体现了不同的酸可以与不同的盐发生反应,这类化学反应叫做 反应。
二、常见碱的性质
1.你知道吗?氢氧化钠具有很强的腐蚀性,所以它有三个俗名 、 、 ,
溶解性是 溶于水,在常见的酸碱中溶于水放热的液体是 ,溶于水放热
的固体是 ,与水反应放热的氧化物是 ,反应后得到的碱的俗名
是 、 ,固体氢氧化钠因易吸收空气中的 、 保
存时需密封,纯净的氢氧化钠溶液经常使用会变质,你知道如何检验是否变质吗?若已变
质可加入 溶液除去杂质。
2.可溶性碱[常见的有 NaOH、KOH、Ca(OH)2、Ba(OH)2 ]的化学性质:
(1)与指示剂反应,使石蕊溶液变 色,使酚酞溶液变 色。
(2)与非金属氧化物反应 ( 重点是理解下列两反应的应用 )
CO2 + NaOH — ;CO2 + Ca(OH)2 — 。
(3)与酸的中和反应 NaOH + HCl— ;Ca(OH)2 + HCl— 。
Ba(OH)2 + H2SO4 — ,该反应属于 或 。
(4)与可溶性盐溶液的反应 Na2CO3 + Ca(OH)2 — ( 此反应有何用途? )
FeCl3 + NaOH — ;CuSO4 + NaOH — 。
(NH4)2SO4 + Ca(OH)2 — ,该反应属于 反应。
3.难溶性碱[常见的有 Mg(OH)2 、Al(OH)3 、Cu(OH)2、Fe(OH)3 ]的化学性质
(1)与酸的中和反应 Mg(OH)2 + HCl — ;Al(OH)3 + HCl — 。
( 用于治疗胃酸过多)
(2)受热分解 Cu(OH)2 — ,Fe(OH)3 — 。
三、pH应用
1.溶液pH的测定方法: 取一小片pH试纸放在 或 上,
用 或 将被测液滴到pH试纸上,待试纸变色后与
作比较,即可得出被测液的pH。
2.溶液酸碱性与pH 的关系:向盛有NaOH溶液的烧杯中滴入几滴酚酞溶液,溶液变为
色,此时溶液的pH 7,向此溶液中滴加稀盐酸,并不断振荡,直至溶液刚好
无色时,溶液呈 性,pH 7。继续滴加稀盐酸,溶液呈 色,pH 7。
在整个实验中溶液发生了 反应,化学方程式为 。
3.生活中一些常见物质 pH 如下图所示,其中酸性最强的是( )
A.洁厕灵 B.西瓜汁 C.鸡蛋清 D.肥皂水
【合作探究】
1.溶液稀释过程中pH的变化规律:
以 pH 为纵坐标,加入的水的体积为横坐标,分别画出pH=1的盐酸、pH=12的NaOH,
pH=7的NaCl溶液稀释过程中pH的变化曲线。
2.右侧图象与对应实验是否相符?
向 pH=13 的氢氧化钠溶液中逐滴加入pH=1的盐酸。
3.有浓盐酸、氢氧化钠、石灰水三种物质的溶液长期存放在空气中,溶液质量因发生化
学变化而减小的物质是 ,反应的化学方程式为 ,
因发生化学变化溶液质量增大的物质是 。
【达标检测】
1.盐酸、希硫酸在水溶液中都能产生H+,故有许多共同的性质。下列有关叙述正确的是( ) A.打开盛有浓盐酸和浓硫酸的试剂瓶瓶塞,在瓶口都有白雾
B.稀盐酸和稀硫酸都可用于除铁锈
C.浓盐酸、浓硫酸都可用来干燥氧气
D.在稀盐酸、稀硫酸中滴加氢氧化钡溶液,都有白色沉淀
2.白蚁能分泌出蚁酸。蚁酸的化学性质与盐酸相似,能腐蚀很多物质。下列最不容易被蚁
酸腐蚀的是( )
A.镀锌水管 B.铜制塑像 C.大理石栏杆 D.铝合金门窗
3.小烧杯中盛有含石蕊的氢氧化钠溶液。逐滴加入稀盐酸至过量,烧杯中溶液颜色变化的
顺序是 ( )
A.紫色——红色——蓝色 B.蓝色——紫色——红色
C.蓝色——红色——紫色 D.紫色——蓝色——红色
4.下列有关物质用途的说法中,错误的是 ( )
A.干冰用于人工降雨 B.用氢氧化钠改良酸性土壤
C.小苏打用于治疗胃酸过多 D.用稀盐酸除去铁器表面的锈渍
5.下列对实验意外事故的处理错误的是 ( )
A.硫酸洒在实验台上,立即用烧碱溶液冲洗
B.实验药液溅入眼睛,立即用水冲洗,切不可用手揉搓
C.酒精灯洒出的酒精在桌上燃烧,立即用湿布或沙子扑灭
D.浓硫酸沾到皮肤上,立即用大量的水冲洗,再涂上 3%~5%的碳酸氢钠溶液
6.下列实验操作正确的是 ( )
7.检验某溶液是否是酸时,不能选用的试剂是( )
A.紫色石蕊溶液 B.无色酚酞溶液 C.碳酸钠溶液 D.锌粒
8.下列物质的溶液长期放置在空气中,溶液质量因发生化学变化而减少的是
A.浓盐酸 B.烧碱 C.石灰水 D.氯化钾
9.构建知识网络,可以帮助我们理解知识间的内在联系。右图是盐酸与不同类别物质之
间反应的知识网络。
(1)图中 M 应为 类物质。
(2)写出一种能与盐酸反应的金属: 。
(3)盐酸能与碱反应的实质是盐酸中的 (写离子
符号)与碱中的OH-反应生成H2O。
(4)用盐酸除铁锈(主要成分Fe2O3)的化学方程式是 。
10.纯碱属于盐类物质,用pH试纸测定某浓度的纯碱溶液其PH为10,请说明该溶液呈
性,能使紫色石蕊试液变成 色。
11.下列是几种作物生长最适宜的pH范围:西瓜6.0~7.0,柑橘5.0~6.0,桑树6.0~
8.0。经测定,土壤的pH=5,该土壤显???? ?? 性,如果仅从土壤的酸碱性考虑,上述作物
中最适宜种植的是??? ???,若想发扬“种桑养鱼”的特色,改种桑树,可用???? ??改良土壤。
【拓展提升】
1.一定条件下,下列物质的转化不能由一步反应实现的是( )
A. Fe2O3→FeCl3 B. Na2CO3→CO2 C. CuSO4→Cu D. Fe(NO3)2→Cu
2.下列各组物质在pH=1的溶液中能大量共存且形成无色溶液的是( )
A.CaCl2、NaOH、MgSO4 B.K2SO4、CuCl2、KNO3
C.Na2SO4、NH4NO3、MgCl2 D. NaCl、K2CO3、NH4NO3
3.下列各组物质中,在恰好完全反应后,溶液的导电性不会明显减小的是( )
A.氢氧化钡与硫酸铜 B.铁与稀盐酸 C.氢氧化钡与稀硫酸 D. 氢氧化钙与碳酸钠
4.下列实验方案或结论正确的是
选项 实验目的 实验方案或结论
A 除去铁制品上的铁锈 将铁制品长时间浸泡在足量的稀硫酸中
B 鉴别NaNO3溶液和NaCl溶液 各取少量于试管中,分别滴加酚酞溶液,观察现象
C 除去CO2中的少量HCl气体 先通过NaOH溶液,再通过浓硫酸
D 鉴别NaCl溶液、Na2SO4溶液和
(NH4)2SO4溶液 各取少量于试管中,分别滴加Ba(OH)2溶液,察现象
5.某兴趣小组同学为了探究实验室中久置的氢氧化钠固体的成分,进行了有关实验。请你
与他们一起完成以下探究活动:
? 【对固体猜想】
? 猜想I:全部是Na2CO3,猜想的依据是 ;
? 猜想Ⅱ:全部是NaOH?
猜想Ⅲ:部分是NaOH,部分是Na2CO3。
? 【实验和推断】
实验步骤 实验现象
①取少量白色固体于试管中,加水振荡后,至全部溶解。 无色溶液
②向试管的溶液中滴加适量物质X的溶液 现象A
③再向试管中滴加几滴酚酞试液。 现象B
? (1)若现象A为有气泡产生,则加入的X溶液是 ,说明氢氧化钠已经变质,有气泡产生的反应的化学方程式是 。
? (2)若X是Ca(OH)2溶液,现象A有白色沉淀,现象B为无色酚酞试液变红色,则白色
沉淀为 (填化学式),该实验 (填“能”或“不能”)说明样品中
有NaOH。
? (3)若X是CaCl2溶液,猜想Ⅲ成立的实验现象是 、
。
??????
【总结反思】
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
