2020-2021学年人教版(2019)高中化学选择性必修一1.1反应热 第2课时 热化学方程式书写 课件(20张ppt)
文档属性
| 名称 | 2020-2021学年人教版(2019)高中化学选择性必修一1.1反应热 第2课时 热化学方程式书写 课件(20张ppt) | 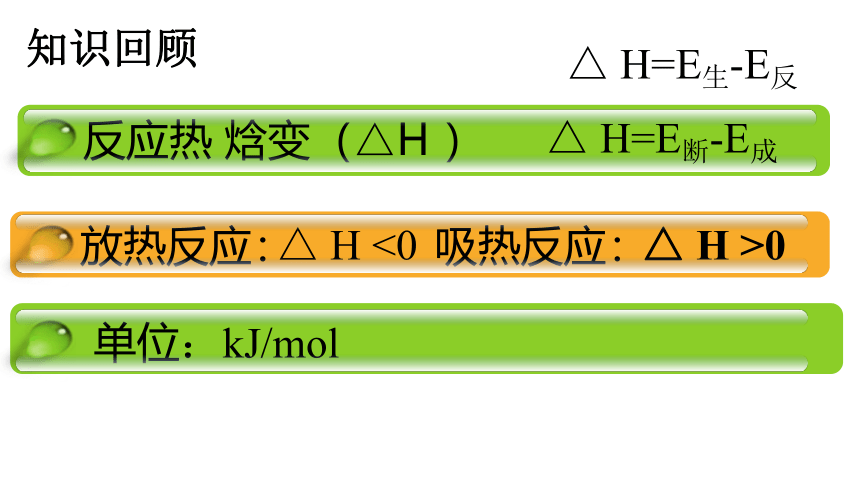 | |
| 格式 | ppt | ||
| 文件大小 | 527.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-08-10 16:29:04 | ||
图片预览







文档简介
(共20张PPT)
知识回顾
反应热
焓变(△H
)
放热反应:
吸热反应:
单位:kJ/mol
△
H
<0
△
H
>0
△
H=E生-E反
△
H=E断-E成
化学反应
物质变化
能量变化
化学反应方程式
热化学方程式
点击添加文本
点击添加文本
点击添加文本
点击添加文本
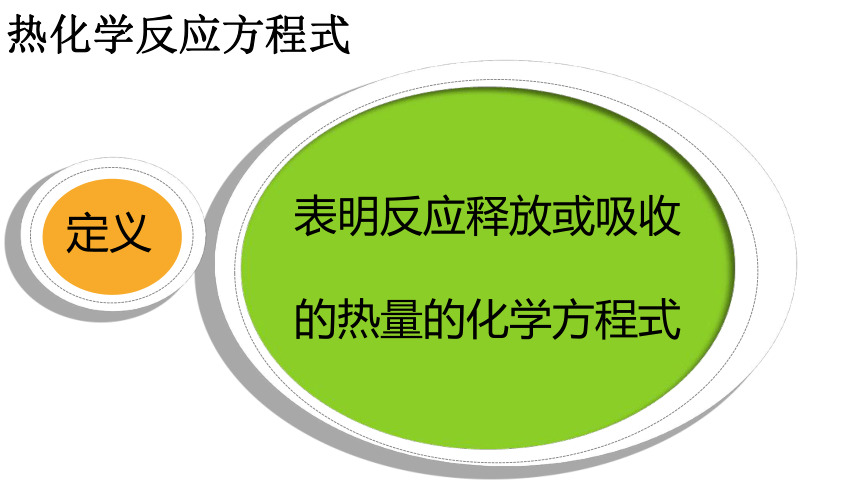
热化学反应方程式
表明反应释放或吸收的热量的化学方程式
定义
第一节
反应热
第2课时
热化学方程式的书写
比较两个反应的热化学方程式:
H2(g)+1/2O2(g)
H2O(g)
△
H
=-241.8kJ/mol
H2(g)+1/2O2(g)
H2O(l)
△
H
=-285.8kJ/mol
△
H=
E生
-
E反
物质越稳定,其能量越低。
反应物相同,生成物越稳定,放热越多,△
H
越小。
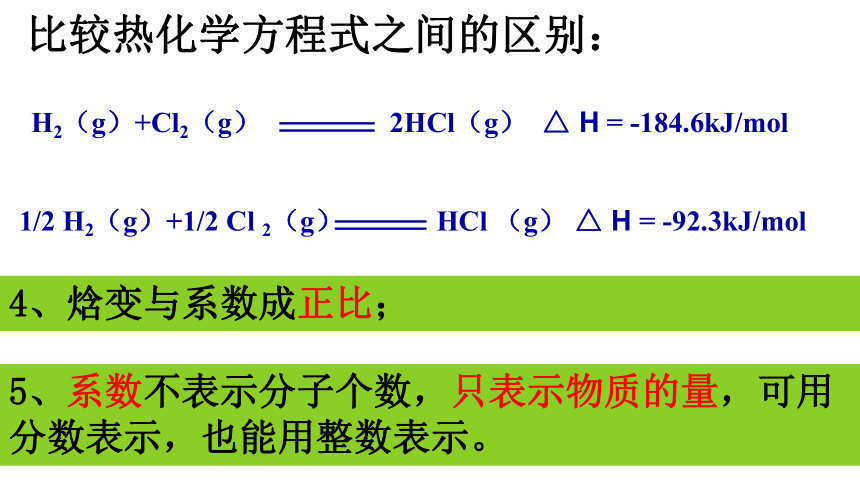
H2(g)+Cl2(g)
2HCl(g)
△
H
=-184.6kJ/mol
指出与化学方程式的区别:
H2
+
Cl2
2HCl
点
燃
表示:1mol气态氢气与1mol气态氯气反应生成2mol气态氯化氢时,放出184.6
kJ的热量。
3、标出焓变:+
、
—、大小、单位
2、标明物质的状态,固、气、液、水溶液
分别用s、g、l、aq表示。不标↑、↓
1、需注明反应时的温度和压强。但常用的△H的数据,一般都是25
℃、101
kPa时的数据,可以省略。
1/2
H2(g)+1/2
Cl
2(g)
HCl
(g)
△
H
=
-92.3kJ/mol
H2(g)+Cl2(g)
2HCl(g)
△
H
=
-184.6kJ/mol
比较热化学方程式之间的区别:
4、焓变与系数成正比;
5、系数不表示分子个数,只表示物质的量,可用分数表示,也能用整数表示。
比较热化学方程式之间的区别:
2H2O(g)
H2(g)+1/2O2(g)
△
H
=+241.8kJ/mol
H2(g)+1/2O2(g)
2H2O(g)
△
H
=-241.8kJ/mol
6、正逆反应焓变数值不变,符号相反
(3)书写要求
①注明反应的
和
(25
℃、101
kPa下进行的反应可不注明)。
②注明反应物和生成物的状态:固态(s)、液态(l)、水溶液(aq)、气态(g)。
③热化学方程式中各物质的化学计量数只表示物质的
,而不表示分子个数(或原子个数),因此可以写成分数。
④热化学方程式中不用“↑”和“↓”。
⑤由于ΔH与反应物的物质的量有关,所以热化学方程式中物质的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应向逆反应方向进行时,其反应热与正反应的反应热数值相等,符号相反。
温度
压强
物质的量
例1:写出下列反应的热化学方程式
(1)1
mol
N2(g)与适量H2(g)反应生成NH3(g),放出92.2
kJ热量。
N2(g)+3H2(g)
2NH3(g)△
H
=
-
92.2
kJ/mol
【课堂练习】
(1)1
mol
N2(g)与适量O2(g)反应生成NO2(g),吸收68
kJ热量。
1、依据事实,写出下列反应的热化学方程式
N2(g)+2O2(g)
2NO2(g)
△
H=+68
kJ/mol
(2)1
mol
C8H18(g)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518
kJ热量。
C8H18(g)+25/2O2(g)
8CO2(g)+9H2O(l)
△
H=-5518
kJ/mol
点击添加文本
点击添加文本
点击添加文本
点击添加文本
课堂总结
1、标状态、
标焓变。
2、焓变与系数成正比,系数不表示分子个数,只表示物质的量,正逆反应焓变数值不变,符号相反
学习小结
自我检测
D
2、SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1
molS(s)转换为气态硫原子吸收能量280
kJ,断裂1
molF-F、S-F键需要吸收的能量分别为160
kJ、330
kJ。则S(s)+3F2(g)=SF6(g)的反应热为(
)
A.-1780kJ/mol
B.-1220kJ/mol
C.-450kJ/mol
D.+430kJ/mol
B
未注明水为液态。
B
B
反应热
旧化学键断裂吸收的能量
新化学键形成放出的能量
<
放热
断键
成键
知识回顾
反应热
焓变(△H
)
放热反应:
吸热反应:
单位:kJ/mol
△
H
<0
△
H
>0
△
H=E生-E反
△
H=E断-E成
化学反应
物质变化
能量变化
化学反应方程式
热化学方程式
点击添加文本
点击添加文本
点击添加文本
点击添加文本
热化学反应方程式
表明反应释放或吸收的热量的化学方程式
定义
第一节
反应热
第2课时
热化学方程式的书写
比较两个反应的热化学方程式:
H2(g)+1/2O2(g)
H2O(g)
△
H
=-241.8kJ/mol
H2(g)+1/2O2(g)
H2O(l)
△
H
=-285.8kJ/mol
△
H=
E生
-
E反
物质越稳定,其能量越低。
反应物相同,生成物越稳定,放热越多,△
H
越小。
H2(g)+Cl2(g)
2HCl(g)
△
H
=-184.6kJ/mol
指出与化学方程式的区别:
H2
+
Cl2
2HCl
点
燃
表示:1mol气态氢气与1mol气态氯气反应生成2mol气态氯化氢时,放出184.6
kJ的热量。
3、标出焓变:+
、
—、大小、单位
2、标明物质的状态,固、气、液、水溶液
分别用s、g、l、aq表示。不标↑、↓
1、需注明反应时的温度和压强。但常用的△H的数据,一般都是25
℃、101
kPa时的数据,可以省略。
1/2
H2(g)+1/2
Cl
2(g)
HCl
(g)
△
H
=
-92.3kJ/mol
H2(g)+Cl2(g)
2HCl(g)
△
H
=
-184.6kJ/mol
比较热化学方程式之间的区别:
4、焓变与系数成正比;
5、系数不表示分子个数,只表示物质的量,可用分数表示,也能用整数表示。
比较热化学方程式之间的区别:
2H2O(g)
H2(g)+1/2O2(g)
△
H
=+241.8kJ/mol
H2(g)+1/2O2(g)
2H2O(g)
△
H
=-241.8kJ/mol
6、正逆反应焓变数值不变,符号相反
(3)书写要求
①注明反应的
和
(25
℃、101
kPa下进行的反应可不注明)。
②注明反应物和生成物的状态:固态(s)、液态(l)、水溶液(aq)、气态(g)。
③热化学方程式中各物质的化学计量数只表示物质的
,而不表示分子个数(或原子个数),因此可以写成分数。
④热化学方程式中不用“↑”和“↓”。
⑤由于ΔH与反应物的物质的量有关,所以热化学方程式中物质的化学计量数必须与ΔH相对应,如果化学计量数加倍,则ΔH也要加倍。当反应向逆反应方向进行时,其反应热与正反应的反应热数值相等,符号相反。
温度
压强
物质的量
例1:写出下列反应的热化学方程式
(1)1
mol
N2(g)与适量H2(g)反应生成NH3(g),放出92.2
kJ热量。
N2(g)+3H2(g)
2NH3(g)△
H
=
-
92.2
kJ/mol
【课堂练习】
(1)1
mol
N2(g)与适量O2(g)反应生成NO2(g),吸收68
kJ热量。
1、依据事实,写出下列反应的热化学方程式
N2(g)+2O2(g)
2NO2(g)
△
H=+68
kJ/mol
(2)1
mol
C8H18(g)在O2(g)中燃烧,生成CO2(g)和H2O(l),放出5518
kJ热量。
C8H18(g)+25/2O2(g)
8CO2(g)+9H2O(l)
△
H=-5518
kJ/mol
点击添加文本
点击添加文本
点击添加文本
点击添加文本
课堂总结
1、标状态、
标焓变。
2、焓变与系数成正比,系数不表示分子个数,只表示物质的量,正逆反应焓变数值不变,符号相反
学习小结
自我检测
D
2、SF6是一种优良的绝缘气体,分子结构中只存在S-F键。已知:1
molS(s)转换为气态硫原子吸收能量280
kJ,断裂1
molF-F、S-F键需要吸收的能量分别为160
kJ、330
kJ。则S(s)+3F2(g)=SF6(g)的反应热为(
)
A.-1780kJ/mol
B.-1220kJ/mol
C.-450kJ/mol
D.+430kJ/mol
B
未注明水为液态。
B
B
反应热
旧化学键断裂吸收的能量
新化学键形成放出的能量
<
放热
断键
成键
