湖北省2020-2021学年高一下学期7月统一调研考试化学试题 Word版含解析
文档属性
| 名称 | 湖北省2020-2021学年高一下学期7月统一调研考试化学试题 Word版含解析 |  | |
| 格式 | docx | ||
| 文件大小 | 423.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-06 21:52:23 | ||
图片预览



文档简介
11290300117221002021年7月湖北省高一统一调研测试
化学试卷
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学发展中是科学史重要组成部分。下列科学家与主要成就不匹配的是( )
选项
科学家
主要成就
A
屠呦呦
从菁蒿中提取菁蒿素
B
侯德榜
发明侯氏制碱法
C
凯库勒
发现苯
D
门捷列夫
编制第一张元素周期表
2.化学与生产、生活密切相关。下列说法正确的是( )
A.天然气只能用作清洁燃料 B.工业上常用液氨作制冷剂
C.纤维素是人类基本营养物质 D.磁性氧化铁常用于制作橡胶的红色颜料
3.下列物质与水反应能生成两种化合物,其中一种为强电解质另一种为强氧化剂的是( )
A.false B.false C.false D.false
4.工业上,制备乙醇的原理为false。下列说法错误的是( )
A.简单的氧离子结构示意图为 B.乙烯分子空间填充模型为
C.乙醇的同分异构体结构简式为false D.中子数为7的碳原子表示为false
5.下列物质性质和用途都正确且匹配的是( )
选项
用途
性质
A
醋酸可浸泡水垢并除去水垢
醋酸易挥发、具有刺激性气味
B
false可用于制造指南针
false是碱性氧化物
C
氢氟酸在玻璃器具表面标注记号
HF是易挥发、易溶于水的一元酸
D
铝合金材料广泛用作门窗等
铝合金表面有一层致氧化膜,耐腐蚀且质轻
6.下列离子方程式正确的是( )
A.钠与水反应:false
B.氯化铁溶液腐蚀铜电路板:false
C.用烧碱溶液吸收氯气:false
D.用氨水吸收少量的二氧化硫:false
7.false为阿伏加德罗常数的值。下列说法正确的是( )
A.60g正丙醇和足量丙酸在一定条件下反应生成丙酸正丙酯分子数为false
B.标准状况下,22.4L硫化氢和二氧化硫的混合物含分子数false
C.10g46%酒精与足量金属钠反应转移电子数为false
D.电极反应false中,false参与反应,结合阳离子数为false
8.“黑火药”是我国古代四大发明之一,其反应原理是false。下列说法正确的是( )
A.二氧化碳是含非极性键的共价化合物 B.硝酸钾是含极性共价键的离子化合物
C.上述反应中被还原的元素只有氮元素 D.产生11.2L氮气时转移6mol电子
9.M和N反应分反应①和②两步进行,能量变化如图所示。下列说法正确的是( )
A.能量:反应物>产物>中间产物
B.总反应中原子利用率为100%
C.T是总反应的催化剂
D.总反应是置换反应
10.下列各组离子或分子在指定条件下能大量共存的是( )
A.无色透明溶液中:false、false、false、false
B.false的溶液中:false、false、false、false
C.加入铝粉产生false的溶液中:false、false、false、false
D.加入酚酞变红色的溶液中:false、false、false、false
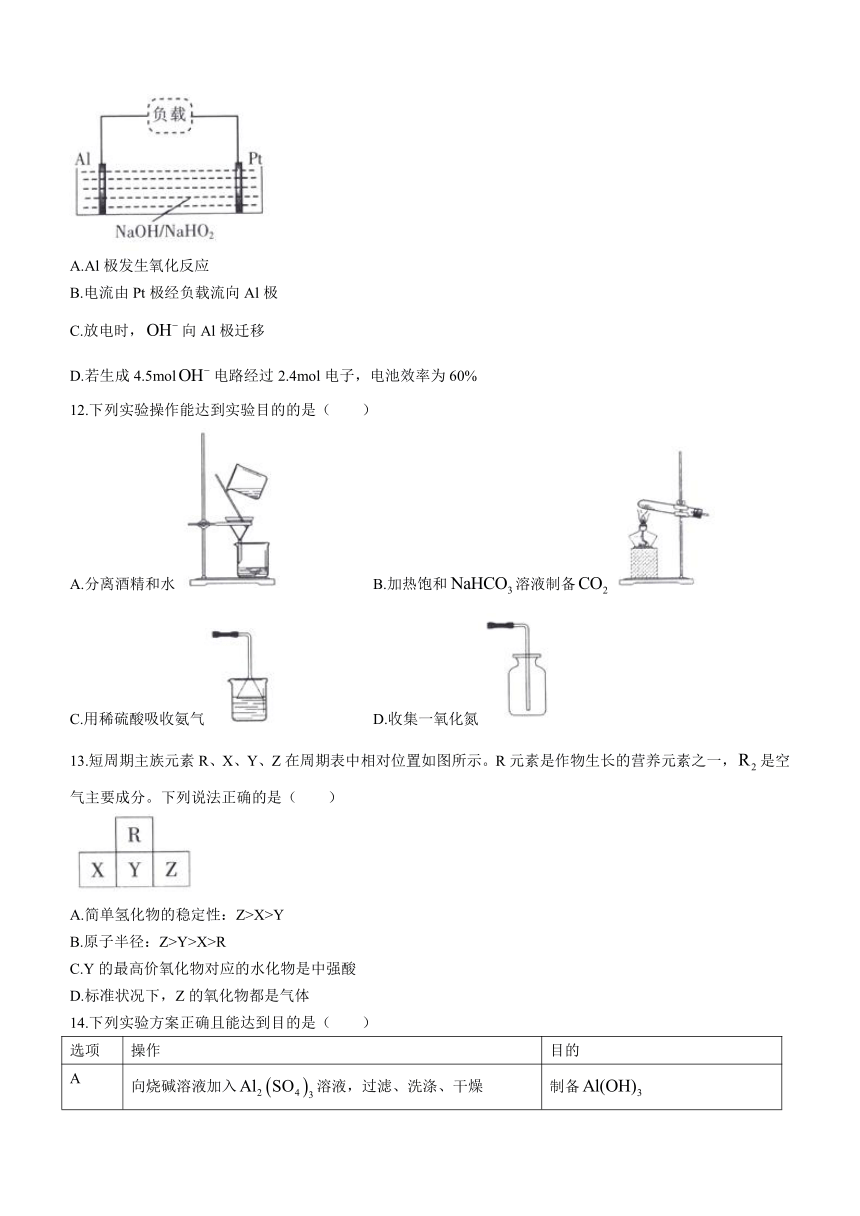
11.false在强碱性溶液中主要以false形式存在。false燃料电池工作原理如图所示。正极反应式为false。提示:电池效率等于电路上通过的电子数与负极失去电子数之比。下列说法错误的是( )
A.Al极发生氧化反应
B.电流由Pt极经负载流向Al极
C.放电时,false向Al极迁移
D.若生成4.5molfalse电路经过2.4mol电子,电池效率为60%
12.下列实验操作能达到实验目的的是( )
A.分离酒精和水 B.加热饱和false溶液制备false
C.用稀硫酸吸收氨气 D.收集一氧化氮
13.短周期主族元素R、X、Y、Z在周期表中相对位置如图所示。R元素是作物生长的营养元素之一,false是空气主要成分。下列说法正确的是( )
A.简单氢化物的稳定性:Z>X>Y
B.原子半径:Z>Y>X>R
C.Y的最高价氧化物对应的水化物是中强酸
D.标准状况下,Z的氧化物都是气体
14.下列实验方案正确且能达到目的是( )
选项
操作
目的
A
向烧碱溶液加入false溶液,过滤、洗涤、干燥
制备false
B
向酸性false溶液中滴加丙烯醇false并振荡
证明丙烯醇中含有醇羟基
C
在暗处用激光灯照射氯化铁溶液和氢氧化铁胶体
鉴别氯化铁溶液和氢氧化铁胶体
D
浓硫酸和稀硫酸分别与铝片反应
探究浓度对反应速率影响
15.在一定温度下,在密闭容器中投入X(g)和Y(g),发生反应生成Z(g)。测得各物质浓度与时间关系如图所示(提示:净反应速率等于正、逆反应速率之差)。下列说法错误的是( )
A.a点:正反应速率大于逆反应速率
B.b点:净反应速率等于零
C.上述可逆反应中X、Y、Z的化学计量数之比为3∶1∶2
D.该条件下,Y的最大限度(平衡转化率)为60%
二、非选择题:本题共4小题,共55分。
16.(14分)某小组设计实验证明乙醇和钠反应产生氢气,并探究氧化铜的还原产物。已知:①false。②红色粉末false在酸性条件下发生歧化反应:false。装置如图所示:
回答下列问题:
(1)试剂R最好选择_______(填字母,单选)。
a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.硫酸镁
(2)装置E的作用是_______.
(3)写出A中发生反应的化学方程式:_______;该反应类型是_______.(填字母,双选)。
a.置换反应 b.加成反应 c.离子反应 d.放热反应
(4)实验完毕后,为了探究C中红色粉末是否含有false,设计下列两种方案:
方案1:取少量红色粉末于试管,加入足量溶液M,充分振荡,若溶液变蓝色,则红色粉末一定含false;
方案2:取a g红色粉末,在加热条件下通入足量氢气,充分反应后,冷却、称重,红色固体质量为x g。
①方案1中M可能是______(填字母,单选)。
a.稀硝酸 b.稀硫酸 c.浓硫酸 d.浓硝酸
②方案2中,当false______时,红色粉末全部是false。
(5)分析与讨论。
①CuO被false、false、CO等还原可能生成false或Cu,生成false的可能原因是______(填字母,双选)。
A.通入false量不足 B.false与CuO接触充分
C.温度较低 D.高度过高
②若缺少装置B,C中黑色粉末变红色,D中白色粉末变蓝色,不能肯定A中一定生成了false,理由是______。
17.(16分)CO是重要化工原料和清洁能源。
I.CO是一种常用的还原剂。一定条件下,反应false的速率方程为false(k为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,该反应在不同浓度下反应速率如下表所示:
false
false
反应速率
①
0.10
0.10
v
②
0.20
0.10
false
③
0.20
0.20
false
(1)根据表中测定结果,下列推断正确的是______(填字母,单选)。
A.false、false B.false、false C.false,false D.false,false
(2)改变下列一个条件,反应速率增大的是______(填字母,双选)。
A.降温 B.缩小体积 C.加入催化剂 D.减压
(3)其他条件不变,降低温度,k值______(填“增大”“减小”或“不变”,下同);其他条件不变,加入催化剂,k值______.
(4)一定温度下,在2L恒容密闭容器中投入x mol CO(g)和false,发生上述反应,经过t min达到平衡,CO的转化率为false。
①下列情况表明上述反应达到平衡状态的是______(填字母,单选)。
A.混合气体的密度保持不变 B.混合气体的摩尔质量保持不变
C.气体总压强保持不变 D.NO的消耗速率等于CO的消耗速率
②false间CO的平均速率false______.
③平衡时false______.
Ⅱ.CO是一种清洁能源。
(5)CO空气碱性燃料电池能量转化率高,电池反应为false。在______(填“正”或“负”)极区通入空气,写出负极反应式:______.
Ⅲ.CO是一种常用的化工原料。催化剂
(6)工业上,利用CO和false反应制备甲醇false。
已知:该反应的正反应是放热反应。下列图像符合上述反应中能量变化的是______(填“甲”或“乙”)。
18.(12分)F是一种皮革处理剂,一种合成F的流程如下:
回答下列问题:
(1)E所含官能团名称是______。
(2)A和C互为______(填“同系物”或“同分异构体”,下同);C与互为______。
(3)有机物B的名称是______;有机物D的结构简式为______。
(4)A和无机物X合成有机物B的反应类型是______。
(5)写出E→F的化学方程式:______。
(6)E不具有下列性质的是______(填代号,单选)。
a.能使溴水褪色
b.能使酸性高锰酸钾溶液褪色
c.能在热烧碱溶液中发生水解反应
d.在常温下能与false反应
19.(13分)一种从海水中提取金属镁和单质溴的主要步骤如下:
回答下列问题:
(1)试剂1属于氧化物,它是______,试剂2是______(填化学式)。
(2)操作A中常用玻璃棒,其作用是______,操作B是______(填操作名称)。
(3)溴蒸气通入二氧化硫的水溶液中,其离子方程式为______。
(4)设计简易实验证明溶液2含false:______。
(5)向溶液1中通入热空气的目的是______;向溶液2中通入氯气的反应中,氧化剂是______(填化学式)。
(6)工业上冶炼金属常用镁作还原剂。如高温下,镁置换false中U(铀),写出化学方程式:______。
2021年7月湖北省高一统一调研测试
化学参考答案
1.【答案】C
【解析】凯库勒提出苯的结构,法拉第最早发现苯。
2.【答案】B
【解析】天然气也是化工原料,A项错误;液氨汽化时要吸收大量热量,B项正确;人体没有纤维素水解酶,纤维素在人体内不能水解,故它不是基本营养物质,C项错误;氧化铁作红色颜料,磁性氧化铁呈黑色,D项错误。
3.【答案】C
【解析】二氧化氮与水反应生成硝酸和一氧化氮,NO是非电解质,A项错误;三氧化硫与水反应生成硫酸,B项错误;氯气与水反应生成HCl和HClO,HCl是强电解质,HClO是强氧化剂,C项正确;过氧化钠与水反应生成氢氧化钠和氧气,氧气是单质,D项错误。
4.【答案】A
【解析】简单氧离子false结构示意图为,A项错误;乙烯分子的空间填充模型为,B项正确;乙醇的同分异构体是二甲醚,结构简式为false,C项正确;中子数为7的碳原子的质量数为13,D项正确。
5.【答案】D
【解析】醋酸的酸性比碳酸强,用醋酸除去水垢,A项错误;四氧化三铁具有磁性,可指示方向,常
用于制造指南针,B项错误;HF溶液与false反应生成易挥发的false,C项错误;铝合金表面有氧化铝致密保护膜,铝合金耐腐蚀、密度小,D项正确。
6.【答案】C
【解析】电荷不守恒,A项错误;铜与false反应的离子方程式为false,B项错误;氨水吸收少量false,生成亚硫酸铵,离子方程式为2false,D项错误。
7.【答案】D
【解析】酯化反应是可逆反应,false为1mol,生成丙酸正丙酯分子小于1mol,A项错误;false,B项错误;酒精含水和乙醇,水和乙醇都与钠反应,C项错误;由反应式知,x molS参与反应时结合false,D项正确。
8.【答案】B
【解析】二氧化碳只含极性键,不含非极性键,A项错误;硝酸钾中氮和氧之间存在极性共价键,B项正确;上述反应中,硝酸钾、硫都作氧化剂,氮、硫被还原,C项错误;没有强调“标准状况”,不能根据氮气体积计算其物质的量,D项错误。
9.【答案】B
【解析】由图示知,中间产物、反应物、产物的能量依次降低,A项错误;观察图示知,总反应为化合反应,原子利用率为100%,是理想的绿色化学反应,B项正确;T是中间产物,C项错误;反应物是M和N,产物是Q,该总反应是化合反应,D项错误。
10.【答案】C
【解析】铁离子和硫氰根离子不能大量共存且生成的粒子显血红色,A项错误;酸性条件下高锰酸根离子氧化乙醇,B项错误;使酚酞变红色溶液呈碱性,在碱性条件下,亚铁离子、镁离子不能大量共存,D项错误。
11.【答案】D
【解析】观察图示知,铝电极为负极,铂电极为正极,负极发生氧化反应,A项正确;电流由正极经外电路流向负极,B项正确;铂极为正极,铝极为负极,false向负极迁移,C项正确;正极反应式为false,false,false,电池效率false,D项错误。
12.【答案】C
【解析】酒精和水都是液体,不能用过滤分离,A项错误;碳酸氢钠溶液是液体,试管口不能向下倾斜,B项错误;氨气极易溶于水,倒置的漏斗能防倒吸,C项正确;NO极易与空气中氧气反应,不能用排空气法收集NO,D项错误。
13.【答案】C
【解析】氮气分子存在三键,故R为氮,X为硅,Y为磷,Z为硫。硫化氢、磷化氢、硅烷的稳定性依次减弱,A项错误;硅、磷、硫、氮的原子半径依次减小,B项错误;磷酸是中强酸,C项正确;false在标准状况下是固体,D项错误。
14.【答案】C
【解析】氢氧化钠与氢氧化铝反应,实验室用氨水和硫酸铝溶液反应制备氢氧化铝,A项错误;丙烯醇中碳碳双键也能与酸性高锰酸钾溶液反应,B项错误;用丁达尔效应检验胶体和溶液,C项正确;铝片与浓硫酸发生钝化,使反应停止,D项错误。
15.【答案】D
【解析】a点未达到平衡,正反应速率大于逆反应速率,A项正确;b点达到平衡,正、逆反应速率相等,净反应速率等于零,B项正确;根据速率之比等于化学计量数之比知,X、Y、Z的化学计量数之比为false,最终反应体系中存在反应物和产物,说明它是可逆反应,C项正确; 达到平衡时Y消耗false,Y的转化率为40%,D错误。
16.【答案】(1)b
(2)吸收空气中水蒸气,避免干扰对生成水的检验
(3)false ad
(4)①b ②false
(5)①A、C ②乙醇蒸气能还原氧化铜
【解析】(1)钠与乙醇反应是放热反应,乙醇易挥发,氢气中混有乙醇蒸气,用无水氯化钙吸收乙醇蒸气,故试剂R为无水氯化钙。
(2)本实验检验氢气和氧化铜反应生成水,避免空气中水进入,故E装置吸收空气中水蒸气。
(3)乙醇与钠反应,从物质种类看,它是置换反应;从元素化合价看,它是氧化还原反应。置换反应一定是氧化还原反应;从能量变化看,它是放热反应。
(4)①方案1要求溶液M只与false反应,铜不干扰实验,故选择无氧化性酸,如稀硫酸。
②false,false,false。
(5)①氧化铜生成氧化亚铜,说明还原不充分,可以从反应物量、固体接触、温度等角度寻找可能原因。
②如果氢气中混有乙醇蒸气,会发生反应false。
17.【答案】(1)B
(2)B、C
(3)减小 增大
(4)①D ②false ③false
(5)正 false
(6)甲
【解析】(1)代入数据计算,得:false,false,选B。
(2)缩小体积,增大浓度,反应速率加快;加入催化剂,反应速率增大,故选BC。
(3)降低温度,速率减小,而浓度不变,速率常数减小;加入催化剂,速率增大,但是浓度不变,故速率常数增大。
(4)①混合气体总质量不变、体积不变,故密度始终不变,A项错误;气体总物质的量不变,气体摩尔质量不变,B项错误;该反应是气体分子数不变的反应,气体总物质的量不变,温度、体积不变,故气体压强不变,C项错误;消耗CO速率等于消耗NO速率,可以转化为消耗CO速率等于
生成CO速率,达到平衡,D项正确。
②false
③false,false。false
(5)在正极区充入空气,氧气发生还原反应;负极上CO被氧化生成碳酸盐。
(6)CO和氢气反应生成甲醇反应是放热反应,甲图像表明放热反应。
18.【答案】(1)碳碳双键、酯基
(2)同系物 同分异构体
(3)乙醇 false
(4)加成反应
(5)
(6)d
【解析】根据E的结构简式知,E水解生成丙烯酸false和乙醇。由此推知:无机物X为水,乙烯和水在催化剂作用下生成乙醇,B为乙醇。有机物D为丙烯酸。F为聚丙烯酸乙酯。
(1)丙烯酸乙酯含碳碳双键、酯基两种官能团。
(2)乙烯和丙烯互为同系物,丙烯与环丙烷互为同分异构体。
(4)乙烯和水反应是加成反应。
(5)E发生加聚反应类似乙烯加聚反应。
(6)E在催化剂、加热条件下与氢气发生加成反应。常温下,E与氢气不反应。
19.【答案】(1)CaO HCl
(2)搅拌,加快反应等 蒸馏
(3)false
(4)取少量溶液2于试管,滴加盐酸和false溶液,若产生白色沉淀,则溶液2含false
(5)吹出溴蒸气等合理答案 false
(6)false
【解析】(1)生石灰(或熟石灰)比烧碱价格低,工业上宜选择生石灰作海水中镁离子的沉淀剂。氢氧化镁与盐酸反应生成氯化镁。
(2)固体溶于溶液中,采用“溶解”,常用玻璃棒搅拌,增大固体接触面,加快反应。溴易挥发,采用蒸馏将溶液中溴蒸出来。
(3)氢溴酸是强酸,向二氧化硫的水溶液中通入溴蒸气,发生化学反应为false。
(4)用盐酸和氯化钡溶液检验硫酸根离子。
(5)溴的沸点较低,用热空气将液溴吹出来,被二氧化硫的水溶液吸收,达到富集溴的目的。氯气和溴化氢反应为false氯气是氧化剂,溴化氢是还原剂。
(6)镁置换四氟化铀中铀,生成氟化镁。
化学试卷
可能用到的相对原子质量:H-1 C-12 O-16 S-32 Cu-64
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学发展中是科学史重要组成部分。下列科学家与主要成就不匹配的是( )
选项
科学家
主要成就
A
屠呦呦
从菁蒿中提取菁蒿素
B
侯德榜
发明侯氏制碱法
C
凯库勒
发现苯
D
门捷列夫
编制第一张元素周期表
2.化学与生产、生活密切相关。下列说法正确的是( )
A.天然气只能用作清洁燃料 B.工业上常用液氨作制冷剂
C.纤维素是人类基本营养物质 D.磁性氧化铁常用于制作橡胶的红色颜料
3.下列物质与水反应能生成两种化合物,其中一种为强电解质另一种为强氧化剂的是( )
A.false B.false C.false D.false
4.工业上,制备乙醇的原理为false。下列说法错误的是( )
A.简单的氧离子结构示意图为 B.乙烯分子空间填充模型为
C.乙醇的同分异构体结构简式为false D.中子数为7的碳原子表示为false
5.下列物质性质和用途都正确且匹配的是( )
选项
用途
性质
A
醋酸可浸泡水垢并除去水垢
醋酸易挥发、具有刺激性气味
B
false可用于制造指南针
false是碱性氧化物
C
氢氟酸在玻璃器具表面标注记号
HF是易挥发、易溶于水的一元酸
D
铝合金材料广泛用作门窗等
铝合金表面有一层致氧化膜,耐腐蚀且质轻
6.下列离子方程式正确的是( )
A.钠与水反应:false
B.氯化铁溶液腐蚀铜电路板:false
C.用烧碱溶液吸收氯气:false
D.用氨水吸收少量的二氧化硫:false
7.false为阿伏加德罗常数的值。下列说法正确的是( )
A.60g正丙醇和足量丙酸在一定条件下反应生成丙酸正丙酯分子数为false
B.标准状况下,22.4L硫化氢和二氧化硫的混合物含分子数false
C.10g46%酒精与足量金属钠反应转移电子数为false
D.电极反应false中,false参与反应,结合阳离子数为false
8.“黑火药”是我国古代四大发明之一,其反应原理是false。下列说法正确的是( )
A.二氧化碳是含非极性键的共价化合物 B.硝酸钾是含极性共价键的离子化合物
C.上述反应中被还原的元素只有氮元素 D.产生11.2L氮气时转移6mol电子
9.M和N反应分反应①和②两步进行,能量变化如图所示。下列说法正确的是( )
A.能量:反应物>产物>中间产物
B.总反应中原子利用率为100%
C.T是总反应的催化剂
D.总反应是置换反应
10.下列各组离子或分子在指定条件下能大量共存的是( )
A.无色透明溶液中:false、false、false、false
B.false的溶液中:false、false、false、false
C.加入铝粉产生false的溶液中:false、false、false、false
D.加入酚酞变红色的溶液中:false、false、false、false
11.false在强碱性溶液中主要以false形式存在。false燃料电池工作原理如图所示。正极反应式为false。提示:电池效率等于电路上通过的电子数与负极失去电子数之比。下列说法错误的是( )
A.Al极发生氧化反应
B.电流由Pt极经负载流向Al极
C.放电时,false向Al极迁移
D.若生成4.5molfalse电路经过2.4mol电子,电池效率为60%
12.下列实验操作能达到实验目的的是( )
A.分离酒精和水 B.加热饱和false溶液制备false
C.用稀硫酸吸收氨气 D.收集一氧化氮
13.短周期主族元素R、X、Y、Z在周期表中相对位置如图所示。R元素是作物生长的营养元素之一,false是空气主要成分。下列说法正确的是( )
A.简单氢化物的稳定性:Z>X>Y
B.原子半径:Z>Y>X>R
C.Y的最高价氧化物对应的水化物是中强酸
D.标准状况下,Z的氧化物都是气体
14.下列实验方案正确且能达到目的是( )
选项
操作
目的
A
向烧碱溶液加入false溶液,过滤、洗涤、干燥
制备false
B
向酸性false溶液中滴加丙烯醇false并振荡
证明丙烯醇中含有醇羟基
C
在暗处用激光灯照射氯化铁溶液和氢氧化铁胶体
鉴别氯化铁溶液和氢氧化铁胶体
D
浓硫酸和稀硫酸分别与铝片反应
探究浓度对反应速率影响
15.在一定温度下,在密闭容器中投入X(g)和Y(g),发生反应生成Z(g)。测得各物质浓度与时间关系如图所示(提示:净反应速率等于正、逆反应速率之差)。下列说法错误的是( )
A.a点:正反应速率大于逆反应速率
B.b点:净反应速率等于零
C.上述可逆反应中X、Y、Z的化学计量数之比为3∶1∶2
D.该条件下,Y的最大限度(平衡转化率)为60%
二、非选择题:本题共4小题,共55分。
16.(14分)某小组设计实验证明乙醇和钠反应产生氢气,并探究氧化铜的还原产物。已知:①false。②红色粉末false在酸性条件下发生歧化反应:false。装置如图所示:
回答下列问题:
(1)试剂R最好选择_______(填字母,单选)。
a.碱石灰 b.无水氯化钙 c.五氧化二磷 d.硫酸镁
(2)装置E的作用是_______.
(3)写出A中发生反应的化学方程式:_______;该反应类型是_______.(填字母,双选)。
a.置换反应 b.加成反应 c.离子反应 d.放热反应
(4)实验完毕后,为了探究C中红色粉末是否含有false,设计下列两种方案:
方案1:取少量红色粉末于试管,加入足量溶液M,充分振荡,若溶液变蓝色,则红色粉末一定含false;
方案2:取a g红色粉末,在加热条件下通入足量氢气,充分反应后,冷却、称重,红色固体质量为x g。
①方案1中M可能是______(填字母,单选)。
a.稀硝酸 b.稀硫酸 c.浓硫酸 d.浓硝酸
②方案2中,当false______时,红色粉末全部是false。
(5)分析与讨论。
①CuO被false、false、CO等还原可能生成false或Cu,生成false的可能原因是______(填字母,双选)。
A.通入false量不足 B.false与CuO接触充分
C.温度较低 D.高度过高
②若缺少装置B,C中黑色粉末变红色,D中白色粉末变蓝色,不能肯定A中一定生成了false,理由是______。
17.(16分)CO是重要化工原料和清洁能源。
I.CO是一种常用的还原剂。一定条件下,反应false的速率方程为false(k为速率常数,只与温度、催化剂有关,与浓度无关)。某温度下,该反应在不同浓度下反应速率如下表所示:
false
false
反应速率
①
0.10
0.10
v
②
0.20
0.10
false
③
0.20
0.20
false
(1)根据表中测定结果,下列推断正确的是______(填字母,单选)。
A.false、false B.false、false C.false,false D.false,false
(2)改变下列一个条件,反应速率增大的是______(填字母,双选)。
A.降温 B.缩小体积 C.加入催化剂 D.减压
(3)其他条件不变,降低温度,k值______(填“增大”“减小”或“不变”,下同);其他条件不变,加入催化剂,k值______.
(4)一定温度下,在2L恒容密闭容器中投入x mol CO(g)和false,发生上述反应,经过t min达到平衡,CO的转化率为false。
①下列情况表明上述反应达到平衡状态的是______(填字母,单选)。
A.混合气体的密度保持不变 B.混合气体的摩尔质量保持不变
C.气体总压强保持不变 D.NO的消耗速率等于CO的消耗速率
②false间CO的平均速率false______.
③平衡时false______.
Ⅱ.CO是一种清洁能源。
(5)CO空气碱性燃料电池能量转化率高,电池反应为false。在______(填“正”或“负”)极区通入空气,写出负极反应式:______.
Ⅲ.CO是一种常用的化工原料。催化剂
(6)工业上,利用CO和false反应制备甲醇false。
已知:该反应的正反应是放热反应。下列图像符合上述反应中能量变化的是______(填“甲”或“乙”)。
18.(12分)F是一种皮革处理剂,一种合成F的流程如下:
回答下列问题:
(1)E所含官能团名称是______。
(2)A和C互为______(填“同系物”或“同分异构体”,下同);C与互为______。
(3)有机物B的名称是______;有机物D的结构简式为______。
(4)A和无机物X合成有机物B的反应类型是______。
(5)写出E→F的化学方程式:______。
(6)E不具有下列性质的是______(填代号,单选)。
a.能使溴水褪色
b.能使酸性高锰酸钾溶液褪色
c.能在热烧碱溶液中发生水解反应
d.在常温下能与false反应
19.(13分)一种从海水中提取金属镁和单质溴的主要步骤如下:
回答下列问题:
(1)试剂1属于氧化物,它是______,试剂2是______(填化学式)。
(2)操作A中常用玻璃棒,其作用是______,操作B是______(填操作名称)。
(3)溴蒸气通入二氧化硫的水溶液中,其离子方程式为______。
(4)设计简易实验证明溶液2含false:______。
(5)向溶液1中通入热空气的目的是______;向溶液2中通入氯气的反应中,氧化剂是______(填化学式)。
(6)工业上冶炼金属常用镁作还原剂。如高温下,镁置换false中U(铀),写出化学方程式:______。
2021年7月湖北省高一统一调研测试
化学参考答案
1.【答案】C
【解析】凯库勒提出苯的结构,法拉第最早发现苯。
2.【答案】B
【解析】天然气也是化工原料,A项错误;液氨汽化时要吸收大量热量,B项正确;人体没有纤维素水解酶,纤维素在人体内不能水解,故它不是基本营养物质,C项错误;氧化铁作红色颜料,磁性氧化铁呈黑色,D项错误。
3.【答案】C
【解析】二氧化氮与水反应生成硝酸和一氧化氮,NO是非电解质,A项错误;三氧化硫与水反应生成硫酸,B项错误;氯气与水反应生成HCl和HClO,HCl是强电解质,HClO是强氧化剂,C项正确;过氧化钠与水反应生成氢氧化钠和氧气,氧气是单质,D项错误。
4.【答案】A
【解析】简单氧离子false结构示意图为,A项错误;乙烯分子的空间填充模型为,B项正确;乙醇的同分异构体是二甲醚,结构简式为false,C项正确;中子数为7的碳原子的质量数为13,D项正确。
5.【答案】D
【解析】醋酸的酸性比碳酸强,用醋酸除去水垢,A项错误;四氧化三铁具有磁性,可指示方向,常
用于制造指南针,B项错误;HF溶液与false反应生成易挥发的false,C项错误;铝合金表面有氧化铝致密保护膜,铝合金耐腐蚀、密度小,D项正确。
6.【答案】C
【解析】电荷不守恒,A项错误;铜与false反应的离子方程式为false,B项错误;氨水吸收少量false,生成亚硫酸铵,离子方程式为2false,D项错误。
7.【答案】D
【解析】酯化反应是可逆反应,false为1mol,生成丙酸正丙酯分子小于1mol,A项错误;false,B项错误;酒精含水和乙醇,水和乙醇都与钠反应,C项错误;由反应式知,x molS参与反应时结合false,D项正确。
8.【答案】B
【解析】二氧化碳只含极性键,不含非极性键,A项错误;硝酸钾中氮和氧之间存在极性共价键,B项正确;上述反应中,硝酸钾、硫都作氧化剂,氮、硫被还原,C项错误;没有强调“标准状况”,不能根据氮气体积计算其物质的量,D项错误。
9.【答案】B
【解析】由图示知,中间产物、反应物、产物的能量依次降低,A项错误;观察图示知,总反应为化合反应,原子利用率为100%,是理想的绿色化学反应,B项正确;T是中间产物,C项错误;反应物是M和N,产物是Q,该总反应是化合反应,D项错误。
10.【答案】C
【解析】铁离子和硫氰根离子不能大量共存且生成的粒子显血红色,A项错误;酸性条件下高锰酸根离子氧化乙醇,B项错误;使酚酞变红色溶液呈碱性,在碱性条件下,亚铁离子、镁离子不能大量共存,D项错误。
11.【答案】D
【解析】观察图示知,铝电极为负极,铂电极为正极,负极发生氧化反应,A项正确;电流由正极经外电路流向负极,B项正确;铂极为正极,铝极为负极,false向负极迁移,C项正确;正极反应式为false,false,false,电池效率false,D项错误。
12.【答案】C
【解析】酒精和水都是液体,不能用过滤分离,A项错误;碳酸氢钠溶液是液体,试管口不能向下倾斜,B项错误;氨气极易溶于水,倒置的漏斗能防倒吸,C项正确;NO极易与空气中氧气反应,不能用排空气法收集NO,D项错误。
13.【答案】C
【解析】氮气分子存在三键,故R为氮,X为硅,Y为磷,Z为硫。硫化氢、磷化氢、硅烷的稳定性依次减弱,A项错误;硅、磷、硫、氮的原子半径依次减小,B项错误;磷酸是中强酸,C项正确;false在标准状况下是固体,D项错误。
14.【答案】C
【解析】氢氧化钠与氢氧化铝反应,实验室用氨水和硫酸铝溶液反应制备氢氧化铝,A项错误;丙烯醇中碳碳双键也能与酸性高锰酸钾溶液反应,B项错误;用丁达尔效应检验胶体和溶液,C项正确;铝片与浓硫酸发生钝化,使反应停止,D项错误。
15.【答案】D
【解析】a点未达到平衡,正反应速率大于逆反应速率,A项正确;b点达到平衡,正、逆反应速率相等,净反应速率等于零,B项正确;根据速率之比等于化学计量数之比知,X、Y、Z的化学计量数之比为false,最终反应体系中存在反应物和产物,说明它是可逆反应,C项正确; 达到平衡时Y消耗false,Y的转化率为40%,D错误。
16.【答案】(1)b
(2)吸收空气中水蒸气,避免干扰对生成水的检验
(3)false ad
(4)①b ②false
(5)①A、C ②乙醇蒸气能还原氧化铜
【解析】(1)钠与乙醇反应是放热反应,乙醇易挥发,氢气中混有乙醇蒸气,用无水氯化钙吸收乙醇蒸气,故试剂R为无水氯化钙。
(2)本实验检验氢气和氧化铜反应生成水,避免空气中水进入,故E装置吸收空气中水蒸气。
(3)乙醇与钠反应,从物质种类看,它是置换反应;从元素化合价看,它是氧化还原反应。置换反应一定是氧化还原反应;从能量变化看,它是放热反应。
(4)①方案1要求溶液M只与false反应,铜不干扰实验,故选择无氧化性酸,如稀硫酸。
②false,false,false。
(5)①氧化铜生成氧化亚铜,说明还原不充分,可以从反应物量、固体接触、温度等角度寻找可能原因。
②如果氢气中混有乙醇蒸气,会发生反应false。
17.【答案】(1)B
(2)B、C
(3)减小 增大
(4)①D ②false ③false
(5)正 false
(6)甲
【解析】(1)代入数据计算,得:false,false,选B。
(2)缩小体积,增大浓度,反应速率加快;加入催化剂,反应速率增大,故选BC。
(3)降低温度,速率减小,而浓度不变,速率常数减小;加入催化剂,速率增大,但是浓度不变,故速率常数增大。
(4)①混合气体总质量不变、体积不变,故密度始终不变,A项错误;气体总物质的量不变,气体摩尔质量不变,B项错误;该反应是气体分子数不变的反应,气体总物质的量不变,温度、体积不变,故气体压强不变,C项错误;消耗CO速率等于消耗NO速率,可以转化为消耗CO速率等于
生成CO速率,达到平衡,D项正确。
②false
③false,false。false
(5)在正极区充入空气,氧气发生还原反应;负极上CO被氧化生成碳酸盐。
(6)CO和氢气反应生成甲醇反应是放热反应,甲图像表明放热反应。
18.【答案】(1)碳碳双键、酯基
(2)同系物 同分异构体
(3)乙醇 false
(4)加成反应
(5)
(6)d
【解析】根据E的结构简式知,E水解生成丙烯酸false和乙醇。由此推知:无机物X为水,乙烯和水在催化剂作用下生成乙醇,B为乙醇。有机物D为丙烯酸。F为聚丙烯酸乙酯。
(1)丙烯酸乙酯含碳碳双键、酯基两种官能团。
(2)乙烯和丙烯互为同系物,丙烯与环丙烷互为同分异构体。
(4)乙烯和水反应是加成反应。
(5)E发生加聚反应类似乙烯加聚反应。
(6)E在催化剂、加热条件下与氢气发生加成反应。常温下,E与氢气不反应。
19.【答案】(1)CaO HCl
(2)搅拌,加快反应等 蒸馏
(3)false
(4)取少量溶液2于试管,滴加盐酸和false溶液,若产生白色沉淀,则溶液2含false
(5)吹出溴蒸气等合理答案 false
(6)false
【解析】(1)生石灰(或熟石灰)比烧碱价格低,工业上宜选择生石灰作海水中镁离子的沉淀剂。氢氧化镁与盐酸反应生成氯化镁。
(2)固体溶于溶液中,采用“溶解”,常用玻璃棒搅拌,增大固体接触面,加快反应。溴易挥发,采用蒸馏将溶液中溴蒸出来。
(3)氢溴酸是强酸,向二氧化硫的水溶液中通入溴蒸气,发生化学反应为false。
(4)用盐酸和氯化钡溶液检验硫酸根离子。
(5)溴的沸点较低,用热空气将液溴吹出来,被二氧化硫的水溶液吸收,达到富集溴的目的。氯气和溴化氢反应为false氯气是氧化剂,溴化氢是还原剂。
(6)镁置换四氟化铀中铀,生成氟化镁。
同课章节目录
