2020-2021学年高一化学人教版必修2第二章第三节第三课时 化学反应的限度课件 (32张ppt)
文档属性
| 名称 | 2020-2021学年高一化学人教版必修2第二章第三节第三课时 化学反应的限度课件 (32张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2021-07-07 07:47:23 | ||
图片预览










文档简介
(共32张PPT)
第2课时
化学反应的限度
第三节 化学反应的速率和限度
C+O2=CO2
C+CO2==2CO
Fe2O3+3CO==2Fe+3CO2
高温
阅读课本P50科学史话,了解炼铁高炉尾气之谜
可逆反应
启示:
化学反应是有限度的,有些反应是可逆的
高温
新课导入
情景导入-炼铁高炉尾气之谜
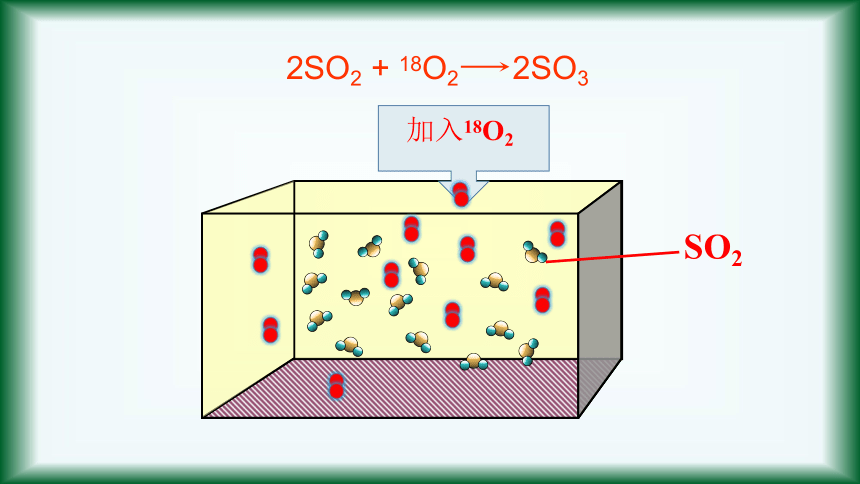
2SO2
+
18O2
2SO3
加入18O2
SO2
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词描述这个过程吗?
18O2
18O16O
S18O3
S16O3
S16O218O
S16O18O2
16O2
S16O2
一、【可逆反应】
1、定义
2、特点
同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.
同一条件,同时发生,同时存在(3同)
3、典例
所有化学反应都是可逆的,只是可逆程度大小不同而已;
有些反应在同一条件下逆反应程度很小,称为不可逆反应。
高温高压
催化剂
高温高压
催化剂
加热
N2+3H2
2NH3
SO2+O2
SO3
Cl2+H2O
HClO+HCl
H2
+l2
2Hl
CO2+H2O
H2CO3
NH3+H2O
NH3·H2O
针对训练
1、下列反应是否属于可逆反应?
(1)H2在O2中燃烧生成水与水电解产生H2与O2
(2)二次电池的放电与充电
(3)CO2和H2O在植物中通过光合作用合成糖
与糖在体内氧化生成CO2和H2O
(4)
CO2
+
H2O=H2CO3
与
H2CO3
=CO2
+
H2O
否
否
否
是
D
3.在密闭容器中进行反应X2(g)+Y2(g)
2Z(g),已知
X2、Y2
、Z的起始浓度分别为0.1
mol·L-1、0.2
mol·L-1、0.2
mol·L-1,在一定条件下,当反应达到平衡时,各物质
的浓度有可能是(
)
A.Z为0.3
mol·L-1
B.Y2为0.4
mol·L-1
C.X2为0.2
mol·L-1
D.Z为0.4
mol·L-1
A
X2:
(0-0.2
)
Y2:
(0.1-0.2)
Z:
(0-0.4)
X2(g)+Y2(g)
2Z(g)
始c
0.1
0.2
0.2
转c
0.1
0.1
0.2
平c
0
0.1
0.4
2Z(g)
X2(g)+Y2(g)
始c
0.2
0.1
0.2
转c
0.2
0.1
0.1
平c
0
0.2
0.3
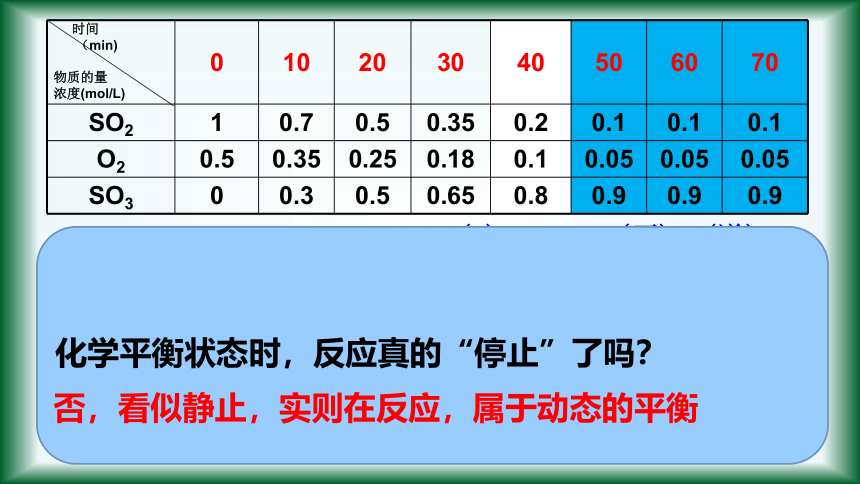
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
1、0时刻,反应物浓度
,正反应速率
;
生成物浓度
,逆反应速率
。
2、0-50时,反应物浓度
,正反应速率
;
生成物浓度
,逆反应速率
。
【典例】:某温度和压强下的密闭容器中,2SO2+O2
2SO3
△
催化剂
最大
为0
减小
增大
3、50以后,正反应速率
逆反应速率,且均
;
反应物浓度
,生成物浓度
。
等于
不变
最大
为0
减小
增大
不变
不变
v
t
●
v正
●
v逆
v正
v逆
v正=v逆
50
0
(1)0~50:v(正)>v(逆)
(2)50以后:v(正)=v(逆)
50以后反应处于平衡状态!
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
化学平衡状态时,反应真的“停止”了吗?
否,看似静止,实则在反应,属于动态的平衡
1、定义
二、【化学平衡】
在一定条件下的可逆反应里,正反应和逆反应的速率相等,
反应物与生成物浓度不再改变,达到表面上静止的一种“平
衡状态”,简称化学平衡状态
注意:化学平衡状态是给定条件下可逆反应所能完成的最大程度,即该反应进行的限度,此时反应物的转化率最大。
1、任何可逆反应在给定条件下都有一定的限度,不同反应的限度不同。
2、改变反应的条件可以在一定程度上改变一个反应的限度,即破坏化学平衡状态;
3、工业生产中,通过调控条件可以使反应更好地符合人们预期的结果。
2、特点
③动:
②等:
④定:
⑤变:
①逆:
动态平衡(v(正)=
v(逆)
≠0)
v(正)=
v(逆)
各组分的浓度和含量保持不变。
条件改变,原平衡被破坏,在新的条件
下建立新的平衡。
可逆反应
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
2、正误判断:
(1)化学反应进行的限度只与化学反应本身有关,与外界条件无关
(2)当某可逆反应在一定条件下达到反应限度时即达到了化学平衡
状态
(3)当某反应达到限度时,反应物和生成物的浓度一定相等。
(4)在一定条件下,向密闭容器中充入1
mol
N2和3
mol
H2
充分反应,达到平衡时N2、H2、NH3三者共存
针对训练
D
√
×
√
×
针对训练
三、【化学反应条件的控制】
阅读课本P51,思考:
1、生产生活中如何促进有利的反应?
2、生产生活中如何抑制有害的反应?
提高反应物的转化率、加快反应的速率
减缓反应的速率、减少甚至消除有害物质的产生、
控制副反应的发生
阅读课本P52,思考:如何提高煤的燃烧效率?
1、粉碎固体原料,以增大其与氧气的接触面,加快
反应速率,同时可以提高原料的利用率
2、空气过量有利于煤的充分燃烧,提高煤的利用率
3、炉膛应该用隔热、耐高温材料,减少热量的损失
4、废气中的热量可以加以利用,避免浪费
你知道燃煤脱硫的原理吗?
CaCO3
=
CaO
+CO2
↑
CaO
+
SO2
=
CaSO3
2CaSO3
+
O2
=
2CaSO4
高温
燃煤时加入氧化钙可以脱硫,但是不能解决温室效应
拓展视野
针对训练
阅读课本P53思考与交流:
1、加热能够加快化学反应速率
2、减缓或抑制橡胶和塑料老化的速率
3、隔绝空气和水,防止金属的腐蚀
4、使林木与火源隔离,防止火势扩大,利于灭火
5、硅胶可以吸水,防止食品、药品受潮变质
问题思考
重难突破【化学平衡的判断】
一定条件下,某容器中发生反应:N2(g)+3H2(g)
2NH3(g)
一段时间后,反应处于平衡状态,思考:
高温高压
催化剂
1、氮气的消耗速率与生成速率有何关系?
同一物质:
V正(N2
)
=V逆(N2
)
注意:非平衡状态的时候不具备以上关系
2、氮气的消耗速率与氢气的生成速率有何关系?
不同物质:
V逆(H2
)
=
1:3
V正(N2
)
方法小结
一、等速标志:
V正=
V逆
①同一物质的生成速率等于它的消耗速率
②不同物质的生成速率和消耗速率之比等于化学方程式的计量数之比。
【化学平衡的判断】
V正(H2)
=
V逆(H2)
V正(H2
)
V逆(N2
)
=
3:1
或
V正(H2)
=
3
V逆(N2)
针对训练
能说明反应
为平衡状态的为:
N2+3H2
2NH3
①V正(N2)
=
V逆(N2)
②
2V正(H2)=3V逆(NH3)
③
V正(N2)=2V逆(NH3)
④
3V正(N2)
=
V正(H2)
⑤单位时间内,每生成1molN2就生成2molNH3。
⑥单位时间内,每生成1molN2就生成3molH2。
⑦单位时间内,每断开1molN≡N键就形成3molH-H键。
⑧单位时间内,每断开1molN≡N键就形成6molN-H键。
√
√
√
×
×
√
×
×
问题思考
一定条件下,某容器中发生反应:N2(g)+3H2(g)
2NH3(g)
一段时间后,反应处于平衡状态,思考:
高温高压
催化剂
1、N2、H2、NH3的浓度、体积、物质的量、质量是否改变?
2、
N2、H2、NH3的体积分数、物质的量分数、质量分数是
否改变?
均保持不变
均保持不变
注意:非平衡状态的时候以上均为变量
二、变量不变:
①反应体系中各物质的浓度保持不变
②各组成成分的质量、质量分数、物质的量、物质的量分数、气体的体积及体积分数、分子数、反应物的转化率保持不变
方法小结
【化学平衡的判断】
针对训练
1、能说明反应
为平衡状态的为:
N2+3H2
2NH3
①H2的质量不变
②
NH3的浓度不变
③
N2的转化率不变
④
c(N2):c(H2):c(NH3)=
1:2:3
⑤
N2、H2
、NH3的浓度相等
⑥
H2的体积分数不变
⑦气体的总物质的量不变
⑧气体的总质量不变
√
×
√
√
√
√
×
×
2、以下条件能够证明下列反应处于平衡状态的是:
①恒温恒容的密闭容器,压强不再改变
②恒温恒压的密闭容器,体积不再改变
③绝热的密闭容器,温度不再改变
④
恒温恒容的密闭容器,混合气体的密度不变
⑤
恒温恒压的密闭容器,混合气体的密度不变
⑥
混合气体的平均摩尔质量(平均相对分子质量)不变
⑦混合气体的颜色不变
⑧混合气体的总质量不变
(1)
H2(g)
+
I2(g)
=
2
HI(g)
(2)
2SO2(g)
+
O2(g)
=
2
SO3(g)
(3)
2A(g)
+
B(s)
=
2
C(g)
(A、C均为无色气体)
③
⑦
①
②
③
⑤
⑥
③
④
⑤
⑥
⑧
归纳小结
【化学平衡的判断】方法小结
化学平衡的判断方法
同一物质
V正(A)
=
V逆(A)
等速标志
不同物质
变量不变
pV=nRT
恒温恒容,压强
恒温恒压,体积
V逆(B)
=
a
:
b
V正(A)
混合气体的密度
ρ=
V
m
混合气体的平均摩尔质量
(平均相对分子质量)
M
=
n
m
1、一定条件下,a
L密闭容器中放入1molN2和3molH2发生
N2
(g)
+3H2
(g)
?2NH3
(g)的反应,下列选项中能说明反应
已达到平衡状态的是(
)
A.c(N2):c(H2)比值不变
B.2v(H2)
=
3v(NH3)
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
C
典题训练
2、一定条件下,a
L密闭容器中放入2molN2和4molH2发生
N2
(g)
+3H2
(g)
?2NH3
(g)的反应,下列选项中能说明反应
已达到平衡状态的是(
)
A.c(N2)∶c(H2)比值不变
B.3v正(H2)
=
2v逆(NH3)
C.
N2、H2、NH3的浓度相等
D.混合气体的密度不再变化
A
对于反应:N2+3H2
2NH3,当N2和H2的物质的量之比不变的时候,反应一定处于平衡状态吗?
不一定
当N2和H2的起始充入量等于1:3时,不能判断平衡
当起始时仅充入NH3时,不能判断平衡;
当N2和H2的起始充入量不等于1:3时,能判断平衡
深入思考
3、一定条件下,a
L密闭容器中放入2mol
NH4HS发生
NH4HS(s)
NH3(g)
+
H2S(g)的反应,下列选项中能
说明反应已达到平衡状态的是(
)
A.NH3的体积分数不变
B.
NH3和
H2S的浓度相等
C.
混合气体的平均相对分子质量不变
D.混合气体的密度不再变化
D
4、一定条件下,a
L密闭容器中放入2mol
NH3
和3mol
H2S
发生NH3(g)
+
H2S(g)
NH4HS(s)
的反应,下列选项中不
能说明反应已达到平衡状态的是(
)
A.NH3的体积分数不变
B.
NH3和
H2S的浓度不变
C.
混合气体的总物质的量不变
D.混合气体的颜色不再变化
D
对于反应:NH4HS(s)
NH3(g)
+
H2S(g)
,当NH3和H2S的体积分数不变的时候,反应一定处于平衡状态吗?
不一定
当起始时仅充入NH4HS(s)时,不能判断平衡;
当起始时按1:1充入NH3(g)
和
H2S(g)时,不能判断平衡;
当起始时不按1:1充入NH3(g)
和
H2S(g)时,能判断平衡;
深入思考
第2课时
化学反应的限度
第三节 化学反应的速率和限度
C+O2=CO2
C+CO2==2CO
Fe2O3+3CO==2Fe+3CO2
高温
阅读课本P50科学史话,了解炼铁高炉尾气之谜
可逆反应
启示:
化学反应是有限度的,有些反应是可逆的
高温
新课导入
情景导入-炼铁高炉尾气之谜
2SO2
+
18O2
2SO3
加入18O2
SO2
2SO2
+
18O2
2SO3
S18O2
S16O18O
你能用一个化学专用名词描述这个过程吗?
18O2
18O16O
S18O3
S16O3
S16O218O
S16O18O2
16O2
S16O2
一、【可逆反应】
1、定义
2、特点
同一条件下,既能向正反应方向进行,同时又能向逆反应方向进行的反应.
同一条件,同时发生,同时存在(3同)
3、典例
所有化学反应都是可逆的,只是可逆程度大小不同而已;
有些反应在同一条件下逆反应程度很小,称为不可逆反应。
高温高压
催化剂
高温高压
催化剂
加热
N2+3H2
2NH3
SO2+O2
SO3
Cl2+H2O
HClO+HCl
H2
+l2
2Hl
CO2+H2O
H2CO3
NH3+H2O
NH3·H2O
针对训练
1、下列反应是否属于可逆反应?
(1)H2在O2中燃烧生成水与水电解产生H2与O2
(2)二次电池的放电与充电
(3)CO2和H2O在植物中通过光合作用合成糖
与糖在体内氧化生成CO2和H2O
(4)
CO2
+
H2O=H2CO3
与
H2CO3
=CO2
+
H2O
否
否
否
是
D
3.在密闭容器中进行反应X2(g)+Y2(g)
2Z(g),已知
X2、Y2
、Z的起始浓度分别为0.1
mol·L-1、0.2
mol·L-1、0.2
mol·L-1,在一定条件下,当反应达到平衡时,各物质
的浓度有可能是(
)
A.Z为0.3
mol·L-1
B.Y2为0.4
mol·L-1
C.X2为0.2
mol·L-1
D.Z为0.4
mol·L-1
A
X2:
(0-0.2
)
Y2:
(0.1-0.2)
Z:
(0-0.4)
X2(g)+Y2(g)
2Z(g)
始c
0.1
0.2
0.2
转c
0.1
0.1
0.2
平c
0
0.1
0.4
2Z(g)
X2(g)+Y2(g)
始c
0.2
0.1
0.2
转c
0.2
0.1
0.1
平c
0
0.2
0.3
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
1、0时刻,反应物浓度
,正反应速率
;
生成物浓度
,逆反应速率
。
2、0-50时,反应物浓度
,正反应速率
;
生成物浓度
,逆反应速率
。
【典例】:某温度和压强下的密闭容器中,2SO2+O2
2SO3
△
催化剂
最大
为0
减小
增大
3、50以后,正反应速率
逆反应速率,且均
;
反应物浓度
,生成物浓度
。
等于
不变
最大
为0
减小
增大
不变
不变
v
t
●
v正
●
v逆
v正
v逆
v正=v逆
50
0
(1)0~50:v(正)>v(逆)
(2)50以后:v(正)=v(逆)
50以后反应处于平衡状态!
时间
(min)
物质的量
浓度(mol/L)
0
10
20
30
40
50
60
70
SO2
1
0.7
0.5
0.35
0.2
0.1
0.1
0.1
O2
0.5
0.35
0.25
0.18
0.1
0.05
0.05
0.05
SO3
0
0.3
0.5
0.65
0.8
0.9
0.9
0.9
化学平衡状态时,反应真的“停止”了吗?
否,看似静止,实则在反应,属于动态的平衡
1、定义
二、【化学平衡】
在一定条件下的可逆反应里,正反应和逆反应的速率相等,
反应物与生成物浓度不再改变,达到表面上静止的一种“平
衡状态”,简称化学平衡状态
注意:化学平衡状态是给定条件下可逆反应所能完成的最大程度,即该反应进行的限度,此时反应物的转化率最大。
1、任何可逆反应在给定条件下都有一定的限度,不同反应的限度不同。
2、改变反应的条件可以在一定程度上改变一个反应的限度,即破坏化学平衡状态;
3、工业生产中,通过调控条件可以使反应更好地符合人们预期的结果。
2、特点
③动:
②等:
④定:
⑤变:
①逆:
动态平衡(v(正)=
v(逆)
≠0)
v(正)=
v(逆)
各组分的浓度和含量保持不变。
条件改变,原平衡被破坏,在新的条件
下建立新的平衡。
可逆反应
1.可逆反应达到平衡的重要特征( )
A.反应停止了
B.正、逆反应速率都为零
C.反应物和生成物的浓度相等
D.正、逆反应的速率相等
2、正误判断:
(1)化学反应进行的限度只与化学反应本身有关,与外界条件无关
(2)当某可逆反应在一定条件下达到反应限度时即达到了化学平衡
状态
(3)当某反应达到限度时,反应物和生成物的浓度一定相等。
(4)在一定条件下,向密闭容器中充入1
mol
N2和3
mol
H2
充分反应,达到平衡时N2、H2、NH3三者共存
针对训练
D
√
×
√
×
针对训练
三、【化学反应条件的控制】
阅读课本P51,思考:
1、生产生活中如何促进有利的反应?
2、生产生活中如何抑制有害的反应?
提高反应物的转化率、加快反应的速率
减缓反应的速率、减少甚至消除有害物质的产生、
控制副反应的发生
阅读课本P52,思考:如何提高煤的燃烧效率?
1、粉碎固体原料,以增大其与氧气的接触面,加快
反应速率,同时可以提高原料的利用率
2、空气过量有利于煤的充分燃烧,提高煤的利用率
3、炉膛应该用隔热、耐高温材料,减少热量的损失
4、废气中的热量可以加以利用,避免浪费
你知道燃煤脱硫的原理吗?
CaCO3
=
CaO
+CO2
↑
CaO
+
SO2
=
CaSO3
2CaSO3
+
O2
=
2CaSO4
高温
燃煤时加入氧化钙可以脱硫,但是不能解决温室效应
拓展视野
针对训练
阅读课本P53思考与交流:
1、加热能够加快化学反应速率
2、减缓或抑制橡胶和塑料老化的速率
3、隔绝空气和水,防止金属的腐蚀
4、使林木与火源隔离,防止火势扩大,利于灭火
5、硅胶可以吸水,防止食品、药品受潮变质
问题思考
重难突破【化学平衡的判断】
一定条件下,某容器中发生反应:N2(g)+3H2(g)
2NH3(g)
一段时间后,反应处于平衡状态,思考:
高温高压
催化剂
1、氮气的消耗速率与生成速率有何关系?
同一物质:
V正(N2
)
=V逆(N2
)
注意:非平衡状态的时候不具备以上关系
2、氮气的消耗速率与氢气的生成速率有何关系?
不同物质:
V逆(H2
)
=
1:3
V正(N2
)
方法小结
一、等速标志:
V正=
V逆
①同一物质的生成速率等于它的消耗速率
②不同物质的生成速率和消耗速率之比等于化学方程式的计量数之比。
【化学平衡的判断】
V正(H2)
=
V逆(H2)
V正(H2
)
V逆(N2
)
=
3:1
或
V正(H2)
=
3
V逆(N2)
针对训练
能说明反应
为平衡状态的为:
N2+3H2
2NH3
①V正(N2)
=
V逆(N2)
②
2V正(H2)=3V逆(NH3)
③
V正(N2)=2V逆(NH3)
④
3V正(N2)
=
V正(H2)
⑤单位时间内,每生成1molN2就生成2molNH3。
⑥单位时间内,每生成1molN2就生成3molH2。
⑦单位时间内,每断开1molN≡N键就形成3molH-H键。
⑧单位时间内,每断开1molN≡N键就形成6molN-H键。
√
√
√
×
×
√
×
×
问题思考
一定条件下,某容器中发生反应:N2(g)+3H2(g)
2NH3(g)
一段时间后,反应处于平衡状态,思考:
高温高压
催化剂
1、N2、H2、NH3的浓度、体积、物质的量、质量是否改变?
2、
N2、H2、NH3的体积分数、物质的量分数、质量分数是
否改变?
均保持不变
均保持不变
注意:非平衡状态的时候以上均为变量
二、变量不变:
①反应体系中各物质的浓度保持不变
②各组成成分的质量、质量分数、物质的量、物质的量分数、气体的体积及体积分数、分子数、反应物的转化率保持不变
方法小结
【化学平衡的判断】
针对训练
1、能说明反应
为平衡状态的为:
N2+3H2
2NH3
①H2的质量不变
②
NH3的浓度不变
③
N2的转化率不变
④
c(N2):c(H2):c(NH3)=
1:2:3
⑤
N2、H2
、NH3的浓度相等
⑥
H2的体积分数不变
⑦气体的总物质的量不变
⑧气体的总质量不变
√
×
√
√
√
√
×
×
2、以下条件能够证明下列反应处于平衡状态的是:
①恒温恒容的密闭容器,压强不再改变
②恒温恒压的密闭容器,体积不再改变
③绝热的密闭容器,温度不再改变
④
恒温恒容的密闭容器,混合气体的密度不变
⑤
恒温恒压的密闭容器,混合气体的密度不变
⑥
混合气体的平均摩尔质量(平均相对分子质量)不变
⑦混合气体的颜色不变
⑧混合气体的总质量不变
(1)
H2(g)
+
I2(g)
=
2
HI(g)
(2)
2SO2(g)
+
O2(g)
=
2
SO3(g)
(3)
2A(g)
+
B(s)
=
2
C(g)
(A、C均为无色气体)
③
⑦
①
②
③
⑤
⑥
③
④
⑤
⑥
⑧
归纳小结
【化学平衡的判断】方法小结
化学平衡的判断方法
同一物质
V正(A)
=
V逆(A)
等速标志
不同物质
变量不变
pV=nRT
恒温恒容,压强
恒温恒压,体积
V逆(B)
=
a
:
b
V正(A)
混合气体的密度
ρ=
V
m
混合气体的平均摩尔质量
(平均相对分子质量)
M
=
n
m
1、一定条件下,a
L密闭容器中放入1molN2和3molH2发生
N2
(g)
+3H2
(g)
?2NH3
(g)的反应,下列选项中能说明反应
已达到平衡状态的是(
)
A.c(N2):c(H2)比值不变
B.2v(H2)
=
3v(NH3)
C.单位时间内1个N≡N键断裂的同时,有6个N-H键断裂
D.单位时间消耗0.1molN2的同时,生成0.2molNH3
C
典题训练
2、一定条件下,a
L密闭容器中放入2molN2和4molH2发生
N2
(g)
+3H2
(g)
?2NH3
(g)的反应,下列选项中能说明反应
已达到平衡状态的是(
)
A.c(N2)∶c(H2)比值不变
B.3v正(H2)
=
2v逆(NH3)
C.
N2、H2、NH3的浓度相等
D.混合气体的密度不再变化
A
对于反应:N2+3H2
2NH3,当N2和H2的物质的量之比不变的时候,反应一定处于平衡状态吗?
不一定
当N2和H2的起始充入量等于1:3时,不能判断平衡
当起始时仅充入NH3时,不能判断平衡;
当N2和H2的起始充入量不等于1:3时,能判断平衡
深入思考
3、一定条件下,a
L密闭容器中放入2mol
NH4HS发生
NH4HS(s)
NH3(g)
+
H2S(g)的反应,下列选项中能
说明反应已达到平衡状态的是(
)
A.NH3的体积分数不变
B.
NH3和
H2S的浓度相等
C.
混合气体的平均相对分子质量不变
D.混合气体的密度不再变化
D
4、一定条件下,a
L密闭容器中放入2mol
NH3
和3mol
H2S
发生NH3(g)
+
H2S(g)
NH4HS(s)
的反应,下列选项中不
能说明反应已达到平衡状态的是(
)
A.NH3的体积分数不变
B.
NH3和
H2S的浓度不变
C.
混合气体的总物质的量不变
D.混合气体的颜色不再变化
D
对于反应:NH4HS(s)
NH3(g)
+
H2S(g)
,当NH3和H2S的体积分数不变的时候,反应一定处于平衡状态吗?
不一定
当起始时仅充入NH4HS(s)时,不能判断平衡;
当起始时按1:1充入NH3(g)
和
H2S(g)时,不能判断平衡;
当起始时不按1:1充入NH3(g)
和
H2S(g)时,能判断平衡;
深入思考
